- Elvitegravir
-
Elvitégravir
Elvitégravir 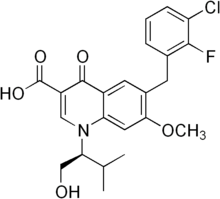
Général Nom IUPAC 6-(3-chloro-2-fluorobenzyl) -1-[(2S)-1hydroxy-3-methylbutan-2-yl]-7 -methoxy-4-oxo-1,4-dihydroquinoline -3-carboxylic acid Synonymes Propriétés chimiques Formule brute C23H23ClFNO5 [Isomères] Masse molaire 447,884 g∙mol-1
C 61,68 %, H 5,18 %, Cl 7,92 %, F 4,24 %, N 3,13 %, O 17,86 %,Classe thérapeutique Antirétroviral : Inhibiteur d'intégrase Considérations thérapeutiques Voie d’administration Orale Unités du SI & CNTP, sauf indication contraire. L'elvitégravir est une molécule de la classe des anti-intégrase destinée à combattre le VIH, développée par Japan Tobacco sous le nom de code JTK-303 et licenciée à Gilead Sciences pour une commercialisation dans le monde entier, Japon excepté. Il s'agit d'un inhibiteur de transfert de brins (INtegrase Strand Transfer Inhibitor, INSTI).
Sommaire
Dosage et effets secondaires
Elle est utilisée en association avec du ritonavir (en tant que booster). La dose quotidienne prévue est d'une fois 150 mg (ou 85 mg si le médicament est pris en même temps que du lopinavir ou de l'atazanavir)[1].
Actuellement en essais cliniques de phase III, elle ne semble pas provoquer d'effets secondaires[2]. Elle offre malheureusement un profil de résistance similaire à celui du raltégravir. Les avantages par rapport à cette dernière molécule seraient sa capacité à passer la barrière du cerveau, amoindrissant la charge virale dans le système nerveux central, et la monoprise quotidienne.
Efficacité et disponibilité
La baisse de la charge virale obtenue avec une trithérapie comprenant de l'elvitégravir est plus rapide qu'avec une trithérapie contenant un inhibiteur de protéase comme le Kaletra (lopinavir+ritonavir)[3].
Elle est actuellement disponible en ATU pour les patients ne disposant pas d'alternative (salvage therapy). Aucun essai pour les patients naïfs de traitement antirétroviral n'est prévu à ce jour. 700 patients prétraités sur les 1400 que compteront deux études menées pour la première aux États-Unis et à Porto Rico, pour la seconde au Canada, en Europe et en Australie (essai GS 183 0145[4]), pourront bénéficier de la nouvelle molécule, comparée au raltégravir.
Divers
Le nom de code de développement chez Gilead est GS 9137; le médicament peut également être noté EVG/r (elvitégravir+ritonavir).
Gilead mène également des recherches sur le GS 9350[5], un agent de remplacement pour le ritonavir; il est actuellement en essais cliniques de phase II. Si ce produit rencontrait du succès dans son développement, on pourrait voir arriver sur le marché une pilule combinant elvitégravir, GS 9350, ténofovir et emtricitabine, permettant tout comme l'Atripla® le propose une multithérapie en monoprise quotidienne[6], simplifiant grandement le traitement du VIH.
Références
- ↑ Gilead lance l’essai clinique de phase III de l’elvitegravir, un inhibiteur investigationnel de l’intégrase du VIH sur actions-traitements.org
- ↑ Fiche de l'elvitégravir sur aidsmeds.com (en) : However, in the 278-patient study, side effects after 16 weeks of treatment were similar in the elvitegravir groups and the control group, meaning that no additional short-term side effects associated with elvitegravir use were documented.
- ↑ Derek Thaczuk et Michael Carter : (en) ICAAC: Best response to elvitegravir seen when used with T-20 and other active agents sur Aidsmap.com.
- ↑ GS 183 0145, essai Gilead sur actupparis.org
- ↑ (en) GS 9350 Gilead now testing ritonavir replacement in human studies sur actions-traitements.org
- ↑ (en) Gilead's goal is to develop and bring to market a pharmacokinetic enhancer that does not have HIV activity, can be dosed once daily, is in solid form and is stable at room temperature, such that it can be co-formulated with elvitegravir and Truvada (emtricitabine and tenofovir disoproxil fumarate) into a single tablet sur hivandhepatitis.com
- Portail de la pharmacie
Catégories : Composé du fluor | Antirétroviral
Wikimedia Foundation. 2010.