- Abacavir
-
 Pour les articles homonymes, voir ABC.
Pour les articles homonymes, voir ABC.Abacavir 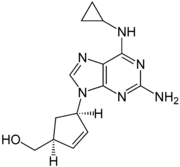
Représentations plane de l'abacavir Général Nom IUPAC [(1S,4R)-4-[2-amino-6-(cyclopropylamino)-9H-purin-9-yl]cyclopent-2-ényl]méthanol Synonymes ABC No CAS Code ATC AF06 DrugBank PubChem SMILES InChI Propriétés chimiques Formule brute C14H18N6O [Isomères] Masse molaire[1] 286,3323 ± 0,014 g·mol-1
C 58,73 %, H 6,34 %, N 29,35 %, O 5,59 %,Propriétés physiques T° fusion 165 °C Classe thérapeutique Antiviral • Antirétroviral • Inhibiteur nucléosidique de la transcriptase inverse Données pharmacocinétiques Biodisponibilité 83 % Liaison protéique Proche de 50 % Métabolisme Hépatique Demi-vie d’élim. 1,54 ± 0,63 heures Considérations thérapeutiques Voie d’administration Orale Grossesse Contre-indiquée Unités du SI & CNTP, sauf indication contraire.  Abacavir
Abacavir
Noms commerciaux :
Ziagen® (Belgique, France, Suisse)Classe :
AntiviralAutres informations :
Sous classe :L'abacavir (ABC) est un inhibiteur très puissant de la transcriptase inverse, pour le traitement de l'infection à VIH. L'ABC est capable de franchir la barrière sang-cerveau. Il est plutôt bien toléré ; le principal effet secondaire est une réaction d'hypersensibilité[Laquelle ?], qui peut être dangereuse.
Les souches résistantes à l'AZT ou au 3TC sont généralement sensibles à l'abacavir, tandis que celles résistantes à l'AZT et au 3TC ne sont pas très sensibles à l'abacavir. L'abacavir est donné per os et a une grande biodisponibilité (83 %). Il est principalement métabolisé par la déshydrogénase alcoolique qui transforme l'alcool primaire en 5' en acide carboxylique ou la gluconyl transférase.
Le médicament est commercialisé sous la marque Ziagen (GlaxoSmithKline) et comme association Trizivir (GlaxoSmithKline) et Kivexa (GlaxoSmithKline).
Effets secondaires
Dans 5 à 10 % des cas, survient dans les semaines après l'introduction du médicament un syndrome d'hypersensibilité comportant une fièvre, une éruption cutanée, un essoufflement, des symptômes digestifs, le tout imposant l'arrêt du traitement et totalement réversible alors[2]. Cette réaction semble étroitement en rapport avec la présence de l'allèle HLA-B*5701[3].
Il existe également un risque augmenté de faire un infarctus du myocarde chez les patients traités[4].
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Hetherington S, McGuirk S, Powell G, et als. Hypersensitivity reactions during therapy with the nucleoside reverse transcriptase inhibitor abacavir, Clin Ther, 2001;23:1603-1614
- allal S, Phillips E, Carosi G et Als. HLA-B*5701 screening for hypersensitivity to Abacavir, N Eng J Med, 2008:358:568-579
- D:A:D Study Group, Use of nucleoside reverse transcriptase inhibitors and risk of myocardial infarction in HIV-infected patients enrolled in the D:A:D study: a multi-cohort collaboration, Lancet, 2008;371:1417-1426
- Antiretroviral Therapy-Investigational NRTIs: HIV Clinical Management Vol. 3. Medscape Inc, 1998
- HIV Insite Antiretroviral Drug Database; UC Regents, 1999
Wikimedia Foundation. 2010.

