- Lamivudine
-
Lamivudine 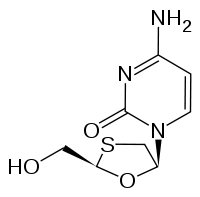
Général Nom IUPAC (2R,5S)-(–)-4-amino-1-[2-(hydroxymethyl)-1,3 -oxathiolan-5-yl]-1H-pyrimidin-2-one Synonymes 3TC No CAS (2R,5S) (–) Code ATC AF05 DrugBank PubChem Propriétés chimiques Formule brute C8H11N3O3S [Isomères] Masse molaire[1] 229,256 ± 0,014 g·mol-1
C 41,91 %, H 4,84 %, N 18,33 %, O 20,94 %, S 13,99 %,Données pharmacocinétiques Biodisponibilité 86% Liaison protéique inférieure à 36 % Métabolisme Rénal (environ 70 % recouvré inchangé. Le principal métabolite est la S-oxythiacytidine) Demi-vie d’élim. 5 à 7 h Excrétion Urinaire Considérations thérapeutiques Voie d’administration Orale, IV Unités du SI & CNTP, sauf indication contraire. La lamivudine (2',3'-didéoxy-3'-thiacytidine, 3TC) est un puissant inhibiteur de la transcriptase inverse commercialisé sous le nom de Epivir. Elle peut inhiber les deux types (1 et 2) de transcriptase inverse de VIH ainsi que celle du virus de l'hépatite B. Pour qu'elle devienne active, il faut qu'elle soit phosphorylée sous sa forme triphosphate. Le triphosphate de 3TC inhibe ainsi l'ADN polymérase cellulaire. Elle est actuellement le médicament antirétroviral le plus utilisé, prescrit pratiquement systématiquement, et ceci depuis son introduction dans la trithérapie en 1995-1996, années où la mortalité due au Sida a chuté considérablement.
La lamivudine est administrée par voie orale, et elle est rapidement absorbée avec une bio-disponibilité supérieure à 80 %. Diverses recherches tendent à montrer que la lamivudine peut passer la barrière hémato-encéphalique. Elle est souvent utilisée en combinaison avec la zidovudine. Ces deux antiretroviraux agissent de manière synergétique. Il a été montré que le traitement par la Lamivudine restaure la sensibilité à la zidovudine chez les personnes devenues résistantes au VIH.
Une mutation (M184V) du VIH lui permet d’acquérir une résistance à la lamivudine. Toutefois, de façon générale, il est conseillé de poursuivre le traitement au 3TC même si cela se produit, cette mutation semble produire un virus se répliquant moins efficacement et restant encore contrôlé par la lamivudine. Par exemple des études ont montré qu'une monothérapie de 3TC permet une meilleure évolution clinique et immunologique qu'un arrêt thérapeutique chez les patients séropositifs précédemment sous trithérapie dont le virus était devenu résistant à la lamivudine[2]. Dans le cas d'une trithérapie, sans autre mutation constaté, le virus muté reste sensible à d'autre molécules. De nombreux tests de mutagénicité montrent que la lamivudine ne présente pas d'activité mutagène aux doses thérapeutiques.
La lamivudine a été utilisée pour le traitement de l'hépatite B chronique à une dose plus faible que l'utilisation que pour le traitement de l'infection à VIH. Il améliore la séroconversion de l'antigène e positif de l'hépatite B, et aussi la mise en scène histologie du foie. Une utilisation à long terme de la lamivudine conduit au développement d'un virus résistant de l'hépatite B (YMDD) par mutation. Malgré cela, la lamivudine est encore largement utilisée tant elle est bien tolérée.
Historique
La lamivudine a été découverte par screening en 1989 par Bernard Belleau et Nghe Nguyen-Ga.
Les travaux de l'équipe du médecin-chercheur Lorne Tyrrell de l'Université de l'Alberta, Canada, ont montré que le Lamivudine était un traitement efficace contre l'hépatite B[3].
La synthèse de novo est réalisée en milieu totalement anhydre, à cause de la sensibilité de l'acétal soufré formé aux acides aqueux. Celle-ci peut être résumée par le schéma suivant[4] :

Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Lamivudine monotherapy in HIV-1-infected patients harbouring a lamivudine-resistant virus: a randomized pilot study (E-184V study).
- Découverte de Lorne Tyrrell
- Method and compositions for the synthesis of BCH-189
Catégories :- Antirétroviral
- Oxathiolane
- Pyrimidone
- Amine
Wikimedia Foundation. 2010.
