- Peste Blanche
-
Tuberculose
Tuberculose
Classification et ressources externesCIM-10 A15-A19 CIM-9 010-018 La tuberculose est une maladie infectieuse transmissible et non immunisante, avec des signes cliniques variables. Elle est provoquée par une mycobactérie du complexe tuberculosis correspondant à différents germes et principalement Mycobacterium tuberculosis (ou Bacille de Koch ; BK).
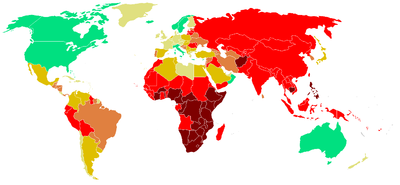
Autrefois soignée dans les sanatoriums, par des cures de soleil et plein air, elle a été réduite par les antibiotiques dans les années 1950, mais elle connaît un regain expliqué par l'apparition de souches multi-résistantes, ce qui explique que la maladie tue encore près de deux millions de personnes chaque année dans le monde (plus de 1,7 million de victimes en 2004 selon l'OMS).
La tuberculose pulmonaire (phtisie) est de loin la plus fréquente et la plus répandue, mais il existe des atteintes osseuses (mal de Pott, tumeur blanche du genou...), rénales, intestinales, génitales, méningées, cutanées (tuberculomes).
Sommaire
Historique
La tuberculose a été isolée d'autres maladies pulmonaires par Laennec en 1819. En 1839, le médecin allemand Schönlein a réuni en une description unifiée ses manifestations cliniques disparates, et lui a donné son nom définitif.
En 1865, le médecin Jean-Antoine Villemin après avoir prouvé par la méthode expérimentale la transmission de la tuberculose a pu affirmer que cette maladie, de nature jusqu'alors inconnue, était due à un microbe invisible avec les moyens techniques de l'époque. Il a conclu qu'on pouvait donc s'en protéger par des mesures visant à éviter la contagion.
Enfin, à la suite des travaux de Pasteur, c'est un médecin allemand, Robert Koch, qui découvre le bacille, en 1882 : à ce moment, la tuberculose était en Europe la cause d'un décès sur sept.
Les bacilles de la tuberculose existaient il y a trois millions d'années, alors que les précédentes estimations tablaient sur une apparition datant seulement de 35 000 ans. La souche originelle serait apparue en Afrique de l'Est, considérée comme le berceau de l'humanité. La maladie serait donc aussi vieille que l'humanité et son expansion à travers le monde serait intimement liée à celle de l'homme. Ce serait l'homme qui aurait transmis la maladie à ses animaux domestiques ou commensaux et non l'inverse.
Le complexe tuberculosis serait constitué de deux lignées évolutives différentes[1],[2], la première n'infectant que l'Homo sapiens, la seconde qui serait d'origine animale pouvant aussi infecter l'être humain, mais affectant surtout d'autres mammifères (bovins, caprins, rongeurs…).
Des modèles statistiques bayésiens appuyés sur l'étude de marqueurs génétiques hypervariables (MIRU) laissent penser que le complexe tuberculosis actuel aurait 40 000 ans, c'est-à-dire qu'il serait apparu lors des migrations humaines hors d'Afrique, mais ce n'est qu'il y a environ 10 000 ans, probablement en Mésopotamie lors du processus de domestication animale qu'il se serait diversifié.
Épidémiologie
Le nombre annuel de nouveaux cas dans le monde, incluant les cas de rechute, est d'environ 5,4 millions (2006), occasionnant environ un million de décès[3]. Selon l'Organisation mondiale de la santé (OMS) :
- de 5 à 10 % des sujets infectés développent la maladie ou deviennent contagieux au cours de leur existence.
La plupart des nouveaux cas (49%) se situent dans les zones peuplées d'Asie : Bangladesh, Pakistan, Inde, Chine et Indonésie. Il existe une augmentation dans les pays de l'Europe de l'Est (incluant la Russie)[4]. La croissance reste très forte en Afrique, avec près de 13 % contre moins de 1 % dans les pays asiatiques.
Elle est fréquente chez les utilisateurs de drogues par intraveineuse et porteurs du VIH, son incidence pouvant atteindre alors près de 10 %[5].
Il s'agit essentiellement d'une infection touchant l'adulte jeune, et les hommes sont près de deux fois plus atteints que les femmes.
La malnutrition et les intoxications médicamenteuses sont des causes reconnues de l'augmentation du nombre de cas.
La résistance aux médicaments anti-tuberculeux classiques reste rare (environ 4 % des nouveaux cas) mais atteint 10 % dans certains pays de l'Europe de l'Est[6]. Ce taux augmente très sensiblement en cas d'antécédent de tuberculose précédemment traité. La résistance aux médicaments anti-tuberculeux de seconde ligne reste rare mais a une très forte mortalité dans un délai court[7]. Le nombre de cette dernière forme tend cependant à augmenter (notamment assez fortement en Russie) et à s'étendre géographiquement. Il tend, au contraire, à se stabiliser dans les pays baltiques et à diminuer aux États-Unis[8].
La tuberculose mérite triplement son qualificatif de "maladie sociale" :
- sa fréquence dans une communauté est un bon indice du degré d'évolution sociale de celle-ci. Les facteurs principaux de diminution de la tuberculose sont les conditions de nutrition, d'habitat, d'hygiène et d'éducation sanitaire.
- la prévention de la tuberculose nécessite, pour être efficace, un équipement médical et une organisation sociale bien développés.
- les principales victimes sont des adultes jeunes subissant une longue invalidité, vu l'évolution lente et la nécessité d'un traitement efficace.
En 2003, le nombre de malades de la tuberculose a diminué de 30 % en Chine (la Chine est encore le deuxième pays le plus touché au monde après l'Inde) grâce au traitement de brève durée sous surveillance directe (DOTS) de l'OMS, le seul réellement efficace à ce jour, mais qui avait peine à s'imposer dans le monde. À la fin de 2006, le nombre de cas dans tout le Congo était estimé à 80 000, contre 60 000 en 2002. Malgré le soutien des organisations internationales, la situation s'aggrave de par la pauvreté, mais aussi de l'insécurité et des combats, qui poussent les gens à se déplacer, d'où plus de contamination. Le traitement repose sur des mesures de prévention individuelle et collective, ainsi que sur un traitement rigoureux et complet des sujets malades :
- engagement des pouvoirs publics à prévenir la tuberculose en améliorant la disponibilité des commodités de base : eau, nourriture, hygiène, habitat;
- dépistage de la tuberculose par examen microscopique des frottis chez les sujets qui présentent des symptômes;
- approvisionnement régulier en médicaments antituberculeux;
- traitement antibiotique sous surveillance pendant une durée suffisante (plusieurs mois) ;
- systèmes de notification pour vérifier l'action du traitement et les résultats du programme.
Manifestations cliniques
Tuberculose pulmonaire
Découverte fortuite
La réalisation d'une intradermoréaction permet de dépister les personnes dont l'organisme héberge le bacille de Koch avant les manifestations cliniques de la maladie en l'absence de vaccination par le BCG. En effet ce dernier positivise le test, le rendant non interprétable en ce sens.
L'interprétation d'une intradermoréaction est purement fondée sur la taille de l'induration et non pas sur la présence d'un érythème.
L'intradermoréaction pour la tuberculose porte aussi le nom de test Mantoux.
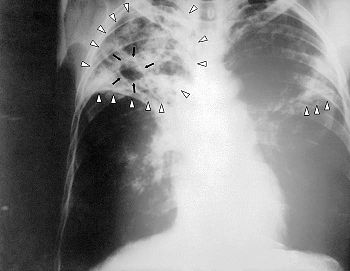
Une radiographie des poumons recherchera des signes radiologiques.
Une recherche de contamination dans l'entourage familial et professionnel est indispensable.
Signes cliniques
Les symptômes sont un fébricule (38–38,5 °C) au long cours, une toux quelquefois accompagnée d'hémoptysie, un amaigrissement de 5 à 10 kg survenant en quelques mois et des sueurs nocturnes. Une intradermoréaction (IDR) positive à la tuberculine. Les facteurs de risque sont la malnutrition, l'immunodépression, la toxicomanie intraveineuse, l'absence de domicile fixe, le contact direct avec des personnes infectées et certaines professions de santé.
Signes radiologiques
- Radio du thorax : classiquement, atteinte des apex (extrémité supérieure des poumons) avec, dans une tuberculose évoluée, des cavernes (cavités dans le tissu pulmonaire, contenant de l'air et de nombreux BK, cette bactérie étant en effet aérobie). Ces cavernes ne disparaissent pas à la guérison ; elles se calcifient et produisent des séquelles radiologiques autrefois appelées « taches au poumon ».
Tuberculose extra pulmonaire
Le plus souvent par dissémination hématogène
Tuberculose rénale
Péricardite tuberculeuse
Tuberculose génitale
Femme
Circonstances de découverte
- Aménorrhée
- Infertilité
Tuberculose osseuse
- spondylodiscite tuberculeuse ou mal de Pott
- tumeur blanche du genou
- spina ventosa
Tuberculose ganglionnaire
- Ganglion lymphatique Organe ovalaire entouré par une capsule fibreuse sous laquelle on identifie le sinus lymphatique sous capsulaire. Deux zones distinctes sont présentes :
- la corticale où se différencient les follicules lymphoïdes,
- la médullaire, peu visible ici, renfermant le réseau vasculaire.
- Lésion Sur le plan de coupe, ce ganglion renferme de multiples lésions nodulaires correspondant aux follicules tuberculeux (Fig. a). Au sein d'un même ganglion, plusieurs lésions tuberculeuses peuvent s'observer :
- Lésion folliculaire (Fig. a) : foyer arrondi formé de cellules géantes et de cellules épithélioïdes, entouré d'une couronne de lymphocytes. Les cellules géantes sont des cellules plurinucléées, au cytoplasme abondant faiblement éosinophile (Fig. b) (h). Les cellules épithélioïdes sont des cellules allongées, aux limites cytoplasmiques mal visibles et au noyau allongé en semelle de chaussure (Fig. b) (t).
- Lésion caséofibreuse (Fig. c) : nécrose centrale éosinophile anhiste : nécrose caséeuse (h) cernée par une coque fibreuse.
- Lésion caséofolliculaire : foyer centré par une plage de nécrose caséeuse, entourée par des cellules épithélioïdes, des cellules géantes et une couronne de lymphocytes. La présence de bacilles de Koch peut être révélée sur la coloration de Ziehl Neelsen (Fig. d)
- Diagnostic Tuberculose ganglionnaire.
Méningite tuberculeuse
Elle survient surtout chez les patients immigrés, les immunodéprimés, et peut se rencontrer aussi chez les patients éthyliques chroniques et les personnes âgées. Le début est plus progressif qu'une méningite bactérienne. La ponction lombaire retrouve un LCR (Liquide céphalo-rachidien) lymphocytaire hypoglycorachique. Une recherche du génome bactérien par PCR sur le LCR peut parfois rapidement confirmer le diagnostic, sinon la culture (au minimum 3 semaines) peut retrouver le bacille de Koch[9].
La quantité des cas de meningite tuberculeuse apparus dans les enfants de moins de 5 ans d'une population sert á connaitre la couverture par le vaccin BCG.
Diagnostic
Il repose sur l'identification du germe, soit à l'examen direct d'un échantillon (expectoration) au microscope, soit après mise en culture de ce même échantillon. Cette dernière procédure est cependant longue (plusieurs semaines), ce qui retarde d'autant le diagnostic. Elle permet d'effectuer un antibiogramme (test de la sensibilité du germe à différents antibiotiques).
La détection de certains gènes de la mycobactérie après amplification PCR semble être prometteuse avec cependant un coût plus important[10].
La tuberculose peut être causée par différents germes :
- Mycobacterium tuberculosis (bacille de Koch), le plus fréquent
- Mycobacterium bovis
- Mycobacterium africanum
- Mycobacterium canetti (essentiellement à Djibouti)
Le test à la tuberculine (intra-dermo réaction) consiste à injecter sous la peau une dose de ce dernier et de visualiser la présence ou l'absence de réaction allergique (taille de la papule) après 48 à 72 h. Ce test est cependant peu sensible, surtout chez le patient immunodéprimé, et peu spécifique (patient vacciné ou ayant été au contact d'autres mycobactéries).
La détermination des souches résistantes aux anti-tuberculeux habituels est importante pour adapter le traitement. La mise en culture du germe identifié dans différents milieux enrichis en antibiotiques (antibiogramme) reste la méthode de référence mais peut demander plusieurs semaines pour avoir une réponse. Des sondes génétiques permettant d'identifier directement les souches résistantes dans un délai très bref ont été mises au point avec une bonne sensibilité et spécificité[11].
Traitement antituberculeux
Le traitement est d'une durée de six mois pour une tuberculose pulmonaire à BK sensible chez un patient immunocompétent, comprenant 2 mois de quadrithérapie antibiotique (isoniazide + rifampicine + pirilène+ethambutol) puis 4 mois de bithérapie (isoniazide et rifampicine).
Le traitement prolongé est indispensable afin de guérir la maladie et éviter l'émergence de souches résistantes dont l'évolution est souvent beaucoup plus grave.
Rifadine
Ce traitement peut être utilisé pour traiter la tuberculose osseuse.
Isoniazide
L'isoniazide est utilisé généralement à la dose de 5 mg, en association avec trois autres antibiotiques. Isoniazide inhibe la multiplication des bactéries responsables de la tuberculose. Ce médicament doit être administré a jeun .
Rifampicine
La rifampicine est utilisée habituellement à la dose de 10 mg/kg/jour, pendant une durée de 6 mois, pour le traitement de la tuberculose. Cet antibiotique est un fort inducteur enzymatique : il accélère la dégradation des autres médicaments, notamment les contraceptifs oraux. Les femmes sous contraceptifs sont donc invitées à revoir leur traitement à la hausse (après consultation du gynécologue), voire même à passer à une contraception mécanique (préservatif, ...) pendant la durée du traitement. La rifampicine provoque une coloration orangée des urines. C'est un bon moyen d'objectiver l'observance du traitement.
Streptomycine
La streptomycine (découverte par Waksman vers 1946) fut le premier antibiotique actif contre le bacille de Koch. Il est contre-indiqué chez la femme enceinte et doit impérativement être associé à d'autres antituberculeux (INH et PAS).
- Posologie :
- Par voie intramusculaire chez l'adulte : 15 à 25 mg par kg et par jour.
- Par voie intrarachidienne : Pour l'adulte, vingt cinq à cent milligrammes par jour, pour un enfant, vingt à quarante milligrammes par kilogramme et par jour en 2 ou 4 injections.
- Surveillance du traitement : Les fonctions auditives et rénales devront être surveillées régulièrement.
Éthambutol
L'éthambutol est utilisable chez la femme enceinte.
- Posologie pour adulte : Le matin à jeun en une seule prise, quinze à vingt milligrammes par kilogramme. Ne pas dépasser vingt cinq milligrammes par kilogramme par 24 h sans dépasser 60 jours, puis réduire à quinze milligrammes par kilogramme et par jour.
- Surveillance
Diarylquinolines
Le R207910, une molécule de la famille des diarylquinolines, pourrait se révéler prometteuse contre Mycobacterium tuberculosis. Elle fait naître trois espoirs :
- raccourcir la durée du traitement ;
- envisager des prises une seule fois par semaine en association avec un autre antituberculeux ;
- être active sur des souches multi résistantes, avec une efficacité bactéricide bien supérieure à celle de l'isoniazide et de la rifampicine.
Ce médicament est actuellement en phase très précoce de son développement. Seules des études approfondies chez l'homme permettront de vérifier que ces espoirs sont fondés.
Résistance aux traitements anti-tuberculeux
Elle est due à des traitements insuffisants en doses ou en durée[12]. Elle pose des problèmes importants car la tuberculose est beaucoup plus délicate à soigner, surtout en cas de résistances à plusieurs anti-tuberculeux (multi résistance). Dans le pire des cas, elle est dite étendue lorsque qu'elle concerne des antibiotiques de première intention (isionazide, rifampicine) et un ou plusieurs antibiotiques de seconde intention. Son incidence est d'environ 10 % des nouveaux cas (pour un seul antibiotique) et de 1 % (pour plusieurs antibiotiques). Dans certains pays, ces chiffres peuvent atteindre plus de 50 % des cas (notamment en Russie)[13].
Le dépistage de ces formes est difficile, la mise en culture du germe en présence des différents antibiotiques (antibiogramme) requérant plusieurs semaines pour avoir un résultat du fait de la lenteur de multiplication du mycobactérium. La recherche directe de mutations responsable de la résistance est faisable et donne de bons résultats[14]. Du fait de son coût, ces techniques sont difficilement applicables dans les pays pauvres. Une autre méthode consiste à observer la croissance de la souche de mycobacterium au microscope, en présence de différents antibiotiques. Elle donne des résultats fiables et assez rapide (une semaine)[15].
Le traitement des formes résistantes consiste en l'utilisation d'antituberculeux testés comme efficace sur la souche en question, complété par une fluoroquinolone et par des antibiotiques, dits de seconde ligne. La prise en charge a fait l'objet d'un document de recommandations publié par l'OMS en 2006[16].
Pneumothorax (historique)
Avant la découverte d'antibiotiques efficaces, on pratiquait la collapsothérapie. La collapsothérapie est un affaissement de la partie atteinte du poumon et d'une partie du thorax par insufflation d'air, le pneumothorax, ou par chirurgie mutilante.
Ces méthodes ont disparu des pays occidentaux dans les années 1950.
Prévention
Dépistage des vaches porteuses du bacille
Afin de prévenir la transmission du bacille à l'homme, soit par voie aérienne directement par contact, soit par voie digestive après ingestion de viande ou de lait insuffisamment cuit ou pasteurisé, la plupart des pays développés ont entrepris d'assainir leur cheptel bovin.
La détection des animaux porteurs se fait par voie clinique, allergique et par recherche des lésions évocatrices sur les carcasses à l'abattoir. En France, cette prophylaxie est obligatoire depuis 1963 sur tout le territoire national pour tous les bovins âgés de plus de 6 semaines. Pour que les animaux puissent se déplacer sans contrainte, le cheptel doit obtenir le statut "officiellement indemne de tuberculose". Pour cela, tous les animaux sont testés régulièrement par intradermotuberculination. La fréquence est annuelle mais peut être allégée quand la prévalence de la maladie dans le département est faible.
Les animaux réagissant peuvent être soit testés comparativement par une tuberculine aviaire (pour détecter les faux positifs), soit envoyés à l'abattoir (l'abattage est alors subventionné) où les lésions évocatrices seront recherchées par un vétérinaire inspecteur, et éventuellement confirmées par diagnostic de laboratoire. Les troupeaux où l'infection est confirmée peuvent faire l'objet d'un abattage total, également subventionné.
Parallèlement, en France, un réseau de 5 000 vétérinaires sanitaires surveille l'apparition de signes cliniques évocateurs. Des visites sanitaires biennales de tous les troupeaux de bovins sont obligatoires.
La vaccination au BCG positivant le test intradermique, elle est interdite sur le territoire français.
Cette politique a permis de faire considérablement baisser la prévalence de la tuberculose bovine. En 2000, la commission européenne a reconnu à la France le statut de pays officiellement indemne. En 2006 le taux d'incidence était de 0,032 % de cheptels infectés alors qu'il était de près de 25 % en 1955.
Vaccination par le BCG
En 1921, Albert Calmette et Camille Guérin essayent avec succès le premier vaccin contre la tuberculose, baptisé BCG.
Le vaccin Bilié de Calmette et Guérin (vaccin BCG) est une souche vivante atténuée de Mycobacterium bovis. L’efficacité de la vaccination par BCG se limite à la protection contre l’évolution mortelle de la tuberculose, particulièrement la méningite tuberculeuse et la maladie disséminée (miliaire). Le vaccin est plus efficace chez le nouveau-né et l'enfant que chez l'adulte.
Il ne permet donc pas d'empêcher la transmission de la maladie et d'enrayer l'épidémie mondiale. L'avenir est dans la recherche des gènes de virulence du bacille.
Signalons au passage que si on regarde attentivement l'évolution de la régression de la tuberculose depuis le XIXe siècle (fait constaté dans de nombreux pays), on constate objectivement qu'elle a régressé avant la découverte des antituberculeux, ou de la vaccination. Les épidémiologistes l'interprètent essentiellement par l'amélioration des conditions d'hygiène, des conditions nutritionnelles, etc[17],[18],[19]
Sur base d'études faites à grande échelle et organisées par l'Organisation mondiale de la santé (OMS), certains pensent que l'efficacité du BCG est faible : dans une étude faite sur 260.000 personnes dans un pays d'endémie tuberculeuse (en Inde), les auteurs n'ont pas trouvé de différence significative entre le groupe qui avait reçu le BCG et celui qui ne l'avait pas reçu[20]. Une autre étude faite également en Inde sur 366.625 personnes a montré que le BCG n'avait aucune action préventive sur les formes de tuberculoses pulmonaires adultes[21].
En juillet 2007, le ministre français de la santé, Roselyne Bachelot, a annoncé la suspension de l'obligation de vacciner tous les enfants et les adolescents contre la tuberculose par le BCG, à l'occasion de la présentation du nouveau programme de lutte contre cette maladie.
Après plus de deux ans de débats, et conformément aux recommandations du Conseil supérieur d'hygiène publique français et du Comité technique des vaccinations, la France, à l'image d'autres pays européens, veut optimiser sa stratégie de vaccination en la ciblant vers les enfants dits "à risque" et en renforçant le dépistage.
Déclaration obligatoire
En France, en Belgique et en Suisse, cette maladie est sur la liste des Maladies infectieuses à déclaration obligatoire.
En France, en particulier, c'est la mise sous traitement antituberculeux qui fait partie de la déclaration. Cela permet d'inclure les cas confirmés bactériologiquement et les cas probables reposant sur un faisceau d'arguments épidémiologiques, cliniques et d'imagerie en l'absence de preuve bactériologique formelle. En effet ces cas probables nécessitant les mêmes investigations d'enquête épidémiologique pour rechercher d'éventuels cas contact ou contaminant autour d'eux...
Recherche et Développement
Selon une étude d'Olivier Neyrolles de l'Institut Pasteur, le bacille de Koch se cacherait dans les cellules adipeuses[22]. C'est ainsi qu'il résisterait aux antibiotiques les plus puissants et qu'il serait capable de réapparaître après de nombreuses années chez des personnes guéries.
Notes et références
- ↑ Origin, Spread and Demography of the Mycobacterium tuberculosis Complex, Thierry Wirth, Falk Hildebrand, Caroline Allix-Beguec, Florian Wölbeling, Tanja Kubica, Kristin Kremer, Dick van Soolingen, Sabine Rüsch-Gerdes, Camille Locht, Sylvain Brisse, Axel Meyer, Philip Supply, Stefan Niemann - Plos Pathogens – septembre 2008.
- ↑ Communiqué CNRS
- ↑ WHO, Global tuberculosis control 2008
- ↑ Global epidemiology of tuberculosis, C Dye, Lancet 2006; 367:938-940
- ↑ Selwyn PA, Hartel D, Lewis VA et als. A prospective study of the risk of tuberculosis among intravenous drug users with human immunodeficiency virus infection, N Engl J Med, 1989:320;545–550
- ↑ Zignol M, Hosseini MS, Wright A et als. Global incidence of multidrug-resistant tuberculosis, J Infect Dis, 2006;194:479–485
- ↑ Gandhi NR, Moll A, Sturm AW et als. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa, Lancet, 2006:368;1575–1580
- ↑ Anti-tuberculosis drugs resitance in the world, 4ième rapport de l'OMS, 2008
- ↑ Pilly de 2002
- ↑ Piersimoni C, Scarparo C, Relevance of commercial amplification methods for direct detection of Mycobacterium tuberculosis complex in clinical samples, J Clin Microbiol, 2003;41:5355–5365
- ↑ Morgan M, Kalantri S, Flores L, Pai M, A commercial line probe assay for the rapid detection of rifampicin resistance in Mycobacterium tuberculosis: a systematic review and meta-analysis, BMC Infect Dis, 2005;5:62
- ↑ Espinal MA, Laserson K, Camacho M et als. Determinants of drug-resistant tuberculosis: analysis of 11 countries, Int J Tuberc Lung Dis, 2001;5:887-93
- ↑ (en)}Epidemiology of antituberculosis drug resistance (the Global Project on Anti-tuberculosis Drug Resistance Surveillance), Mohamed Abdel Aziz, Abigail Wright, Adalbert Laszlo, Aimé De Muynck, Françoise Portaels, Armand Van Deun, Charles Wells, Paul Nunn, Leopold Blanc, Mario Raviglione, Lancet 2006; 368:2142-2154
- ↑ Sam IC, Drobniewski F, More P, Kemp M, Brown T, Mycobacterium tuberculosis and rifampin resistance, United Kingdom, Emerg Infect Dis, 2006;12:752-9
- ↑ Moore DA, Evans CA, Gilman RH et als. Microscopic-observation drug-susceptibility assay for the diagnosis of TB, N Engl J Med, 2006;355:1539-50
- ↑ World Health Organization, Guidelines for the programmatic management of drug-resistant tuberculosis, Geneva: WHO, 2006
- ↑ R. Beaglehole, R. Bonita, T. Kjellström - Éléments d'épidémiologie éd. OMS 1994, p 85.
- ↑ (en)[pdf]Environmental Justice, Science, and Public Health, Steve Wing
- ↑ Michel Georget, Vaccinations, éd. Dangles, p 237
- ↑ (en)[pdf]Trial of BCG vaccines in south India for tuberculosis prevention : first report (Bull of WHO 1979 : 57 (5) : 819-827)
- ↑ (en)[pdf]Fifteen year follow up trial of BCG vaccines in south India for tuberculosis prevention, Tuberculosis research center, Indian J. Med Res (1999): 110, 56-69
- ↑ Communiqué de l'Institut Pasteur
Voir aussi
Articles connexes
Liens externes
- [pdf] Dossier sur le site du Comité National contre les Maladies Respiratoires
- (fr) Numéro thématique : LE POINT SUR LA TUBERCULOSE, Bulletin épidémiologique hebdomadaire (BEH), mai 2005, France
- (fr) Huchon G, Tuberculose (livre en version électronique)
- Portail de la médecine
- Portail des maladies infectieuses
Catégories : Tuberculose | Terme médical commençant par T
Wikimedia Foundation. 2010.