- Intoxication au Naphtalène
-
Naphtalène
Naphtalène 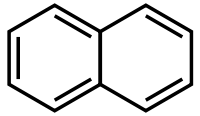
Général Synonymes Naphtaline
Camphre de goudronNo CAS No EINECS SMILES InChI Apparence Cristaux incolores
rhomboédriques sous
forme d'écailles.Propriétés chimiques Formule brute C10H8 [Isomères] Masse molaire 128,1705 g∙mol-1
C 93,71 %, H 6,29 %,Propriétés physiques T° fusion 80 °C[1] T° ébullition 218 °C[1] Solubilité 32 mg/l eau à 20 °C.
Sol dans éthanol, éther,
benzène,
chloroforme,
acide acétique,
acide chlorhydrique,
et dans les huilesMasse volumique 1.16 g/cm³[1] T° d’auto-inflammation 567 °C[1] Point d’éclair 79 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 0.9-5.9[1] Pression de vapeur saturante à 25 °C : 11 Pa[1] Cristallographie Système cristallin monoclinique [2] Classe cristalline ou
groupe d’espaceP21 / a[2] Paramètres de maille a = 8,24 Å
b = 6,00 Å
γ = 90,0 ° [2]
c = 8,66 Å
α = 90,0 °
β = 122,9 °Précautions Directive 67/548/EEC 
Xn
NPhrases R : 22, 40, 50/53, Phrases S : (2), 36/37, 46, 60, 61, Transport 40 1334
- 2304 NFPA 704 SIMDUT[4] 

SGH[5] 

AttentionClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[3] Écotoxicologie LogP 3.3[1] Unités du SI & CNTP, sauf indication contraire. Le naphtalène ou naphtaline ou camphre de goudron est un hydrocarbure aromatique à deux cycles, de formule C10H8 (voir schéma ci-contre). Son odeur caractéristique est perçue par l'odorat humain à partir de (0,04 ppm)[6]. Il a été couramment utilisé comme anti-mites. On a constaté par le suivi des maladies des travailleurs de l'industrie chimique qu'il pouvait être cancérigène[7],[8]
Sommaire
Utilisations
Les billes solides de naphtalène cristallisé sont vendues sous le nom de « Naphtaline », et utilisées principalement comme insecticide (antimites).
Le naphtalène est toxique : risque d'anémie hémolytique, peut-être cancérigène
Lors du traitement d'un lieu entier (appartement, maison) à la naphtaline, il est conseillé de ne pas habiter le lieu dans les 24 à 48 heures qui suivent le traitement.
Respirer de la naphtaline peut déclencher des crises de tachycardie chez les personnes fragiles.Origine - fabrication
Le naphtalène a été isolé en 1820 par Garden. Sa représentation actuelle (Deux noyaux benzène) fut proposée par Erlenmeyer en 1868.
En Allemagne, la matière première utilisée pour la production de naphtalène est le goudron de houille, qui en contient environ 10 %. La production de coke étant en régression, on utilise de plus en plus des produits dérivés du pétrole (essence de pyrolyse, huiles résiduelles de pyrolyse) ; fabrication par distillation fractionnée. Depuis les années 1960, la désalkylation des méthylnaphtalènes extrait du pétrole en présence d'hydrogène et à haute température et sous haute-pression.
La teneur en naphtalène dans le produit technique est de 95 % au moins, le reste étant constitué d'impuretés telles que benzo(b)thiophènes (thionaphtènes) et, pour les naphtalènes issus du pétrole, exclusivement de méthylindènes.Usages
Le naphtalène était autrefois surtout utilisé comme répulsif pour les mites. Aujourd'hui, 60 % du naphtalène produit est vendu comme produit chimique intermédiaire dans la fabrication d'anhydride phtalique, selon l'INERIS. Cet anhydride phtalique sert à synthétiser les phtalates et divers agents plastifiants, résines, teintures, insecticides ou répulsifs, etc. Il est aussi employé comme agent de tannage du cuir et dans certains tensioactifs (sulfonates de naphtalène et dérivés ayant fonction d'agents dispersants ou mouillants en peinture, teinture et formulation de papier d'emballage).
Le napalm, notablement utilisé lors de la Guerre du Viêt Nam, était initialement obtenu à partir de Naphtalène (d'où le "na") et d'acide palmique (d'où le "palm"). Le napthalène est d'ailleurs utilisé pour obtenir des effets pyrotechniques, l'explosion produit une fumée très noire.
Il peut être utilisé pour fabriquer certains plastiques (notamment en synthétisant des phtalates), des colorants ... mais aussi pour d'autres applications, plus marginales : antiseptique, microbicide, diélectrique, parfums ...
Dans l'environnement...
Une espèce de termite américain Coptotermes formosanus sécrète de petites quantités de naphtalène pour lutter contre des parasites et son principal prédateur, la fourmi Solenopsis invicta[9], mais l'essentiel du naphtalène présent dans la nature (89 % environ selon l'INERIS) vient de combustions incomplètes (pyrolyse) (chauffage domestique au bois) et de la sublimation du naphtalène utilisé comme insecticide. Environ 10 % des émissions dans l'air viendraient de la distillation du charbon. La fumée de tabac en contient de petites quantités.
Le naphtalène étant très soluble dans l'air (par sublimation) il s'y disperse rapidement. Le taux moyen dans l'air serait de 1 µg/m³, soit bien plus que dans l'eau de mer où il est peu soluble (10 ng/L) et d'où il peut dégazer dans l'air (idem pour l'eau douce). Les sols (2 µg/kg en moyenne) le retiennent mal (dégazage, adsorption moyenne). Il est habituellement peu présent dans les sédiments (2 µg/kg)[10]. Les essais d’adsorption/désorption répertoriés par l'INERIS donnent des Koc de 378 à 3 200 L/kg[11],[12],[13]. La Commission européenne (CE, 1996) a retenu une valeur de 1 320 L/kg.Bioaccumulation
Ses effets écotoxicologiques sont mal connus, mais on a montré qu'il est bioaccumulable chez plusieurs espèces de poissons (ex : Cyprinus carpio, Pimephales promelas[14]), moules (Mytilus edulis) et huîtres (Ostrea edulis)[15].
Le naphtalène semble pouvoir être absorbé par les racines et feuilles des plantes, mais l'INERIS en 2005 n'a pas trouvé d'études sur ses effets ni sur d'éventuels facteurs de bioconcentration.Dégradation
Compte tenu de sa structure chimique le naphtalène est réputé très stable.
Il semble très peu biodégradable en conditions normales. Un test standard[16] n'a montré que 2 % de dégradation après 28 jours, mais des tests (non normalisés) laissent penser qu'il peut être rapidement biodégradé en conditions aérobies et dénitrifiantes lorsque mis en contact avec certains micro-organismes qui le font quasiment disparaître en 8 à 12 jours dans les meilleurs cas[17],[18],[19]. La Commission Européenne (CE, 1996) a retenu une demi-vie de 150 jours dans les eaux de surface. Quelques tests (non normalisés) de biodégradéation en condition anaérobie et notamment dans les sédiments, laissent penser qu'il est stable dans ces conditions[20].Toxicologie
Divers rapports de l'ATSDR (1995) et de l'EPA aux États-Unis (1998) ont mis en avant plusieurs caractéristiques toxicologiques de ce produit (voir aussi le rapport INERIS « Hydrocarbures Aromatiques Polycycliques (HAPs) : Évaluation de la relation dose-réponse pour des effets cancérigènes - Approche substance par substance[21]. Ils estiment que le naphtalène peut être absorbé et dans certains cas provoquer un empoisonnement via les tractus respiratoire et digestif ainsi qu'au travers de la peau en contact avec des draps ou vêtements traités par un antimite, notamment chez le nouveau né[22]. Dans l'organisme humain, on connaît au moins deux métabolites stables du naphtalène ; le 1-naphtol et le 1,2-dihydro naphtalène diol[23]. Selon l'INERIS, le naphtalène peut être méthylé en 1-méthylnaphatlène (peut-être moins toxique que le naphtalène) ou en 2-méthylnaphatlène. Il est majoritairement peu à peu éliminé en métabolites via les urines.
Les enfants sont plus sensibles à cette molécule. Les individus d’origine africaine et asiatique y sont plus sensibles en raison d'une déficience plus fréquente de l’enzyme G6PD[24].
Effet sur la santé
Le gaz, soluble dans la graisse, peut être stocké dans les adipocytes de l'être humain. Lorsque l'organisme brûle ces graisses, le poison est déversé dans le corps avec pour symptômes de l'anémie, des hémorragies, un coagulum, voire des hallucinations.[réf. nécessaire]
Voir aussi
Notes et références
- ↑ a , b , c , d , e , f , g et h NAPHTHALENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b et c (en) R.B. Campbell, J. M. Robertson et J. Trotter, « The crystal structure of hexacene, and a revision of the crystallographic data for tetracene », dans Acta Crystallographica, vol. 15, no 5, mars 1962, p. 289-290
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Naphtalène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Verschueren K. (1996) - Naphtalene. Handbook of Environmental Data on Organic Chemicals. New York, Van Nostrand Reinhold Co. 3rd Ed, pp. 1756-1762.
- ↑ Wolf O. (1976) - Cancers in chemical workers in a former naphtalene purification plant. Dt Gesundh Wesen, 31, 996-999
- ↑ Wolf O. (1978) - Carcinoma of the larynx in naphtalene purifiers. Z Ges Hyg., 24, 737-739
- ↑ Article d'Anne Gallus dans "Le Monde" du 12 avril 1998
- ↑ Source : INERIS, d'après ATSDR (1995) et HSDB (2000)
- ↑ Rippen G., Ilgenstein M., Klöpffer W. and Poremski H. (1982) - Screening of the adsorption behaviour of new chemicals: natural soils and model adsorbents. Ecotoxicol Environ Saf, 6, 236
- ↑ Bouchard D.C., Mravik S.C. and Smith G.B. (1990) - Benzene and naphthalene sorption on soil contaminated with high molecular weight residual hydrocarbons from unleaded gasoline. Chemosphere, 21, 975
- ↑ Løkke H. (1984) - Sorption of selected organic pollutants in Danish soils. Ecotox Toxicol Environ Saf, 8, 395.
- ↑ Veith G.D., De Foe D.L. and Bergstedt B.V. (1979) - Measuring and estimating the bioconcentration factors of chemicals in fish. J Fish Res Board Can, 36, 1040-1048.
- ↑ Riley R.T., Mix M.C., Schaffer R.L. and Bunting D.L. (1981) - Uptake and accumulation of naphthalene by the oyster Ostrea edulis, in a flow-through system. Marine Biol, 61, 267-276
- ↑ Biodegradation and Bioaccumulation data of existing chemicals based on the CSCL. Chemicals Inspection and Testing Institute. Japan. (méthode OCDE 302 C, CITI, 1992)
- ↑ Delfino J.J. and Miles C.J. (1985) - Aerobic and anaerobic degradation of organic contaminants in Florida groundwater. Proc Soil Crop Sci Soc Fla, 44, 9-14.
- ↑ Nielsen P.H. and Christensen T.H. (1994) - Variability of biological degradation of aromatic hydrocarbons in an aerobic aquifer determined by laboratory batch experiments. J Contam Hydrol, 15, 305-320.
- ↑ Bauer J.E. and Capone D.G. (1985), Effects of four aromatic organic pollutants on microbial glucose metabolism and thymidine incorporation in marine sediments. Appl Environ Microbiol, 49, 828-835
- ↑ Delaune R.D., Hambrick G.A. and Patrick W.H. (1980) - Degradation of hydrocarbons in oxidised and reduced sediments. Mar Pollut Bull, 11, 103-106
- ↑ « Hydrocarbures Aromatiques Polycycliques (HAPs) : Évaluation de la relation dose-réponse pour des effets cancérigènes - Approche substance par substance (facteurs d’équivalence toxique – FET) et approche par mélange ; évaluation de la relation dose-réponse pour des effets non cancérigènes : Valeurs Toxicologiques de Référence (VTR) » de l'INERIS (Voir)
- ↑ Dawson J., Thayer W. and Desforges J. (1958) - Acute hemolytic anemia in the newborne infant due to naphtalene poising: Report of two 2 cases, with investigations into the mechanism of the disease. Blood, 13, 1113-1125
- ↑ Tingle M., Pirmohmed M. and Templeton E. (1993) - An investigation of the formation of cytotoxic, genotoxic, protein-reactive and stable metabolites from naphthalene by human liver microsomes. Biochem Pharmacol, 46 (9), 1529-1538.
- ↑ Calabrese E.J. (1986) - Ecogenetics: historical foundation and current status. J Occup Med, 28, 10, 1096-1102.
Liens externes
- Fiche technique/sécurité, par l'INERIS.
- (fr) Fiche toxicologique de l'INRS
- Portail de la chimie
Catégories : Produit chimique nocif | Produit chimique dangereux pour l'environnement | Hydrocarbure aromatique polycyclique | Naphtalène | Noyau aromatique simple | Insecticide | Composé bicyclique
Wikimedia Foundation. 2010.


