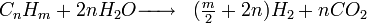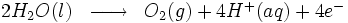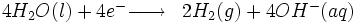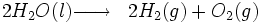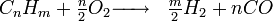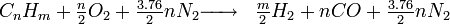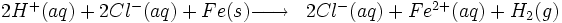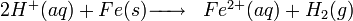- 1333-74-0
-
Dihydrogène
Dihydrogène 
Général Nom IUPAC dihydrogène Synonymes hydrogène No CAS No EINECS PubChem No E E949 SMILES InChI Apparence sans odeur, incolore, gaz comprimé[1]. Propriétés chimiques Formule brute H2 [Isomères] Masse molaire 2,01588 g∙mol-1
H 100 %,Propriétés physiques T° ébullition -253 °C[1] Solubilité 0.019 Masse volumique 0.08988 kg/m (273 K) T° d’auto-inflammation 500 à 571 °C[1] Point d’éclair gaz inflammable[1] Limites d’explosivité dans l’air en volume % dans l'air : 4-76[1] Point critique -239,96 °C / 1315 kPa abs Point triple -259,2 °C / 7,205 kPa abs Thermochimie S0gaz, 1 bar 130.68 J/mol K Cp 14 266 J/kg K (293 K) Précautions Directive 67/548/EEC 
F+Phrases R : 12, Phrases S : 2, 9, 16, 33, [2] Transport 23 1049
223 1966 NFPA 704 gaz :
réfrigéré liquide :[3]SIMDUT[4] 

SGH[5] 

DangerInhalation suffocation Unités du SI & CNTP, sauf indication contraire. Le dihydrogène est la forme moléculaire de l'élément hydrogène, qui existe à l'état gazeux aux conditions normales de pression et de température. Les molécules comportent deux atomes d'hydrogène, sa formule chimique est H2. Il est présent sous forme de traces (0,5 ppmv) dans l'air. Il est également appelé « molécule d'hydrogène » ou « gaz hydrogène » et, dans le langage courant, lorsqu'il n'y a pas d'ambiguïté avec l'élément chimique du même nom, il est très fréquemment désigné par « hydrogène ».
C'est un gaz léger que la gravité terrestre ne peut d'ailleurs retenir. Il fut employé dans les ballons dirigeables de type Zeppelin, utilisant les propriétés de la poussée d'Archimède, avant d'être remplacé par l'hélium moins dangereux car non combustible. Il brûle dans l'air en produisant de l'eau, d'où son nom (du grec hydro : « eau » et gène : « qui génère »).
Le dihydrogène possède une température de vaporisation de 20,27 K et une température de fusion de 14,02 K. Sous de très fortes pressions, comme celle qui existent au centre des géantes gazeuses, ces molécules se dissocient et l'hydrogène devient un métal liquide. Dans l'espace, les nuages de H2 sont à la base du processus de formation des étoiles.
Sommaire
Histoire
Le premier scientifique connu à avoir décrit la production de dihydrogène est le suisse Paracelse (1493-1541). Il fait cette découverte en versant du vitriol sur de la poudre de fer, mais ne comprend pas la nature exacte du gaz dégagé au cours de l'expérience.
Le chimiste anglais Henry Cavendish (1731-1810), recommençant les expériences de Paracelse avec plusieurs métaux différents, découvre que le gaz ainsi produit est différent de l'air, est inflammable et à une faible densité. Il appelle ce gaz « air inflammable » (en anglais : flammable air) et s'aperçoit que sa combustion produit de l'eau. Le dioxygène étant lui nommé « air vital ».
Le chimiste français Antoine Lavoisier ayant confirmé les expériences de Cavendish, propose le mot « hydrogène » pour remplacer l'expression « air inflammable ». Ce mot est formé avec le préfixe hydro (du grec ὕδωρ (hudôr), « eau ») et du suffixe gène (du grec γεννᾰν (gennen), « engendrer »).
Par la suite, dans le domaine scientifique, le mot « hydrogène » sera utilisé pour nommer l'élément chimique et le mot « dihydrogène » sera utilisé pour la molécule.
Utilisations industrielles
La consommation mondiale d’hydrogène est aujourd’hui d’environ 50 millions de tonnes par an La majeure partie de la production de dihydrogène est consommée sur place, dans l’industrie chimique et pétrochimique principalement: synthèse de l’ammoniac (50 %), raffinage et désulfuration des hydrocarbures (37 %), synthèse du méthanol (12 %).
les principales utilisations industrielles du dihydrogène sont :
- les procédés Haber-Bosch de production de l'ammoniac, l'hydrogénation des graisses et des huiles et la production de méthanol.
- la fabrication de l'acide chlorhydrique, le soudage, les carburants pour fusées et la réduction de minerais métalliques ;
- le dihydrogène liquide (LH2) est utilisé pour les recherches à très basses températures, y compris l'étude de la supraconductivité ;
- il était utilisé dans les ballons car il est quatorze fois plus léger que l'air, mais il a été remplacé par l'hélium pour des raisons de sécurité.
- le deutérium (2H) est utilisé dans les applications nucléaires comme modérateur (eau lourde ou D2O) pour ralentir les neutrons. Les composés du deutérium sont aussi utilisés en chimie et en biologie pour étudier ou utiliser l'effet isotopique ;
- le tritium (3H), un autre isotope, est produit dans les réacteurs nucléaires et est utilisé pour la construction de bombes atomiques. Il est également utilisé comme un marqueur isotopique dans les biosciences et comme source de radiation dans les peintures luminescentes.
- l'hydrogène ou plutôt de l'azote hydrogénée est aussi utilisé comme gaz traceur pour effectuer des opérations de recherches de micro-fuites dans des ensembles industriels (automobiles, biens d'équipement, installation de chauffage, réseau de distribution d'eau, réservoir d'avions, etc.).
- Le dihydrogène est un additif alimentaire autorisé sous la référence E 949, voir Liste des additifs alimentaires.
Réactions de base de la production de dihydrogène
Au XIXe siècle, pour produire de l’hydrogène, on chauffait de l’eau, on envoyait ensuite la vapeur d’eau obtenue dans un tonneau rempli de limailles et copeaux de fer. La vapeur d’eau H2O attaquait le métal créant de l’oxyde de fer et libérant du dihydrogène. Le dihydrogène, sortait ensuite du tonneau, on le filtrait dans un autre tonneau rempli d’eau. Puis, direct au ballon. Ce dispositif permettait à l’armée de gonfler n’importe où et en quelques heures un ballon d’observation.[réf. nécessaire]
L'hydrogène est produit industriellement par deux procédés :
- par vaporeformage à partir d'hydrocarbures (en particulier à partir de méthane)
- par électrolyse de l'eau
D'autres procédés sont aussi à l'étude, basés sur le craquage ou l'oxydation partielle, qui a l'avantage d'être exothermique
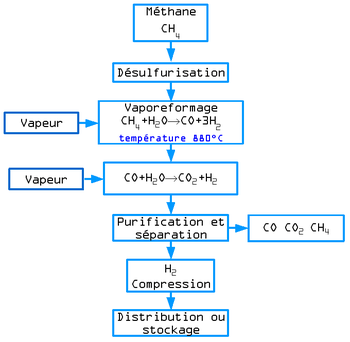
Vaporeformage d'hydrocarbures
Le vaporeformage d'hydrocarbures est le procédé qui, au XXIe siècle, est le plus utilisé au niveau industriel. Son principe est basé sur la dissociation de molécules carbonées (méthane...) en présence de vapeur d'eau et de chaleur. La réaction globale s'écrit:
Le rendement énergétique est de l'ordre de 40 à 45% dans certaines installations. En pratique industrielle, il est nécessaire d'aider la réaction à l'aide de catalyseurs ou de brûleurs. Elle a l'inconvénient de produire du dioxyde de carbone, un gaz à effet de serre.
Électrolyse de l'eau
Cette technologie consiste à faire passer un courant électrique dans l'eau afin d'obtenir la dissociation des molécules d'eau en dihydrogène et dioxygène.
Réaction à l'anode :
Réaction à la cathode :
Globalement, nous avons :
Cette technologie nécessite de grandes quantités d'électricité. Elle est aussi cependant aujourd'hui efficace d'un point de vue énergétique : l'énergie potentielle du dihydrogène produit correspond à environ 80% de l'énergie électrique consommée[réf. nécessaire]. Elle est relativement peu utilisée.
Oxydation partielle d'hydrocarbures
Cette réaction est une combustion "riche" dans le sens où l'on vise la production d'un gaz riche en H2 et CO (gaz de synthèse); au lieu des produits "classiques" CO2 et H2O.
La réaction s'écrit:
La plupart du temps, on utilise l'air comme comburant. Nous avons alors:
La réaction est exothermique: par exemple, l'enthalpie de la réaction avec le méthane est de -35.7 kJ/mol.
Tout comme la réaction de vaporeformage, il est nécessaire de catalyser la réaction.
L'intérêt de la réaction d'oxydation partielle réside dans son caractère exothermique (contrairement à la réaction de vaporeformage) qui permet d'aider la catalyse (élévation de température).
L'inconvénient majeur réside dans le fait que les pourcentages de H2 sont inférieurs à ceux obtenus par vaporeformage, à cause de la présence majoritaire de l'azote de l'air. De plus, il est possible d'obenir des NOx.
Action de l'acide chlorhydrique sur le fer
Au laboratoire de Chimie (collège ou lycée), on produit parfois du dihydrogène par action de l'acide chlorhydrique sur du fer.
ou, formule simplifiée :
Hydrogène renouvelable
Afin d'être une énergie vraiment avantageuse en termes d'environnement, l'hydrogène doit notamment pouvoir être produit à partir d'énergie renouvelable.
Il est possible de réaliser l'électrolyse de l'eau à partir d'électricité renouvelable mais le rendement faible de cette étape diminue la quantité d'énergie globale disponible.
Une autre voie de production d'hydrogène renouvelable se fait par fermentation de biomasse: on peut alors parler de biohydrogène. Certains travaux de recherche se font sur la fermentation directe d'hydrogène à partir de substrats et micro organismes spécifiques. Une autre voie est la fermentation anaérobie, voie de dégradation de matière organique (déchets notamment) très courante, la production de biogaz et le reformage du méthane contenu dans le biogaz, en hydrogène comme présenté plus haut dans la partie vaporeformage.
Techniques de production
Article détaillé : Production d'hydrogène.Production par électrolyse de l'eau
La production d'hydrogène par électrolyse de l'eau consiste à dissocier la molécule d'eau (H2O) en molécules d'hydrogène et d'oxygène, en faisant passer un courant électrique dans l'eau.
Production par réaction chimique à partir d'eau
La production d'hydrogène peut également être obtenue par réaction chimique en mettant en contact de l'eau, de la soude et de l'aluminium. D'autres formules chimiques existent permettant d'extraire l'hydrogène de l'eau.
Production par reformage d'hydrocarbures
Ce procédé catalytique est utilisé dans l'industrie (essentiellement à partir de gaz naturel) et dans certains projets de pile à combustible. Les résidus carbonés produits peuvent poser également des problèmes de pollution.
Le procédé est surtout basé sur la réaction de vaporeformage décrite ci-dessus. L'oxydation partielle, éventuellement couplée à la réaction de vaporeformage (dans ce cas, on parle de reformage autotherme), présente l'avantage d'être exothermique pour la plupart des hydrocarbures.
La production embarquée d'hydrogène par reformage d'hydrocarbures (véhicules pile à combustible, par exemple) est particulièrement contraignante en termes d'encombrement, poids, coût, temps de réponse, sensibilité au soufre contenue dans les carburants, ... L'application doit présenter les mêmes caractéristiques en termes de sécurité, fiabilité et facilité d'utilisation que les véhicules à combustion interne. Des technologies catalytiques, ou plus novatrices telles que les reformeurs plasma, sont actuellement à l'étude.
Production par photosynthèse (cyanobactéries)
Certaines bactéries peuvent décomposer chimiquement l'eau en oxygène et hydrogène à l'aide de réactions photosynthétiques. Ceci permettrait de produire de l'hydrogène à l'aide d'énergie solaire. Des recherches sont en cours dans ce domaine, notamment en termes de génie génétique.
Stockage
Article détaillé : Stockage d'hydrogène.A ce jour, trois grandes voies de stockage d'hydrogène à bord d'un véhicule sont envisagées[6]:
- Le stockage comprimé
- Le stockage liquide
- Le stockage moléculaire
Gaz comprimé
C'est la forme la plus commune de stockage du dihydrogène.
Le stockage gazeux sous forme comprimé (actuellement 350 bars) permet d'atteindre une densité massique satisfaisante avec des réservoirs composites. La densité volumique de stockage reste faible: une pression de 700 bars est inévitable pour rendre la technologie compétitive.
La technologie existe et est couramment utilisée. Son inconvénient réside dans l'énergie nécessaire à la compression et dans la faible efficacité en termes d'encombrement en comparaison aux autres méthodes. Cet encombrement est une des difficultés pour l'utilisation du dihydrogène sous forme de gaz comprimé dans les applications automobiles.
Stockage liquide (cryogénique)
Article détaillé : Hydrogène liquide.Le stockage liquide à 20 K (-253 °C) sous 10 bars permet d'atteindre des densités volumique et massique intéressantes mais nécessite des réservoirs à l'isolation thermique poussée afin de minimiser l'évaporation.
La technologie est existante. Elle a une meilleure efficacité volumique que le stockage de gaz comprimé (70 kg.m−3 contre 10 kg.m−3 à 115 bar et 0 °C). Cependant, cet avantage est modéré par le volume relativement important des enceintes isolantes nécessaires.
D'autre part, il faut une énergie importante pour passer en phase liquide: la liquéfaction consomme 30 à 40% du contenu énergétique du gaz et la déperdition en utilisation réelle est importante (actuellement 1,25 pour mille par heure [7]), pénalisant fortement le stockage au-delà d'une semaine.
Cette technique est notamment utilisée dans le domaine spatial où, malgré le faible délai de mise en œuvre, la remplissage est continu jusqu'au dernier moment.
Hydrures métalliques
Le stockage sur des substrats sous forme absorbée, notamment sur des hydrures métalliques, présente une densité volumique très intéressante mais une densité massique faible. De plus la cinétique, la température et la pression de cyclage restent des points durs à maîtriser.
Les atomes d'hydrogène sont stockés dans certains composés métalliques. On récupère le dihydrogène en chauffant ou en diminuant la pression. Cette technique est aujourd'hui mal maîtrisée. Elle a l'inconvénient de demander un dihydrogène extrêmement pur afin d'éviter de détruire la capacité d'absorption des hydrures. Le chauffage pour récupérer le gaz est également un handicap. Ce type de stockage en est au stade de recherche et n'est pas disponible aujourd'hui sur une base industrielle.
Capacité de stockage de certains hydrures.
Hydrure Pourcentage de dihydrogène
contenu (en masse)LaNi5H6,5 1,4 % ZnMn2H3,6 1,8 % TiFeH2 1,9 % Mg2NiH4 3,6 % VH2 3,8 % MgH2 7,6 % Stockage par adsorption sur du Carbone
Cette technique permet de stocker en surface de certaines structures de carbone telle que du charbon actif ou des nanotubes les molécules de dihydrogène. Elle permet de stocker 0.05 à 2 % en masse de dihydrogène.
Ce type de stockage est au stade de recherche.
Propriétés chimiques
Test de reconnaissance du dihydrogène
Afin de tester sa présence, on approche une bûchette enflammée d'un tube à essai contenant du dihydrogène. Il se produit un bruit caractéristique appelé « jappement ».
Combustion
La combustion du dihydrogène dans le dioxygène, qui produit de l'eau, est particulièrement violente (voir test de reconnaissance) et très exothermique: son pouvoir calorifique est de 141,79 MJ/kg contre, par exemple, seulement 49,51 MJ/kg pour le butane. Cette propriété en fait un carburant de choix pour les engins spatiaux mais rend son stockage dangereux. La même oxydation plus lente est utilisée pour produire du courant électrique dans les piles à combustible.
Formes ortho et para
Le dihydrogène gazeux est un mélange de type de molécules qui diffèrent l'une de l'autre par le spin de leur électron et noyaux atomiques. Ces deux formes sont appelées ortho- et para-hydrogène et la forme para n'existe pas à l'état pur. Dans les conditions normales de température et de pression, l'hydrogène est composé à 75 % de la forme ortho et à 25 % de la forme para. Ces deux formes ont des niveaux énergétiques légèrement différents et donc des propriétés physico-chimiques légèrement différentes. Par exemple, le point de fusion et le point d'ébullition du para-hydrogène sont environ 0,1 K plus bas que ceux de l'ortho-.[réf. nécessaire]
L'hydrogène comme vecteur d'énergie
Article détaillé : Économie hydrogène.L'hydrogène est régulièrement cité comme vecteur énergétique d'avenir. Il est important de préciser qu'il ne s'agit pas d'une source primaire d'énergie mais seulement d'un mode de stockage, un peu comme une batterie. L'impact écologique de son utilisation dépend donc complètement de son mode de production, qui est nécessairement consommateur de matière première et d'énergie, et générateur de pollution et de gaz à effet de serre.
Actuellement seulement 1 % de la production d’hydrogène est utilisée comme vecteur énergétique, uniquement dans le cadre des applications spatiales.
L'hydrogène pourrait être utilisé comme vecteur énergétique avec des applications telles que la pile à combustible ou le moteur à hydrogène. Il est souvent cité comme alternative aux moteurs à combustion interne "traditionnels", en raison notamment de son caractère "propre", son utilisation ne rejetant théoriquement que de la vapeur d'eau.
Claude Mandil, directeur exécutif de l'Agence internationale de l'énergie, estime ainsi que l'hydrogène devra « jouer un rôle crucial » dans l'économie mondiale[8]. De nombreuses expériences ont été menées dans le domaine des véhicules propres. Chrysler-BMW possède une flotte de voitures (moteurs thermiques) roulant à l'hydrogène H2, sans pile à combustible, avec réservoir cryogénique. Plusieurs pays européens subventionnent des programmes d'utilisation d'hydrogène dans les transports en commun.
Cependant ces applications se heurtent à plusieurs difficultés :
- Production : le dihydrogène n'existe qu'en très faible quantité sur Terre (voir plus haut). Pour cette raison, il est nécessaire de le produire, à partir d'eau (par électrolyse) ou de chaînes hydrogénées telles que les alcools, le gaz naturel ou les carburants commerciaux (par reformage). Ces procédés sont développés dans l'article production d'hydrogène.
- Volume de stockage : le dihydrogène est le carburant dont l'énergie massique de combustion est la plus importante (120 MJ/kg), mais comme l'atome d'hydrogène est également l'élément le plus léger, son énergie volumique de combustion est relativement faible. Pour cette raison, il est nécessaire de disposer d'un volume conséquent pour alimenter par exemple un moteur à hydrogène. Ce problème est particulièrement important dans le cas d'un véhicule, où l'espace disponible est limité. Pour limiter le volume du réservoir, il est nécessaire de comprimer fortement le dihydrogène, cette compression est elle aussi consommatrice d'énergie.
- Distribution : pour envisager l'utilisation à grande échelle de véhicules équipés de moteur à hydrogène il sera nécessaire de mettre en place un réseau de distribution d'hydrogène au moins aussi dense que celui existant actuellement pour les carburants "classiques" (stations service). Cependant, il est possible d'utiliser les infrastructures existantes pour les combustibles fossiles :il ne s'agit donc pas d'un effort comparable au développement des filières de distribution du pétrole, qui a demandé plusieurs dizaines d'années. Le coût du déploiement d'un système complet de distribution pourrait demander de 10 à 15 milliards de dollars pour les seuls États-Unis, ce qui ne représente que 0,1 % du PIB des États-Unis[9].
- Rejets : le mythe d'un moteur ne rejetant que de l'eau est très attractif mais malheureusement erroné car trop simpliste. Pour ne rejeter que de l'eau, il faudrait que la combustion se fasse à l'oxygène et non à l'air qui contient près de 80 % d'azote. Une combustion à l'air produit des oxydes d'azote.
- Coût des piles à combustible : elles sont dotées de mousse de platine, très onéreuse. D'autre part, la sécurité de ces piles sur une longue durée n'est pas assurée.
De nouveaux procédés apportent des éléments de réponse. Ainsi la technique de captation et de séquestration du carbone permettrait de compenser l'émission de gaz à effet de serre lors de la production d'hydrogène, mais à un coût important : si la fabrication d'hydrogène (transport non compris) est évaluée à 120 USD le baril en utilisant du gaz naturel, il faut compter le double si on choisit le charbon et une technique de captation/séquestration[10]. Une autre solution serait d'utiliser les réacteurs nucléaires spécifiques de génération IV, à très haute température grâce à l'utilisation d'hélium comme fluide caloporteur, capables de produire de l'hydrogène à partir de l'eau. Ces réacteurs ne seront disponibles qu'à partir de 2030 ou 2040 et le coût de leur futur démantèlement n'est pas encore précisément connu. À partir de là, puiser dans l'électricité standardisée et disponible partout se révèle une solution plus simple et plus efficace, qui ne demande qu'un faible investissement, mais non écologique.
L'utilisation d'hydrogène constitue donc un espoir considérable pour le stockage et le transport de l'énergie, mais reporte la difficulté sur d'autres formes d'énergie. Cette technologie ne sera donc pas utilisable à grande échelle avant plusieurs dizaines d'années.
Dangers, risques et précautions
Le dihydrogène est un gaz classé « extrêmement inflammable ». Il est caractérisé par un domaine d’inflammabilité très large (de 4 à 75 % du volume dans l’air), provoquant une déflagration à partir d’un apport d’énergie d’activation très faible (une étincelle suffit si elle apporte une énergie de 0,02 millijoule (mJ) alors qu’il faut 0,29 mJ pour déclencher une explosion du méthane). L'hydrogène mélangé à de l'oxygène dans les proportions stœchiométriques est un explosif puissant. Le dihydrogène dans l'air est un mélange détonnant lorsque le rapport volumique H2 / air est compris entre 13 et 65 %.[réf. nécessaire]
L'histoire de son utilisation dans les ballons dirigeables est parsemée d'accidents graves, dont le plus célèbre est la catastrophe du Hindenburg . Le zeppelin "LS 129", gonflé de 200 000 mètres-cubes de dihydrogène (car les USA avaient déclaré envers l'Allemagne un embargo pour l' hélium ) brûla le 6 mai 1937 à son arrivée à l'aérodrome de Lakehurst (état du New-Jersey, près de New-York ) . 36 personnes moururent sur le total de 97 embarquées. Les médias qui étaient présentes divulguèrent largement les images de la catastrophe, ce qui conduisit à la désaffection du public pour les ballons. Le remplacement du dihydrogène par l'hélium (beaucoup plus coûteux et plus dense) ne produisit pas le regain de faveur attendu. Les enquêtes sur l'origine de l'accident, facilitées par l'abondance de documents photographiques, n'incriminèrent pourtant pas une explosion du dihydrogène, mais une inflammation par contiguité, à partir d'un incendie de l'enveloppe (causé probablement par une décharge d'électricité statique). La composition du revêtement étanche de l'enveloppe (butyrates et aluminium) aurait favorisé une violente réaction aluminothermique.
Le dihydrogène réagit aussi violemment avec le dichlore pour former de l'acide chlorhydrique (HCl) et avec le difluor pour former de l'acide fluorhydrique (HF).
L’industrie stocke le dihydrogène à l’extérieur des bâtiments, ce qui ne sera pas possible pour une utilisation embarquée (véhicules, navires). Les normes de sécurité sont renforcées pour répondre aux risques posés par le passage dans les tunnels et le stationnement dans les garages ou parkings souterrains.
La réglementation mondiale sur les véhicules s’élabore sous l’égide de l'ONU à partir des propositions des industriels, mais concernant le dihydrogène, les constructeurs japonais, américains et européens ne s’accordent pas. La Commission européenne pourrait décider d’une réglementation communautaire provisoire.
En France, l’INERIS et le CEA travaillent avec l’Organisation internationale de normalisation (ISO) dans un comité technique nommé TC 197 sur le risque dihydrogène. Un projet européen Hysafe traite aussi de la question, où l’INERIS a critiqué le projet de règlement en suggérant une approche plus globale et systémique et non par composant pour l’homologation des véhicules hybrides.
Dans le cadre de l'utilisation de l'hydrogène en tant que vecteur d'énergie, plusieurs études ont soulevé l'hypothèse d'un risque majeur pour la couche d'ozone en cas d'utilisation massive[11],[12]. La peur de l'hydrogène est bien réelle, même si le célèbre "syndrome Hindenburg", né de la destruction du dirigeable allemand en 1937 à Lakehurst (New Jersey), a probablement pénalisé injustement la filière. D'après un scientifique de la NASA en effet, l'incendie qui a détruit le ballon a été déclenché par une décharge électrostatique au niveau du matériau combustible de son enveloppe extérieure, et il n'y a pas eu d'explosion de l'hydrogène stocké à bord, qui a simplement brûlé. Il reste que l'accident aurait été moins violent si le ballon avait été gonflé à l'hélium[6]....
L'hydrogène n'est pas plus dangereux que le gaz naturel ou l'essence, il est tout simplement différent. En matière de sûreté, les points suivants sont à retenir:
- L'hydrogène n'est pas un gaz toxique
- Il est 8 fois plus léger que le méthane et sa molécule, très petite, lui confère un très bon coefficient de diffusion dans l'air (4 fois supérieur à celui du méthane). En milieu non confiné, l'hydrogène a donc tendance à monter et à se diluer très vite dans l'air, ce qui est un facteur de sécurité
- L'hydrogène est l'espèce chimique la plus énergétique par unité de masse (120 kJ/g). En revanche, par unité de volume de gaz, l'énergie explosive théorique est 3.5 fois plus faible pour l'hydrogène que pour le gaz naturel
- Sa limite inférieure d'inflammation est de 4% en volume, comparable à celle du gaz naturel (5% en volume). En revanche, sa limite supérieure d'inflammation est nettement plus élevée (75% contre 15%).
- L'énergie nécessaire pour l'enflammer à la stoechiométrie est également nettement plus faible (environ 10 fois ) que le gaz naturel ou le propane
- La flamme d'hydrogène rayonne peu, ce qui, en cas d'incendie, limite le risque de propagation par effet de rayonnement thermique. Par contre, sa flamme bleu pâle est quasi invisible le jour, ce qui peut constituer un risque pour les secours
- La flamme d'hydrogène se propage beaucoup plus vite (environ 7 fois) que celle du gaz naturel et le risque de détonation (explosion avec effet de souffle très important) n'est pas complètement à exclure
Référence ONU pour le transport de matières dangereuses
- Nom (français) : Hydrogène comprimé
- Classe : 2
- numéro : 1049
- Nom (français) : Hydrogène liquide réfrigéré
- Classe : 2
- numéro : 1966
- Nom (français) : Hydrogène dans un dispositif de stockage à hydrure métallique
- Classe : 2
- numéro : 3468
Annexes
Bibliographie
- La Révolution de l'hydrogène. Vers une énergie propre et performante ?, Stephen Boucher, préface de Thierry Alleau, Paris, Ed. du Felin, 2006, 160 pages, (ISBN 2-86645-616-5).
Notes et références
- ↑ a , b , c , d et e HYDROGENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « hydrogene » sur ESIS, consulté le 15 février 2009
- ↑ Office of Radiation, Chemical & Biological Safety (ORCBS). Consulté le 16 avril 2009
- ↑ « Hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ a et b L'hydrogène, les nouvelles technologies de l'énergie. Les clefs CEA, N°50/51, Hiver 2004-2005, ISSN 0298-6248
- ↑ Rapport du projet européen StorHy, page 8, hydrogen loss rate
- ↑ Présentation d'un rapport remis au G8 de Saint-Petersbourg, juin 2006.
- ↑ Estimation de General Motors, citée par P. Laffitte et C. Saunier, Les apports de la science et de la technologie au développement durable, rapport réalisé pour l'Office parlementaire d'évaluation des choix scientifiques et technologiques.
- ↑ Source : P. Laffitte et C. Saunier, op. cit.
- ↑ T. Rahn, J. M. Eiler, K. A. Boering, P. O. Wennberg, M. C. McCarthy, S. Tyler, S. Schauffler, S. Donelly, E. Atlas, Extreme deuterium enrichment in stratospheric hydrogen and the global atmospheric budget of H2, Nature 424, 918-921, 2003.
- ↑ Tromp, T. K., R-L Shia, M. Allen, J. M. Eiler et Y. L. Yung, Potential environmental impact of a hydrogen economy on the stratosphere, Science 300, 1740-1742, 2003.
Voir aussi
Articles connexes
Liens externes
- (fr) Association française de l'hydrogène
- (fr) Réseau européen/Pôle de compétence
- (fr) H2 Développement
- (fr) CEA Technologies L'hydrogène, les nouvelles technologies de l'énergie (Clefs CEA no 50-51) 23 mars 2005.
- (fr) L'hydrogène vu par le CEA
- (fr) INERIS : retour d'expérience lié aux difficultés de stockage
- (fr) L'hydrogène vu par la Société Française de Chimie
- (fr) La controverse en ce qui concerne l'utilisation de l'hydrogène comme carburant
- (fr) Tout sur l'Alternative Hydrogène, avec une revue de presse, des liens internet et des vidéos
- Portail de la chimie
Catégories : Produit chimique extrêmement inflammable | Composé de l'hydrogène | Gaz inorganique | Hydrogène
Wikimedia Foundation. 2010.