- Butane
-
Butane 
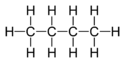

Structure et représentations du butaneGénéral Nom IUPAC butane Synonymes n-butane
diéthyle
méthyléthylméthane.No CAS No EINECS No RTECS PubChem SMILES InChI Apparence gaz comprimé liquéfié, inodore, incolore[1]. Propriétés chimiques Formule brute C4H10 [Isomères] Masse molaire[2] 58,1222 ± 0,0039 g·mol-1
C 82,66 %, H 17,34 %,Propriétés physiques T° fusion −138,29 °C [3] T° ébullition −0,5 °C [3] Solubilité 61,2 mg·l-1 (eau, 25 °C) [4] Masse volumique 0,6011 kg·l-1 (liquide,−0,5 °C)
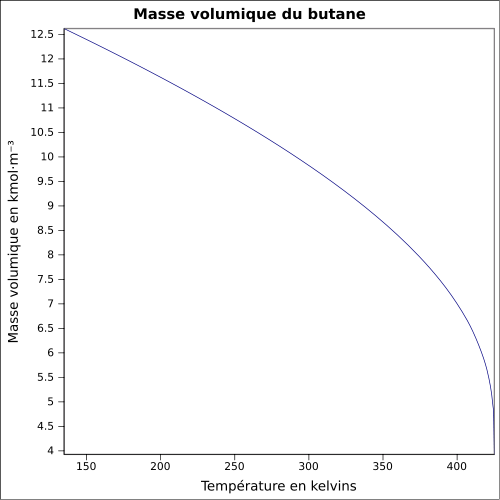
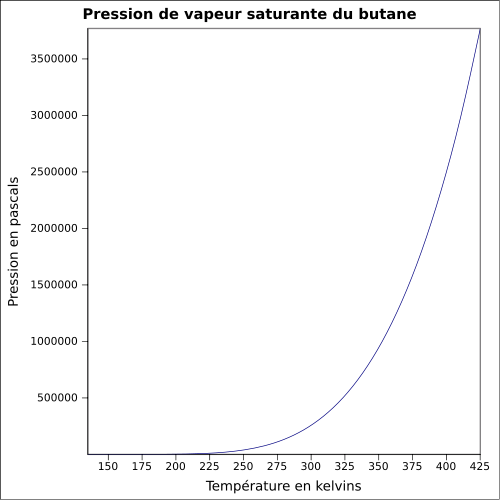
2,709 kg·m-3 (gaz,25 °C, 1 013 mbar)[3]T° d'auto-inflammation 287 °C [1] Point d’éclair -60 °C [1] Limites d’explosivité dans l’air 1,8–8,4 % vol[1] Pression de vapeur saturante 2,081 bar à 20 °C
2,8 bar à 30 °C
4,9 bar à 50 °C [3]Point critique 151,85 °C
38,0 bar
0,255 l·mol-1 [6]Point triple -138,55 °C
0,007 mbar [6]Vitesse du son 1 034 m·s-1 (liquide,-0,5 °C) [7] Thermochimie S0liquide, 1 bar 231 J·mol-1·K-1 [8] ΔfH0gaz -125,6 kJ·mol-1 [9] ΔvapH° 22,389 kJ·mol-1 à -1,1 °C [6] Cp 132,42 J·mol-1·K-1 (liquide,-3,15 °C)
98,49 J·mol-1·K-1 (gaz,25 °C) [6]PCS 49,4 MJ·kg-1 [11] PCI 45,6 MJ·kg-1 Propriétés électroniques 1re énergie d'ionisation 10,53 ± 0,10 eV (gaz)[12] Précautions Directive 67/548/EEC[13] 
F+Phrases R : 12, Phrases S : 2, 9, 16, Transport[3] 23 1011 NFPA 704 SIMDUT[14] 

SGH[15],[16] 

Danger
Avec > 0,1 % de butadiène :



DangerÉcotoxicologie LogP 2,89 [1] Seuil de l’odorat bas : 1 262 ppm
haut : 5 048 ppm[17]Unités du SI & CNTP, sauf indication contraire. Le butane est un hydrocarbure saturé de la famille des alcanes de formule brute C4H10. Il existe sous 2 formes isomères, le butane ou n-butane et le 2-méthylpropane ou isobutane.
Sommaire
Utilisation
Le butane est un gaz principalement utilisé comme combustible d'appoint (chauffe-eau, barbecue,...) notamment pour les activités à l'intérieur d'un bâtiment. On peut facilement s'en procurer sous forme de bouteille.
Au niveau industriel, le butane est un réactif pour la synthèse de l'éthylène et propylène via le vapocraquage, du butadiène au moyen de la déhydrogénation catalytique et de l'anhydride maléique par le procédé de Dupont. L'oxydation non-catalytique du butane est utilisé pour la synthèse de l'acide acétique et l'isomérisation par catalyse acide permet de convertir le n-butane en isobutane[18].
Comme de nombreux hydrocarbures, le butane réagit avec le chlore pour former du 1-chloro- et du 2-chlorobutane, mais aussi d'autres composés plus substitués. Les taux de chloration peuvent partiellement s'expliquer par les différentes énergies de dissociation, 425 et 411 kJ/mole pour les 2 types de liaisons C-H (les 2 carbones centraux ont des liaisons C-H plus faibles).
Propriétés physico-chimiques
Il est soluble dans l'alcool et l'éther, mais peu dans l'eau. Peu réactif, il nécessite un catalyseur pour participer à des réactions chimiques, sauf bien sûr pour la réaction de combustion avec le dioxygène.
Pression de vapeur saturante[19] :
Température Pression Température Pression -103,15 °C 0,1 kPa -33,15 °C 24,1 kPa -98,15 °C 0,2 kPa -28,15 °C 30,9 kPa -93,15 °C 0,3 kPa -23,15 °C 39,1 kPa -88,15 °C 0,5 kPa -18,15 °C 49,1 kPa -83,15 °C 0,8 kPa -13,15 °C 61,0 kPa -78,15 °C 1,3 kPa -8,15 °C 75,0 kPa -73,15 °C 1,9 kPa -3,15 °C 91,5 kPa -68,15 °C 2,8 kPa 1,85 °C 111 kPa -63,15 °C 4,0 kPa 6,85 °C 133 kPa -58,15 °C 5,7 kPa 11,85 °C 159 kPa -53,15 °C 7,8 kPa 16,85 °C 188 kPa -48,15 °C 10,6 kPa 21,85 °C 221 kPa -43,15 °C 14,1 kPa 26,85 °C 258 kPa -38,15 °C 18,5 kPa 50 °C 490 kPa[3] Production et synthèse
Le n-butane est obtenu par distillation sous pression du G.P.L (gaz de pétrole liquéfié) ainsi que par la purification du gaz naturel[18].
Notes et références
- BUTANE (GAZ LIQUEFIE), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « n-Butane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 5 octobre 2009 (JavaScript nécessaire)
- BUTANE sur Hazardous Substances Data Bank. Consulté le 22 décembre 2009
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Butane » sur NIST/WebBook, consulté le 11 février 2010
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 1er juillet 2010, 91e éd., 2610 p. (ISBN 9781439820773) [présentation en ligne], p. 14-40
- Aston, J.G.; Messerly, G.H., The heat capacity and entropy, heats of fusion and vaporization and the vapor pressure of n-butane, J. Am. Chem. Soc., 1940, 62, 1917-1923
- Pittam, D.A.; Pilcher, G., Measurements of heats of combustion by flame calorimetry. Part 8.-Methane, ethane, propane, n-butane and 2-methylpropane, J. Chem. Soc. Faraday Trans. 1, 1972, 68, 2224-2229
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-857-8)
- Les gaz Butane Propane
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 17 juin 2008, 89e éd., 2736 p. (ISBN 9781420066791) [présentation en ligne], p. 10-205
- « butane » sur ESIS, consulté le 15 septembre 2009
- « Butane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- n-Butane sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, 2000
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-4200-9084-0), p. 6-109
Voir aussi
Liens externes
Catégories :- Produit chimique extrêmement inflammable
- Cancérogène chimique
- Alcane linéaire
- Produit pétrolier
- Gaz combustible
- Gaz organique
- Réfrigérant
Wikimedia Foundation. 2010.