- Difluor
-
Difluor 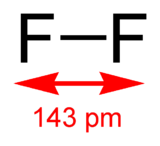
Général Nom IUPAC Difluor No CAS No EINECS Apparence gaz comprime, jaune, d'odeur acre[1]. Propriétés chimiques Formule brute F2 [Isomères] Masse molaire[2] 37,9968064 ± 1,0E-6 g·mol-1
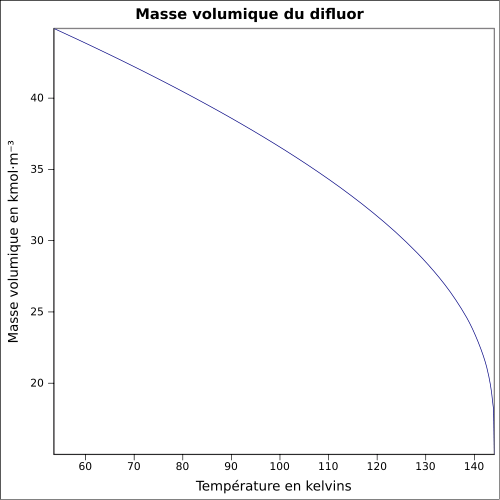
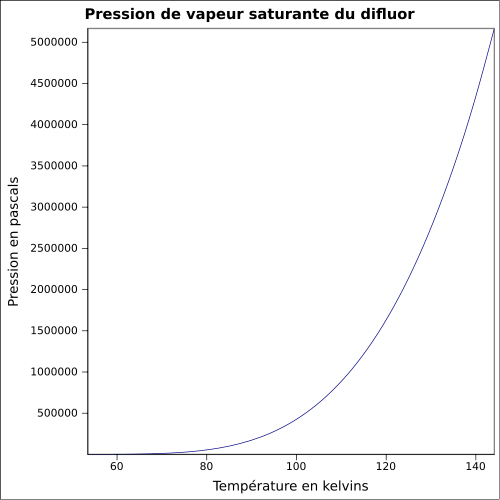
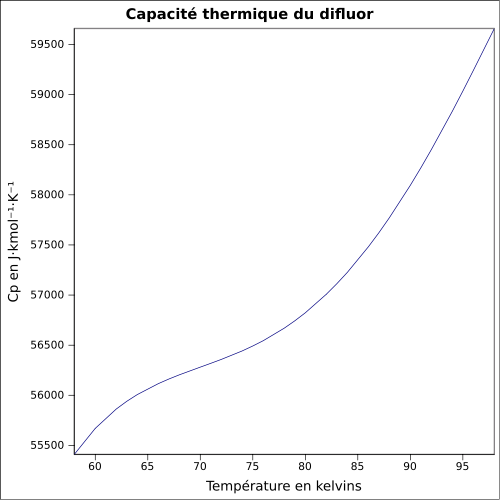
F 100 %,Propriétés physiques T° fusion -219 °C[1] T° ébullition -188 °C[1] Solubilité dans l'eau : réaction[1] Masse volumique liq à -188,13 °C : 1.5127 Pression de vapeur saturante Point critique 52,2 bar, -128,85 °C [4] Thermochimie ΔvapH° 6,62 kJ·mol-1 (1 atm, -188,12 °C)[5] Cp Propriétés électroniques 1re énergie d'ionisation 15,697 ± 0,003 eV (gaz)[6] Précautions Directive 67/548/EEC 
T+
CPhrases R : 7, 26, 35, Phrases S : (1/2), 9, 26, 36/37/39, 45, NFPA 704 SIMDUT[7] 



SGH[8] 



DangerInhalation irritation, spasmes bronchiaux, œdème pulmonaire Peau brûlures Yeux irritation, brûlures Ingestion taches dentaires, ostéosclérose Écotoxicologie CL50 rats 185 ppm (volume),
souris 150 ppm,
cochons d'Inde 170 ppmSeuil de l’odorat bas : 0,09 ppm
haut : 0,19 ppm[9]Unités du SI & CNTP, sauf indication contraire. Le difluor (F2) est une molécule formée de deux atomes de fluor.
Le difluor est un gaz jaune pâle, d'odeur irritante, difficile à liquéfier. Le difluor est l'un des corps les plus réactifs de toute la chimie ; il réagit pratiquement avec toutes les substances sauf trois gaz rares (l'hélium, le néon et l'argon), quelques polymères organiques fluorés et certains alliages spéciaux.
Ce gaz fut découvert en 1771 par le chimiste suédois Carl Wilhelm Scheele et fut isolé en 1886 par le chimiste français Henri Moissan.
Voir aussi
Références
- FLUOR, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « Fluor » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Fluorine sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
Catégories :- Produit chimique très toxique
- Produit chimique corrosif
- Produit chimique qui réagit avec l'eau
- Gaz inorganique
- Composé du fluor
Wikimedia Foundation. 2010.