- Faibles doses d'irradiation
-
En radiobiologie, les faibles doses d'irradiation sont des accumulations de petites irradiations d'origine variées, qui se situent à un niveau très faible, largement inférieur à celui où l'on commence à voir apparaître un effet déterministe (brûlures ou syndrome d'irradiation aiguë pour des expositions supérieures au gray) ou un effet stochastique (leucémies ou autres formes de cancers, ou mutation génétique pour des expositions supérieures au centigray).
Si ces faibles doses ont un effet, celui-ci ne peut pas être étudié statistiquement, par des études épidémiologiques directes. L’estimation des risques pour des faibles doses d’irradiation est basée sur l’extrapolation des effets cancérogènes observés à fortes doses, entre 0,2 et 3 sieverts (1 Sv = 1 Gy corrigé pour les effets de dose équivalente et de dose efficace).
À un niveau microscopique, il est certain que l'effet physique et chimique élémentaire d'un rayonnement ne dépend que de sa nature, et non de la dose. Cependant, la traduction biologique de cet effet jusqu'à sa manifestation macroscopique est un processus complexe, que l'on commence à peine à découvrir. Globalement, l'effet exact de ces faibles doses d'irradiations, ainsi que la relation dose-effet associée, sont encore des questions ouvertes.
C'est principalement dans ce domaine de doses, inférieures à une dizaine de millisieverts par an, que la plus grande partie de la population se trouve exposée, que ce soit par l'irradiation naturelle (principalement due au radon), ou par des examens radiologiques, voire par les activités de l'industrie nucléaire. Ceci en fait un sujet polémique, et qui a une incidence directe sur l'optimisation des politiques de radioprotection et de santé publique.
 L'effet des rayonnements ionisants à très faible dose est une question ouverte.
L'effet des rayonnements ionisants à très faible dose est une question ouverte.
Sommaire
Approche linéaire historique
Études des fortes doses
L'effet nocif des irradiations aux fortes doses a été identifié dès le début du XXe siècle : Henri Becquerel et Pierre et Marie Curie ont présenté des brûlures parce qu'ils manipulaient sans précaution des produits radioactifs. La première étude documentant les effets sur la peau date de 1896. Le premier cancer de la peau radio-induit est décrit en 1902, le premier cancer expérimental en 1910. La guerre de 1914-1918 a vu un développement massif de la radiologie médicale, et le nombre de lésions radio-induites a été très élevé. L’action mutagène possible est mise en évidence en 1927[1].
De nombreuses études épidémiologiques ont permis d'estimer les risques des rayonnements ionisants pour des expositions entre 200 millisievert et 5 Sievert. Il n'y a guère de contestation sur le fait que ces doses produisent des effets observables, et ces effets suivent le plus souvent une loi linéaire, c'est-à-dire que le risque de développer un cancer croît proportionnellement aux doses reçues[2]. Certaines exceptions sont cependant connues, par exemple l’observation des cancers osseux induits par le radium 226 et des cancers du foie induits par le Thorotrast, ou les leucémies induites à Hiroshima et chez les patients traités par l’iode radioactif[3].
Pour les effets stochastiques, la relation entre dose d'irradiation et effet (principalement, l'apparition de cancers à long terme) se fonde principalement sur la cohorte des survivants des bombardements atomiques de Hiroshima et Nagasaki. En moyenne, l'observation de ces cohortes de survivants après un demi-siècle a montré (sur une cohorte de près de 90 000 survivants) un excès de décès de 334 cancers et 231 leucémies[4]. Cet effet est significatif pour les doses supérieures à 0,1 sievert, et le nombre de cancers augmente avec la dose reçue d'une manière grossièrement proportionnelle.
Si l'on divise l'excès de cancers par l'exposition moyenne, on constate que pour ces expositions, l'excès de cancers est de l'ordre de 5% de cancer par sievert. Il y a cependant de fortes incertitudes sur les doses effectivement reçues par les différents survivants, et ceux exposés à de très fortes doses ont majoritairement succombé aux conséquences immédiates des explosions. En l'absence de données permettant d'atteindre davantage de précision, ce ratio de 5% de cancers en excès par sievert est généralement accepté, et il sert donc de fondement à l'estimation du risque retenue par la CIPR.
Mais ces données ne permettent d'observer directement que l'effet de doses relativement fortes, soit >100 mSv chez l'adulte. Dans le cas d'irradiations de foetus in utero, un excès de cancers et de leucémies a été signalé « dès la première radiographie », ce qui correspondait autrefois à des doses variables, de l'ordre de quelques dizaines de mSv[5],[6] Est-il légitime d'extrapoler ces conclusions aux domaines des faibles doses, pour lesquelles on n'observe pas d'effet direct ? Cette question est polémique.
Études aux expositions limites
Les études qui concluent à un « effet de faibles doses d'irradiation » ne détectent en réalité cet effet que sur des plus fortes des doses étudiées, qui restent de l'ordre du Gray.
Ainsi, une étude danoise « cas-témoins » a pu conclure que l'exposition chronique et domestique au radon domestique combinée à la pollution automobile de l'air augmentait significativement le risque de leucémie infantile[7],[8] ; cependant l'effet constaté par cette étude étant décelé pour des expositions au radon supérieures à 1000 Bq/m3.an (qui correspondrait à une exposition de l'ordre de 200 mSv, soit 2 Gray).
L'étude autorisant potentiellement la plus grande puissance statistique est celle du suivi des riverains de la rivière Techa. Ceux-ci sont exposés de manière chronique à une faible radioactivité issue de l'usine de Mayak (au sud de l'Oural en Russie), qui a produit du plutonium militaire à partir de 1948[9], et a été à l'origine de la Catastrophe de Kychtym en 1957. Une cohorte de 29 756 personnes qui avait été exposée à cette pollution radioactive y est suivie depuis 1967[10],[9]. Cette population a connu une exposition interne chronique (incorporation de cesium-137, strontium-90 et strontium-89 via l'eau ou l'alimentation principalement)[9]. La dose moyenne cumulée à la moelle osseuse a été estimée à 0,3 Gray, résultant à 92 % d'une exposition interne[9]. Le degré de fiabilité statistique de ces résultats est comparable selon les auteurs à celui des suivis qui ont suivi les effets des bombes d'Hiroshima et Nagasaki[9] (mais pour des débits de doses très différents, dans ce dernier cas les personnes les plus exposées l'ont été quelques secondes, par voie externe essentiellement, et par des rayonnements ionisants très différents).
Des études par cas témoins sur la mortalité au sein de cette cohorte avaient dès 1999 mis en évidence une association significative entre exposition aux radiations et tous les types de leucémies. Selon les données disponibles en 2005, l’excès de risque relatif (ERR) par Gray correspondant (hors lymphoides chroniques) était de 4,9, et 59 % des leucémies (hors lymphoïdes chroniques) observés dans cette cohorte pourraient être attribuables à l’exposition aux rayonnements ionisants[9]. Ces résultats doivent encore être complétés et précisés par les mêmes auteurs, mais ils invitent à conclure qu'une exposition chronique à de faibles doses (moins de 0,5 Gy à la moelle osseuse), via une contamination principalement interne est effectivement un facteur de risque de leucémie (hors lymphoïdes chroniques)[9]. Cependant, cette étude ne montre des résultats statistiquement significatifs que pour des expositions calculées supérieures au Gray[11].
Limites des études statistiques
Sur le plan épidémiologique, il n’y a pas de divergence, tous les rapports considèrent qu’il n’y a pas de preuve d’un effet cancérogène pour des doses inférieures à 100 mSv[12]. Les études épidémiologiques disponibles ne décèlent aucun effet pour des doses inférieures à 100 mSv, soit qu’il n’en existe pas, soit que la puissance statistique des enquêtes ait été insuffisante pour les détecter[13].
Il n'est pas possible d'observer directement un faible effet de faibles doses d'irradiation, car par ailleurs des cancers apparaissent dans la population de manière apparemment aléatoire, avec une certaine moyenne, et des variations aléatoires autour de cette moyenne qui provoquent un « bruit » statistique. Pour que l'effet d'une faible dose soit observable, il doit être nettement supérieur au niveau des variations aléatoires (le rapport signal sur bruit doit être suffisant). Comme le signal augmente proportionnellement à la taille N de la population, et le bruit des fluctuations, proportionnel à l'écart-type, varie avec la racine carrée de N, le rapport signal/bruit s'améliore comme la racine de N. Pour observer un effet avec une précision de l'ordre du pour-cent, il faut une population N de l'ordre de 10 000 ; pour observer l'effet supposé des faibles doses, qui est mille fois plus faible, il faudra une population N un million de fois plus importante - c'est-à-dire faire un suivi personnel de toute la population terrestre, ce qui est évidemment impossible. S'il faut un échantillon de 500 personnes pour quantifier l'effet d'une dose de 1000 mSv, il faudra (dans l'hypothèse où l'effet est linéaire) un échantillon de 50 000 personnes pour quantifier l'effet d'une dose de 100 mSv, et ≈5 millions pour 10 mSv[14].
Article détaillé : Intervalle de confiance.Cependant, bien qu’à de faibles niveaux de dose d’irradiation, aucun effet sur la santé n’ait été observé au cours de la très grande majorité des études épidémiologiques, l’absence d’effets décelables ne permet pas d’exclure l’existence d’un risque.
L'approche « linéaire sans seuil »
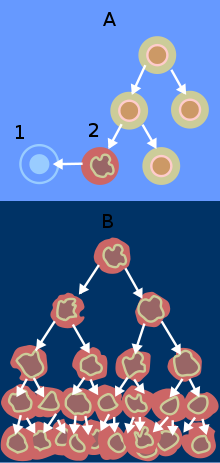 Normalement (A) les cellules endommagées (2) sont éliminées par apoptose (1). Les cellules cancéreuses (B) ne sont pas éliminées et prolifèrent.
Normalement (A) les cellules endommagées (2) sont éliminées par apoptose (1). Les cellules cancéreuses (B) ne sont pas éliminées et prolifèrent.
L'approche la plus simple est celle du modèle « linéaire sans seuil », qui postule que le nombre de cancers induits par une exposition aux rayonnements ionisants varie de manière linéaire avec la dose reçue, et sans seuil en deçà duquel on puisse considérer qu'une exposition serait sans effet.
Le modèle linéaire découle directement de l'image de la cible : a priori, on peut considérer que chaque rayonnement ionisant a une certaine probabilité de toucher sa « cible » d'ADN, chaque impact provoque une anomalie génétique qui dérègle la cellule et a une certaine probabilité de déclencher un cancer ; à partir du moment où une seule particule est susceptible de provoquer un cancer (avec une probabilité si faible soit-elle), la probabilité globale d'observer un cancer ne peut que croître linéairement avec la dose reçue[15].
La justification avancée par certains auteurs[16],[14] se fonde sur les arguments suivants[13] :
- L'étude statistique directe montre qu'une augmentation du risque de cancer peut être statistiquement mise en évidence pour des expositions aux rayons X pour des doses (par organe) de 10 mGy. L’effet cancérogène de doses de l’ordre de 10 mSv est prouvé chez l’homme par les résultats des études sur l’irradiation in utero. À partir de 10 mGy, la relation linéaire sans seuil rend compte de manière correcte de la relation dose-effet pour l’induction de tumeurs solides dans la cohorte d’Hiroshima et Nagasaki.
- Aux doses inférieures à 10 mSv, les cellules irradiées ne sont traversées que par une seule trajectoire (ou un très faible nombre de trajectoires indépendantes), et il n’y a pas d’interaction entre les différents événements physiques initiés le long des différentes trajectoires : en l'absence d'interaction, l'effet de chaque trajectoire sur une cellule est un évènement stochastique indépendant.
- La nature des lésions ainsi causées et la probabilité de réparation fidèle ou fautive et d’élimination par la mort des cellules lésées ne dépendent ni de la dose ni du débit. Réduire la dose ne fait que diminuer le nombre de cellules touchées, mais en l'absence d'interaction, le dommage initial et le devenir d'une cellule touchée sont les mêmes, que la dose macroscopique soit 10 mGy ou plus petite. Rien ne permet de penser que des processus biologiques soient par exemple actifs à 10 mGy et inactivés à 1 mGy, ou vice versa.
- Le cancer est la conséquence directe et aléatoire d’une lésion de l’ADN dans une cellule apte à se diviser et la probabilité pour qu’une cellule initiée donne naissance à un cancer n’est pas influencée par les lésions dans les cellules voisines et les tissus.
Le monde des faibles doses
Unités d'irradiation
 Mesure de la radioactivité ambiante dégagée par le générateur atomique de la sonde Cassini, qui fonctionne au plutonium-238.
Mesure de la radioactivité ambiante dégagée par le générateur atomique de la sonde Cassini, qui fonctionne au plutonium-238.
Ces faibles irradiations s'expriment dans des unités (sievert, becquerel,...) étranges et inconnues du public :
- L'unité utilisée pour mesurer une irradiation physique est le gray. Le gray mesure une énergie fournie par unité de masse, indépendamment de ses effets biologiques. La température augmente pour des puissances de l'ordre du kilogray[17], et le mégagray est l'ordre de grandeur de ce qu'il faut pour cuire un rôti dans un four à micro-ondes[18]. Les irradiations rencontrées en radiobiologie correspondent à des énergies par unité de masse beaucoup plus faibles, insuffisantes pour chauffer la matière exposée. On le rencontre généralement pour exprimer des irradiations assez fortes, de l'ordre du gray (Gy), ou éventuellement du centigray (cGy) pour des expériences de « faibles irradiations » (qui ont néanmoins des effets mesurables).
- L'ancienne unité du rad, que l'on retrouve encore dans de nombreuses publications, correspond au centigray (ce qui explique que ce sous-multiple soit fréquemment utilisé). On a donc 1 cGy = 1 rad. En termes de radioprotection, le rad est une unité d'un bon ordre de grandeur : en dessous, les effets radio-biologiques sont négligeables ; un opérateur peut évoluer à titre exceptionnel dans des environnements de quelques rad, mais sous surveillance et pas trop longtemps ; et des flux de quelques centaines ou milliers de rad / heure imposent en pratique de travailler par télé-opération.
- L'unité normalement utilisée pour mesurer l'effet précis d'une irradiation sur un organisme est le sievert, qui inclut un terme correcteur pour tenir compte de l'effet relatif des différentes particules : se dorer au Soleil peut conduire à une exposition de quelques milliers de grays (on chauffe), mais cette exposition est due à un rayonnement infra-rouge, qui n'induit aucun effet ionisant sur l'organisme. Les « faibles doses » sont typiquement exprimées en milli-, voire en microsievert. Si l'on néglige ces termes correcteurs, les irradiations exprimées en sievert ou en gray sont du même ordre de grandeur pour les rayonnements habituellement rencontrés en radio-protection.
- L'unité utilisée pour mesurer l'activité d'une source radioactive est le Becquerel, qui est un nombre de désintégration radioactives par seconde. Il permet de mesurer indirectement la quantité de matière radioactive présente, connaissant par ailleurs l'activité massique du radionucléide concerné. Le Becquerel est une unité très petite, parce que le moindre atome qui se désintègre est comptabilisé, et il y a beaucoup d'atomes dans une quantité pondérale de matière (voir nombre d'Avogadro). Un corps humain moyen a ainsi une activité naturelle de dix mille Becquerel. La conversion entre l'activité (exprimée en Becquerel) et l'effet biologique (exprimé en sievert) dépend de la nature et de l'énergie des rayonnements impliqués, mais correspond toujours à un facteur extrêmement faible : L'auto-irradiation du fait de la radioactivité naturelle du corps humain (10.000 Bq) induit une exposition de 0,2 mSv/an, soit 20 micro-sievert par kilo-becquerel (µSv/kBq) et par an.
D'autre part, les « faibles doses » correspondent à des domaines de doses ou de débits qui peuvent être très variés mais sont souvent amalgamés. On peut facilement détecter des radioactivités de l'ordre du Becquerel, qui correspondent à une irradiation de l'ordre du nano- voire pico-sievert : la différence entre l'irradiation détectable par les moyens modernes et celle dont on sait qu'elle a des effets prouvés est de neuf ordres de grandeur - c'est la même différence qu'entre boire une goutte (1 mm3) de whisky dans toute sa vie, et en boire dix litres par jour.
Sources d'irradiation
 Dose moyenne de radiation en Allemagne en 2005. La dose effective reçue de radiations d'origine naturelle ou artificielle est en moyenne de 3.9 mSv en Allemagne. Les irradiations d'origine naturelle, et celles d'origine médicale (en particulier les examens aux rayons X) contribuent chacune pour à peu près la moitié de ce total. En regard des irradiations naturelles ou médicales, et compte tenu de la variation considérable de ces irradiations, toutes les autres contributions sont en pratique négligeables.
Dose moyenne de radiation en Allemagne en 2005. La dose effective reçue de radiations d'origine naturelle ou artificielle est en moyenne de 3.9 mSv en Allemagne. Les irradiations d'origine naturelle, et celles d'origine médicale (en particulier les examens aux rayons X) contribuent chacune pour à peu près la moitié de ce total. En regard des irradiations naturelles ou médicales, et compte tenu de la variation considérable de ces irradiations, toutes les autres contributions sont en pratique négligeables.
La principale source d'irradiation est naturelle. Le niveau de l’exposition naturelle varie selon le lieu, généralement dans le rapport de un à trois. Dans de nombreux endroits il peut être beaucoup plus élevé[19].
L'irradiation naturelle provient principalement du radon, un gaz radioactif produit par les traces d'uranium présentes dans certaines roches comme le granite. Ce gaz émane du sol (dans des proportions très variables suivant la nature du terrain) et peut se concentrer dans les habitations mal ventilées. Le radon conduit à une exposition qui peut être très variable, de 1 à 100 mSv/an[20]. En dehors du radon, l'irradiation due aux substances minérales radioactive peut également être importante localement, à proximité de gisements à haute teneur en uranium ou en thorium, ou encore plus rarement, dans des maisons accidentellement construites avec de telles roches ; mais une faible activité naturelle peut être mesurée dans tout matériau de construction : plâtre, brique, béton... L'exposition correspondante est également très variable, de 0,1 à 1000 mSv/an[20].
Les rayons cosmiques sont également une source notable d'irradiation naturelle, d'autant plus forte que l'on est en altitude. Au niveau de la mer et sous des latitudes moyennes, la dose est voisine de 0,3 mSv/an[20]. C'est à cause des rayons cosmiques que l'irradiation moyenne augmente avec les voyages en avion.
Les substances radioactives présentes dans la nature sont également une source d'irradiation : 10% de l'irradiation moyenne reçue par une personne provient de son propre corps, principalement du fait de la désintégration du carbone 14 et du Potassium 40 (principalement présent dans les os). Cette irradiation est pratiquement constante[20].
L'homme est également soumis à des rayonnements provenant de sources artificielles. La radioexposition peut résulter de l’activité professionnelle (radiologue, travailleur de l'industrie nucléaire,...), et dans ce cas, dépend très largement de cette activité. Le niveau moyen de radioexposition professionnelle est généralement comparable à celui de l’exposition au rayonnement naturel, mais un faible pourcentage de travailleurs reçoivent des doses plusieurs fois supérieures à cette dernière. L’exposition des travailleurs est soumise à des limites internationalement reconnues, qui sont environ 10 fois supérieures à l’exposition moyenne au rayonnement naturel[19].
La principale cause d'irradiation est médicale, reçue lors de radiographies. Cette irradiation varie avec les pratiques médicales. Le niveau moyen d’exposition dû aux utilisations médicales des rayonnements dans les pays développés est équivalent à environ 50 % de l’exposition moyenne au rayonnement naturel dans le monde[19].
Certaines activités humaines contribuent à amplifier l'irradiation naturelle : c’est le cas par exemple de l’extraction et de l’utilisation de minerais contenant des substances radioactives et de la production énergie lorsque l’on brûle du charbon contenant de telles substances[19]. Le charbon contient du potassium-40, de l'uranium et du thorium, et sa combustion les concentre d'un facteur 10 dans les cendres ; une partie de cette radioactivité naturelle est également rejetée dans les fumées et contribue à augmenter légèrement l'exposition de l'homme (du même ordre de grandeur que les rejets des centrales nucléaires, c'est-à-dire de l'ordre du micro-sievert par an)[20].
D'autres sources s'analysent comme une pollution résultant d'activités techniques, comme les retombées des essais aériens des armes nucléaires, les retombées de l'accident de Tchernobyl ainsi que les rejets industriels. La dose effective annuelle moyenne sur la population mondiale a atteint un pic de 150 μ Sv en 1963, puis a diminué et est de 5 μ Sv en 2000. Ces doses annuelles sont restées relativement faibles, atteignant au maximum environ 7 % du rayonnement naturel[19]. En France, l'impact moyen des rejets industriels (réacteurs, industrie du combustible, traitement des déchets) est inférieur à quelques millièmes de la radioactivité naturelle[21]. Ces activités n’entraînent généralement des expositions qui ne correspondent qu’à une faible fraction de la dose moyenne d’irradiation naturelle dans le monde. Toutefois, certains groupes de population, au voisinage d’installations rejetant des matières radioactives dans l’environnement, peuvent recevoir des doses plus élevées[19].
Les téléphones portables ou les lignes à haute tension génèrent des rayonnements électromagnétiques de fréquence beaucoup trop faible pour être des rayonnements ionisants. Ils ne sont pas une source d'irradiation.
Modes d'irradiation
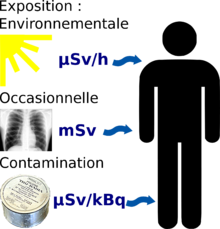
Les faibles doses d'irradiations peuvent être reçues suivant trois modalités assez différentes.
Les expositions aux faibles doses ponctuelles, reçues en une seule fois, sont mesurées en milli-sievert. Elles correspondent la plupart du temps, pour le public, à des radiographies ou des gammagraphies nécessaires pour des diagnostics médicaux. Plus rarement, en cas d'accident radiologique, des personnes peuvent également être exposées à de faibles doses d'irradiation : personnes mises en présence d'une source radioactive à plus grande distance et/ou pendant un temps suffisamment bref ; personnes se trouvant à proximité d'un accident de criticité. En cas d'accident nucléaire, c'est également la dose globale qu'il faut considérer pour pronostiquer le risque associé aux victimes d'une explosion atomique, ou des retombées radioactives
Une exposition continue ou répétée à un environnement irradiant expose à un débit de dose plus ou moins élevé, mesuré en micro-sievert par heure. Ce peut être un environnement de travail (cabinet médical de radiologie, travailleur de l'industrie nucléaire) ou d'habitation (effet de vivre en altitude, ou dans une région riche en uranium ou en thorium).
Enfin, une contamination interne par des substances radioactives (que ce soit par inhalation, ingestion, ou à travers une blessure) expose l'organisme à des rayonnements faibles, mais directement en contact avec les tissus, et sur une durée potentiellement longue (fonction de la période biologique du radioisotope, de son mode d'ingestion, de son état chimique,...). Ces contaminations se mesurent en becquerel, et la plus ou moins grande radiotoxicité de la substance (et s'il y en a, de ses descendants radioactifs le long de la chaîne de désintégration) est évaluée en sievert par becquerel (l'unité typique étant le µSv/kBq).
L'exposition au radon peut être vue comme un cas intermédiaire entre environnement irradiant et contamination. Ce n'est pas le radon lui-même qui pose un problème radiologique, mais ses descendants bloqués dans les poumons sous forme de micro-particule. Pour cette raison, une atmosphère chargée en radon est surtout considérée comme un environnement contaminant, diffusant un « terme source ». La teneur en radon est mesurée en becquerel par mètres cubes, et le séjour dans une atmosphère chargée en radon entraîne surtout une contamination interne des poumons par les descendants du radon, à un niveau estimé à 2,46.10-9 sievert par heure de séjour et par Becquerel par m3[22].
Conséquences sanitaires étudiées
Ces trois types d'exposition se traduisent en fin de compte par des milli-sievert, mais suivant des modes très différents. Dans les deux derniers, le faible débit de dose permet à l'organisme de cicatriser, et ne conduit pratiquement jamais à un syndrome d'irradiation aiguë[23]. Dans les deux premiers cas, l'irradiation est le fait du rayonnement gamma (ou, beaucoup plus rarement, de neutrons), alors que dans le troisième cas l'irradiation est surtout le fait de rayonnement alpha.
En termes de radiobiologie, les différences entre ces modes d'irradiation sont très mal connues. Les expériences sur l'effet biologique des irradiations explorent les irradiations en une seule exposition (ou un petit nombre d'expositions) pour lesquelles un effet peut être constaté, au moins de l'ordre du centigray, parce qu'il n'y a pas de moyen simple d'observer un effet net sur les autres types d'expositions. Les expositions à long terme à des faibles débits de doses ne sont pratiquement pas explorés, en dehors de quelques études sur les taux de mutation génétique. De leur côté, les effets des contaminations ne sont guère explorés qu'à travers la mesure systématique de la période biologique des radioéléments, et l'étude de leur métabolisme, qui permettent de calculer les « micro-sievert par kilo-becquerel » ; mais l'effet biologique de ces micro-sievert n'est jamais étudié en tant que tel.
Quand on reçoit pendant très longtemps un très faible débit de dose, le total peut finir par faire beaucoup, mais une même dose n'a évidemment pas les mêmes effets suivant qu'elle est reçue en une seule exposition, ou étalée sur toute une vie. Les habitants des quartiers à haute radioactivité de Ramsar, en Iran (environ 2000 habitants), vivent dans un environnement pouvant dépasser 100 mSv/an (moyenne à 10 mSv/an, maximum estimé à 260 mSv/an)[24]. A quarante ans, un habitant recevant 100 mSv/an y aura reçu une dose cumulée supérieure à 4 sieverts ; si l'on suit le modèle linéaire sans seuil, il devrait donc y avoir 20% de cancers en plus par rapport à des régions d'irradiation "normale". Rien de tel n'est observé[25],[26]. Cependant, il n'y a pas de données fiables sur l'épidémiologie du cancer de cette population[26],[27],[28]. Une étude constate par ailleurs à Ramsar à la fois un taux de stérilité féminine et un taux d'études universitaires trois fois plus élevé que le groupe témoin retenu, ces deux facteurs étant significativement corrélés[29].
Deux risques génétiques sont étudiés : principalement celui de cancer, et de manière secondaire, celui sur la fertilité et /ou tératogénicité. D'autres effets ont été signalés pour des doses d'irradiation intermédiaires : maladies cardio-vasculaires sur la cohorte de Hiroshima et Nagasaki, sur-mortalités pour la cohorte des « liquidateurs » de Tchernobyl.
Le risque de mutation génétique a été évoqué et très médiatisé dans les années 1950, à la suite des bombardements atomiques de Hiroshima et Nagasaki, et suite à l'accident provoqué par les retombées nucléaires de l'essai Castle Bravo en 1954, qui fit un mort. « Dans les années qui suivirent, et surtout suite aux observations faites sur les descendants des survivants de Hiroshima et Nagasaki, il devint clair que cette préoccupation était une sur-réaction, dues à des passions fortes suscitées par la menace d'une guerre nucléaire. »[30] Aucun effet génétique transmissible imputable à un excès d'irradiation n'a jamais été mis en évidence chez l'homme, y compris suite à l'accident de Tchernobyl[31],[32], bien que ce thème soit très récurrent et régulièrement exploité par des publications non scientifiques[33].
Ordres de grandeurs des faibles doses
Le domaine des « faibles doses » correspond aux doses inférieures à 10 mSv. Une dose peut être considérée comme reçue en une seule exposition quand la durée d'irradiation est plus faible que le temps de réparation des cassures de l'ADN par la cellule, de l'ordre de l'heure.
Niveau Dose en une exposition 1000 mSv
=1 sievertLimite des effets déterministes : apparition de la fièvre des radiations. 100 mSv Limite de l'effet statistiquement observable des excès de cancers sur les victimes de Hiroshima et Nagasaki[19]. Les systèmes de réparation de l’ADN des cellules sont activés à des doses comprises entre 10 et 100 mSv.
10 mSv En dessous du seuil de 2 cGy (20 mSv) on ne détecte plus d'augmentation de la fréquence d’aberrations chromosomiques[34]. Un scanner comportant dix coupes (voire beaucoup plus pour un scanner coronaire moderne) entraîne une exposition de 15 mSv[35]. Un scanner abdominal correspond à 12 mSv.
Les 0,5 million d'habitants des zones faiblement contaminées aux alentours de Tchernobyl recevront une dose cumulée sur 70 ans de l'ordre de 14 mSv[14].
1 mSv
1000 µSvUne exposition de l’ensemble de l’organisme à 1 mGy entraîne, en moyenne, la traversée de chaque cellule par un électron[36]. L'irridiation par scintigraphie est de l'ordre de 4 mSv lors de l'étude des os, et 2 mSv pour l'examen de la thyroïde[35].
100 µSv Une radiographie des poumons entraîne une dose de 0,3 mSv[37] à 1 mSv[35]. Une radiographie dentaire correspond à une dose de 0,2 mSv. L'exposition moyenne due aux retombées des essais nucléaires atmosphériques a atteint un pic en 1963 avec 0,15 mSv[38]. 10 µSv Un voyage Paris-New York aller et retour : 0,06 mSv[37] 1 µSv Les radionucléides contenus dans une cigarette entraînent en moyenne une exposition aux rayonnements de 7,3 µSv par cigarette[39] (outre l'exposition aux goudrons cancérigènes). Ordres de grandeurs des faibles débits de doses
Article détaillé : Débit de dose radioactive.La limite du domaine des « faibles débits de dose », en dessous de laquelle aucun effet biologique n'a été détecté, peut être placée vers 1 mSv/h, voire 100 µSv/h, c'est-à-dire les limites réglementaires des zones contrôlées marquées « zones jaunes » en France.
Ces débits de dose sont mesurés en milli- ou micro-sievert par heure ou par an. Il s'agit dans la quasi-totalité des cas d'une irradiation par rayonnement gamma (ou par rayonnement X pour les cabinets médicaux). Cependant, les irradiations reçues à proximité immédiate d'un réacteur nucléaire (jusqu'à quelques dizaines de mètres) sont au contraire surtout dues aux flux de neutrons qui s'échappent du cœur (ce qui impose d'utiliser des dosimètres spéciaux). Des neutrons sont également présents dans les rayonnements cosmiques.
Un faible débit de dose entraîne en pratique une faible exposition, quelle que soit sa durée. Ce n'est que pour les forts débits de dose, reçus dans des environnements exceptionnels, que l'on fait le calcul inverse : A la limite entre « zone orange » et « zone rouge », où le débit de dose serait de 100 mSv/h, on peut transiter pendant 6 minutes avant de recevoir une dose de 10 mSv (réglementairement acceptable en circonstances exceptionnelles), et il faut rester plusieurs heures pour atteindre une dose de un sievert (niveau où apparaît la fièvre des radiations). Pour ces forts débits de dose, l'exposition est normalement exceptionnelle, la durée d'exposition est normalement inférieure à l'heure, et c'est la dose totale reçue en une seule exposition qu'il faut considérer pour en évaluer l'impact sanitaire.
Niveau Débit de dose 
100 mSv/h - « zone interdite » indiquée par une zone rouge : plus de 100 mSv/h
- Le débit de dose pour lequel le nombre de cassure double brin dû à l’irradiation est égal à celui produit pendant le même temps par le métabolisme cellulaire chez les cellules en prolifération (CDB endogènes) est de 5 mGy /min (300 mGy / h) ; ce nombre est de 0,14 CDB par minute dans les 2 cas[36].
- Cassures double brin de l'ADN supérieures au taux de réparation. Dislocations excédant les capacités de réparation cellulaires. Effets cumulatifs dépendant de la dose totale.

10 mSv/h - « zone contrôlée » en zones orange (spécialement réglementée) : de 2 à 100 mSv/h
- Taux de cassure double brin de l'ADN (~1/cGy) de l'ordre du taux de réparation (~ heure). Apparition éventuelle de phénomènes spécifiquement radio-induits aux expositions prolongées.
- Quand on irradie des souris tout au long de leur vie, à des expositions de 1.5 Gy/semaine (9 mGy/h), 2.2 Gy/semaine(13 mGy/h), et 3 Gy/semaine (18 mGy/h), le pourcentage de souris qui contracte un cancer de la peau est respectivement de 0%, 35%, et 100%, démontrant clairement une réponse à seuil[40]

1 mSv/h
1000 µSv/h- Limite réglementaires inférieure des « zones contrôlées » en zones orange (spécialement réglementée) : à partir de 2 mSv/h
- 1 mSv/h reçu pendant un an entraîne une exposition totale de 8,76 Sv
- Des rats mâles restent fertiles pendant 10 générations s'ils sont exposés à 20 mSv par jour mais un accroissement, même léger, au-delà de cette limite inhibe totalement la spermatogenèse[41].

100 µSv/h - Limites réglementaires des « zone contrôlée » en zones jaunes (spécialement réglementée) : de 0.025 à 2 mSv/h
- Au contact d'un minerai d'uranium d'une activité de 20 000 c/s (20 kBq, soit de l'ordre d'un gramme d'uranium) on subit un débit de dose de 79 µSv/h[42].
- Niveau de radiation détecté sur la plage de sable noir de monazite de Guarapari au Brésil (131 μSv/h)[43] ou dans certaines maisons de Ramsar en Iran (130μGy/h)[44].

100 mSv/an
11 µSv/h- Exposition annuelle de la population aux rayonnements naturels supérieure à 100 mSv dans de larges régions comme le Kerala en Inde (expositions de l'ordre de 10 à 32 mSv/an)[45] ou les quartiers à radioactivité naturelle élevée de la ville de Ramsar en Iran (1800 habitants exposés, moyenne à 10 mSv/an, maximum théorique calculé à 260 mSv/an)[3].
- Irradiation dans la station spatiale internationale : 170 mSv / an[14],[46].
- Limite réglementaire des « zones contrôlées » (zone verte) : de 7.5 µSv/h à 25 µSv/h.

10 mSv/an
1,1 µSv/h- Il faut conserver sur soi plusieurs kg d'uranium pour s'exposer à un débit de 50 mSv/an[47].
- La limite autorisée pour les personnels exposés, en France, est de 20 mSv sur douze mois glissants par personne (Dosimétrie réglementaire), (Dosimétrie mensuelle fixée à 1,5 mSv). (Dosimétrie fixée par les entreprises à 16 mSv/an) (Code du travail, Article R231-76).
- L’inhalation de la fumée par une personne consommant 1,5 paquets de cigarettes par jour conduit à des doses au système trachéobronchial de l’ordre de 80 mSv/an[39] (outre le dépôt de goudron cancérigène), du fait du polonium naturellement présent dans le tabac[48]. Un fumeur de 30 cigarettes par jour s'expose par sa présence dans la fumée à l'équivalent de dose de 300 radios de poumons par an[49].
- Limite réglementaire de l'exposition admissible du public aux rayonnements artificiels, exposition justifiant une « zone surveillée » radiologique : de 2,5 à 7,5 µSv/h, soit plus de 80 μSv par mois, ou 1 mSv par an.
- Les zones considérées comme « sans danger » et habitables à la suite de la catastrophe de Tchernobyl sont celles où la population est exposée à moins de 35 rem en 70 ans, soit 0,5 rem par an ou 5 millisievert/an (5 mSv/an)[50].

1 mSv/an
1000 µSv/an- L’irradiation naturelle (rayons cosmiques, radioéléments naturels présents dans l’organisme et la croûte terrestre) varie en France entre 1,5 mSv/an et 6 mSv/an[12]. L'exposition moyenne aux radiations naturelles dans le monde est estimée de l'ordre de 2,5 mSv / an[51].
- La limite autorisée pour l'exposition de la population aux rayonnements artificiels, en France : 1 mSv/an/personne (Code de la santé publique, Article R1333-8). Elle était de 5 mSv/an en 1998[35].
- L'exposition annuelle due aux examens médicaux est en moyenne de 1 mSv/an[3].
- La CIPR propose pour le radon un coefficient de conversion de 1 millisievert par an pour 66 Bq/m3[52].
- La conservation à domicile d’un bloc de minerai d'uranium de 5 kg d’une activité de 1,5 MBq induit un débit de dose de 0,4 µSv/h ; et l’ordre de grandeur de la dose efficace sera de 1,75 mSv/an, sur la base d’un temps de présence journalier de 12h à une distance de 1 m de l’échantillon[53].

100 µSv/an - Pour l’évaluation de la performance du stockage des déchets radioactifs en couche géologique profonde, la dose reçue doit être inférieure à 0,25 mSv par an (limite retenue par l'Andra) dans le scénario le plus pénalisant[54].
- L'auto-irradiation du fait de la radioactivité naturelle du corps humain induit une exposition de 0,2 mSv/an. Cette dose présente la caractéristique d’être à peu près constante, quelle que soit la corpulence de l’individu et la région géographique[3].
- Les recommandations de l’OMS sur les critères de potabilité de l’eau de boisson sont que la dose reçue du fait de la présence d’un radionucléide dans l’eau de boisson ne dépasse pas 0.1 mSv/an[55].
- L'irradiation reçue au voisinage du centre de stockage de l'Aube (CSFMA), pour une personne passant 24h/24 à la clôture, 365 jours par an, est évaluée à 0,14 mSv/an[56].
10 µSv/an - L'exposition moyenne liée à la production d’électricité par énergie nucléaire (extraction et traitement de l’uranium, fonctionnement des réacteurs, rejets et déchets) correspondant à une exposition de l’ordre de 0,01 à 0,02 mSv par an[3].
1 µSv / an - L'exposition moyenne due aux essais nucléaires en atmosphère (sur toute la population mondiale) a été de 0,005 mSv/an et l’accident de Tchernobyl à conduit à une exposition moyenne de 0,002 mSv/an[3]. Des personnes à proximité immédiate ont évidemment pu être plus irradiées.
<1 µSv / an - L’Andra a évalué l’impact maximal que pourrait recevoir une personne séjournant en permanence à proximité du Centre de stockage de Morvilliers (TFA), du fait des éventuels rejets. La dose de radioactivité que serait susceptible de recevoir cette personne serait de l’ordre de 0,01 microsievert par an[57].
Radioprotection contre les faibles doses
Article détaillé : Radioprotection.Limites d'exposition admises
Mesure du débit d'air dans une mine d'uranium. La ventilation est nécessaire pour maintenir l'exposition au radon en dessous des seuils fixés par la réglementation ; l'exploitant peut se fixer des objectifs internes encore plus contraignants.
Pour permettre une gestion simple du risque et dans une logique de prudence, les commissions internationales ont retenu pour établir les normes la relation linéaire sans seuil fondée sur une relation de proportionnalité entre le risque et les doses reçues. Depuis sa création en 1928, la Commission internationale de protection radiologique (CIPR) produit régulièrement des recommandations sur la protection contre les rayonnements ionisants ; ces recommandations sont habituellement reprises par les organisations internationales et par les États.
Historiquement, le système de prévention des risques radiologiques a d'abord été fondé sur la notion de seuil : une exposition était jugée admissible si elle restait largement en dessous de la dose où des conséquences sanitaires apparaissent. La première limite de dose, qui date de 1938, concernait les seuls professionnels et équivalait à 500 à 700 millisieverts (mSv) par an[58],[30]. Ces fortes doses ne peuvent résulter que de situations accidentelle[58], et peuvent constituer la limite au-delà de laquelle un accident du travail doit être reconnu ; la CIPR justifiant ses limites par comparaison avec d’autres risques professionnels.
Après la seconde guerre mondiale, l’action cancérogène des rayonnements a été reconnue et il est devenu évident que des expositions inférieures aux limites peuvent avoir des conséquences graves. La CIPR recommande alors un abaissement des limites de dose : 3 mSv par semaine pour les travailleurs (soit environ 150 mSv par an) et le dixième de cette valeur pour la population (en raison de possibles risques génétiques et de la sensibilité de certains individus qui les rend particulièrement vulnérables aux rayonnements)[58]. La Publication 1 de la CIPR, de 1959, remplace la limite professionnelle hebdomadaire par une limite annuelle qui tient compte de l’accumulation des doses ; cette limite correspond à une moyenne de 50 mSv par an mais autorise des dépassements exceptionnels, bornés à 30 mSv par trimestre, soit un maximum de 120 mSv par an[58],[30]. En 1963, la CIPR s’intéresse de très près aux cancers radio-induits et aux effets héréditaires, risques potentiels des faibles doses ; et la limite annuelle est fixée à 50 mSv pour les travailleurs et à 5 mSv pour les personnes du public[58], dans la mesure (à partir de 1977) où la moyenne sur la vie ne dépasse pas 1 mSv par an.
La Publication 60 de la CIPR, publiée en 1991, fait la synthèse des travaux sur les risques de cancers radio-induits, et pose que le maximum tolérable sur la vie entière est 1 sievert pour les travailleurs et 70 mSv pour les personnes du public. Les limites de dose annuelles en sont déduites : abaissées à 20 mSv pour les premiers (avec dépassement autorisé jusqu’à 50 mSv une année, dans la mesure ou la moyenne sur 5 ans ne dépasse pas 20 mSv par an) et maintenues à 1 mSv pour les seconds[58],[30].
Le principe ALARA
 Une zone d'accès réglementé est un espace entourant une source de rayonnements ionisants situé dans un établissement ou un chantier qui se trouve assujetti à des règles particulières aux fins de radioprotection et dont l'accès est réglementé et réservé aux seules personnes autorisées. C'est dans ce périmètre que s'applique la réduction « ALARA » de l'exposition radiologique.
Une zone d'accès réglementé est un espace entourant une source de rayonnements ionisants situé dans un établissement ou un chantier qui se trouve assujetti à des règles particulières aux fins de radioprotection et dont l'accès est réglementé et réservé aux seules personnes autorisées. C'est dans ce périmètre que s'applique la réduction « ALARA » de l'exposition radiologique.
Le système de radioprotection est un système de gestion du risque radiologique aujourd'hui plutôt fondé sur le principe de précaution : le niveau de dose auquel on expose quelqu'un doit être « ALARA » dans la terminologie de la CIPR : As Low As Reasonably Achievable, aussi bas que ce que l'on peut raisonnablement atteindre, et justifié par une raison suffisante.
Cette hypothèse est moins la traduction d'une connaissance scientifique, qu'une attitude intellectuelle destinée à fonder l'action en matière de radioprotection[59]. Le principe ALARA est avant tout destiné à susciter une approche globale de la radioprotection, une radioprotection de gestion a priori des doses individuelles et collectives fondée sur la fixation d'objectifs optimisés[59], complémentaire à la surveillance des seuils de radioprotection.
Cette gestion vise un équilibre « raisonnable » entre protection et économie, le R du principe ALARA. L'obligation de comportement à caractère incitatif, qui sous-tend ce principe d'optimisation, motive les exploitants à atteindre au mieux les objectifs dosimétriques qu'ils se sont fixés en matière de gestion des niveaux d'exposition résiduels, tout en agissant au mieux des intérêts de la collectivité et de leurs intérêts propres dans le milieu concurrentiel où ils se trouvent placés[59]. L'optimisation implique que, par une analyse détaillée d'opérations envisagées et partant d'une expérience dans des situations similaires, on recherche les voies d'amélioration possibles et l'on décide, le cas échéant, la mise en œuvre de moyens supplémentaires à un coût jugé acceptable[59].
Ce principe ALARA a guidé à l'adoption ultérieure de l'hypothèse d'une relation linéaire et sans seuil considérée comme prudente au niveau des faibles doses[59]. L'instrument naturel d'une telle optimisation consiste à surveiller et réduire au mieux la dose collective, c'est-à-dire la somme des expositions reçues sur l'ensemble des « zones surveillées ». Dans ce cadre, le choix d'une approche « linéaire sans seuil » s'impose naturellement (et indépendamment de tout fondement scientifique), parce qu'elle permet d'additionner directement des expositions qui peuvent être d'intensités très variables. Ainsi, l'ensemble du personnel est conscient et solidaire de l'objectif collectif, chacun en proportion de la dose individuelle reçue.
La limite est considérée comme la frontière de la région des doses inacceptables ; les valeurs proches de la limite doivent être très strictement réglementées, et les doses proches de la limite ne sont considérées comme tolérables que dans la mesure où les niveaux d'exposition résiduels sont optimisés[59]. Le but de cette approche est de créer une culture de radioprotection, qui en fasse une préoccupation constante de tous les acteurs impliqués, et ne soit pas limitée aux seules zones réputées « dangereuses » parce que proche de la limite, mais s'étende à l'ensemble des « zones surveillées ».
Cependant, alors que l'effort doctrinal de la CIPR porte sur le principe d'optimisation, c'est paradoxalement la fixation des limites qui demeure la principale préoccupation de ceux qui ont la charge de transcrire en normes juridiques le système de gestion du risque radiologique recommandé par la CIPR[59].Position officielle de la CIPR sur l'approche linéaire
L'approche « linéaire sans seuil » est formulée par la Commission internationale de protection radiologique (CIPR) de la manière suivante :
- (§36) « À des doses de rayonnement inférieures à environ 100 mSv par an, l’augmentation de l’incidence des effets stochastiques est censée se produire, selon la Commission, avec une faible probabilité et proportionnellement à l’augmentation des doses de rayonnement au-dessus de la dose due au fond naturel. L’utilisation de ce modèle, ainsi nommé linéaire sans seuil (LNT), est considérée par la Commission comme étant la meilleure approche pratique pour gérer le risque dû à l’exposition aux rayonnements et en accord avec le « principe de précaution » (UNESCO,2005). » [60]
 Dosimètre individuel.
Dosimètre individuel.
Cette approche a été retenue par la commission pour différentes raisons. Pour certains, ces raisons sont avant tout de simplicité administrative : parce qu'elle permet d’additionner les diverses doses reçues par un travailleur au cours de son activité professionnelle quelles que soient la durée de l’exposition et la nature des rayonnements[36]. Grâce à cette approche, les limites réglementaires peuvent être constatées directement sur un dosimètre, qui additionne toutes les expositions comme le fait une pellicule photographique et fournit directement la limite réglementaire.
On note que la position officielle de la CIPR est bien différente de cette vision "administrative", et fonde son adoption du modèle linéaire sans seuil sur sa vraisemblance (à défaut de certitudes) :
- (§64) « Bien qu’il existe des exceptions reconnues, la Commission estime, à des fins de protection radiologique, que les connaissances sur les processus cellulaires fondamentaux, couplées aux données concernant la relation dose-effet, confortent l’opinion selon laquelle dans la plage des faibles doses, en dessous d’environ 100 mSv, il est scientifiquement plausible de supposer que l’incidence d’effets cancérigènes ou héréditaires croît proportionnellement à l’augmentation de la dose équivalente reçue par les organes et tissus concernés. » [60]
On notera que, si elle retient bien l'approche linéaire sans seuil pour proposer les limites d'exposition aux rayonnements, la CIPR s'oppose par contre à son utilisation pour extrapoler des calculs de risque ou de mortalité à des populations entières dans le domaine des faibles doses (le calcul par dose collective)[61] :
- (§66) « Cependant, bien que le modèle LNT reste un élément scientifiquement plausible pour son système pratique de protection radiologique, la Commission souligne le fait que des informations biologiques/épidémiologiques qui permettraient de vérifier sans ambiguïté les hypothèses sous-jacentes au modèle LNT font défaut (voir UNSCEAR, 2000 ; NCRP, 2001). En raison de cette incertitude quant aux effets sur la santé des faibles doses, la Commission estime qu’il est inapproprié, pour les besoins de la santé publique, de calculer le nombre hypothétique de cas de cancers ou de maladies héréditaires qui pourraient être associés à de très faibles doses de rayonnement reçues par un grand nombre de personnes sur de très longues périodes. » [60]
L'approche linéaire sans seuil adoptée en radioprotection ne signifie pas que les mécanismes d'induction de cancer sont intrinsèquement linéaires. Cette approche reste valide même si ces mécanismes sont non linéaires, et qu'elle correspond à une « atténuation » de ces non-linéarités. Des lois à seuil, hyper-linéaires, sub-linéaires peuvent par ailleurs être préférées pour des études scientifiques en radiobiologie, sans que ce soit contradictoire avec une approche simplifiée recommandée pour la réglementation de la radioprotection[62].
Progrès des connaissances en Radiobiologie
Article détaillé : Radiobiologie.Mécanismes de réparation
L'idée d'une loi linéaire s'appuie initialement sur l'observation des ruptures de l'ADN provoquées par les radiations ionisantes. On observe en effet que le nombre de ruptures est directement proportionnel à la dose, sans effet de seuil : il y a un effet possible dès le premier rayonnement. Cette observation de base n'est pas contestée, mais doit être complétée par l'étude du devenir de ces ruptures à travers les mécanismes que la cellule met en œuvre pour réparer l'ADN.
Dans la vie normale de la cellule, l'ADN est en permanence attaqué par des composés très réactifs, les radicaux oxygénés produits par le métabolisme cellulaire[63]. Une première ligne de défense contre ces attaques est la présence de molécules qui neutralisent les espèces réactives oxygénées, les antioxydants: les vitamines C et E, le glutathion, la catalase, la superoxyde dismutase, ...
Mais les antioxydants ne font pas tout, et l'ADN a d'autres ennemis (dépurination, déamination, dimérisation des thymines par les rayons ultra-violets...). Au final, les cellules subissent en permanence de nombreuses ruptures de l'ADN, qu'elle doivent en permanence réparer. La réparation des lésions fait intervenir les enzymes les plus remarquables que l'on connaisse. « Les ruptures simple brin sont réparées en quelques secondes ou minutes. La plupart des autres lésions sont réparées en quelques heures. »[64]
L'étude de l'effet des rayonnements ionisants sur les dommages de l'ADN[65] montre que les dommages constatés sont qualitativement les mêmes que ceux que subissent spontanément les cellules, mais pas leur distribution. Toutes proportions gardées, l'exposition d'une cellule à des rayonnements ionisants augmente la proportion de cassures double brin et de ponts ADN/ADN et ADN/protéine.
Dommage ADN Lésions spontanées/cellule/j Lésions radio-induites/Gy  Réparation de l'ADN : DNA ligase I réparant des dommages causés à un chromosome
Réparation de l'ADN : DNA ligase I réparant des dommages causés à un chromosome
Cassures simple brin 10 000 à 55 000 1000 Perte de base 12 600 Non évaluée Dommage de base 3 200 2 000 Cassure double brin 8 40 pont ADN/ADN 8 30 pont ADN-proteine quelques 150 sites multilésés Non évalué quelques  Effets des rayonnements ionisants sur l'ADN : influence du TLE.
Effets des rayonnements ionisants sur l'ADN : influence du TLE.
L'existence d'un système de réparation n'est pas en soi une objection à l'hypothèse linéaire. Les effets stochastiques des rayonnements sont la conséquence lointaine des erreurs de réparation, et il n'y a pas de raison de supposer que ces erreurs disparaissent en dessous d'un certain seuil : à partir du moment où un taux d'erreur existe, les erreurs du système se produiront en proportion de la dose.
Cependant, les travaux récents sur la réparation de l'ADN montrent que certains systèmes intracellulaires qui gouvernent la réparation ne sont déclenchés qu'au-dessus d'un seuil d'irradiation[12]. À partir du moment où ces mécanismes de réparation sont activés par une irradiation suffisante, le métabolisme cellulaire est modifié, et la réponse de la cellule aux irradiations ultérieures change de nature. La diminution après une première irradiation à faible dose de la radiosensibilité in vivo et in vitro est bien établie (phénomène d’adaptation)[12],[34].
Au-dessous de ce seuil, les défauts créés par les faibles doses et débits de dose ne sont pas réparés, et entraînent la mort de ces cellules. On constate expérimentalement une hypersensibilité individuelle des cellules aux très faibles doses, l'effet macroscopique de cette hypersensibilité étant plus que compensé par la faiblesse de la dose. Cette hypersensibilité, qui ne se manifeste plus pour des débits de dose importants, montre que la nature de la réaction cellulaire dépend de la dose. Elle montre également que certains effets, qui n'apparaissent qu'à faible dose, sont donc nécessairement sous-estimés par la loi « linéaire sans seuil », même s'il n'est pas possible de déterminer si ces effets sont nocifs pour l'organisme dans son ensemble.
L'effet à long terme dépend donc de la dose et du débit de dose : pour de nombreux gènes, la transcription des gènes cellulaires est modifiée par des doses beaucoup plus faibles (de l’ordre du mSv) que celles pour lesquelles on observe une mutagenèse ; et donc selon la dose et le débit de dose ce ne sont pas les mêmes gènes qui sont transcrits[66].
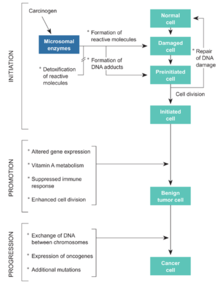
- Pour des très faibles doses d'irradiation (<10 mSv), les lésions ne sont pas réparées et le contrôle qualité de la cellule fonctionne en tout ou rien. Les lésions sont éliminées par la disparition des cellules, soit directement par apoptose (suicide cellulaire programmé par l'apparition d'un génome anormal), soit au moment d'une mitose ultérieure (l'anomalie génétique empêchant la division cellulaire, mais pas son fonctionnement). Pour ces faibles doses et débits de doses, les anomalies sont suffisamment rares pour que l'élimination des cellules anormales n'entraîne pas d'effet somatique sur le tissu.
- Des doses un peu plus élevées endommageant un nombre notable de cellules, et sont donc susceptibles de causer des lésions tissulaires. Pour des doses comprises entre 10 et 100 mSv, les systèmes de réparation de l’ADN sont activés. La réparation permet alors la survie cellulaire, mais peut générer des erreurs. Le nombre de réparations fautives mutagènes est petit mais son importance relative, par unité de dose, croît avec la dose et le débit de dose.
Par la suite, une mutation sera transmise lors de la division cellulaire, mais l'évolution de la cellule anormale dépendra de son environnement : le processus de cancérogenèse se heurte à des mécanismes efficaces de défense à l’échelle du tissu et de l’organisme, qui doivent eux-mêmes être mis en défaut pour qu'un cancer apparaisse.
Effet « bystander »
Un effet de proximité (en anglais, « bystander » désigne celui qui assiste à un accident) a été identifié dans certaines expériences, en particulier des thérapies anti-tumorales[67]. On s'est aperçu depuis quelques années que la réponse d'un tissu exposé à des radiations était coordonnée, faisant intervenir des réponses y compris de la part de cellules qui n'avaient pas été elles-mêmes irradiées. Les mécanismes impliqués ne sont pas éclaircis, mais ces études montrent qu'il n'y a pas de relation dose-effet simple aux faibles doses, que les cellules qui déclenchent une mort programmée par apoptose ne sont pas nécessairement celles qui ont été irradiées (!) et que les irradiations peuvent déclencher des instabilités du génome persistant sur plusieurs générations cellulaires[68],[69].
Ce domaine est à peine exploré[70], mais il est clair que si l'effet d'une faible dose d'irradiation est une réponse globale du tissu, la relation dose-effet peut présenter des seuils et des hystérésis, et aussi bien être en forme de "J" avec effet de seuil ou en forme de "n" avec une sur-réaction aux faibles doses. La seule chose certaine est que la logique justifiant le modèle « linéaire sans seuil », qui présuppose l'addition de réponses indépendantes de chaque cellule isolée, n'a pas de justification réelle, et qu'il n'est pas possible d'extrapoler aux faibles doses d'irradiation les effets observés aux doses plus fortes.
Cancérogenèse
On pensait que la cancérogenèse était initiée quand une lésion de l'ADN atteignait quelques cibles spécifiques : c'est ce modèle relativement simple qui avait justifié la relation « linéaire sans seuil ». Les études plus récentes ont révélé qu'en réalité ce processus de cancérogenèse d'une cellule isolée se heurte à des mécanismes efficaces de défense à l’échelle du tissu et de l’organisme, par un processus complexe faisant intervenir des relations complexes entre la cellule initiée et les cellules environnantes.
Au niveau du tissu, les mécanismes qui interviennent dans l’embryogenèse (et pour diriger la réparation tissulaire après une agression) semblent jouer un rôle pour contrôler la prolifération d’une cellule, même quand celle-ci est devenue autonome. Ce mécanisme pourrait expliquer l’absence d’effet cancérogène après contamination par de faibles quantités de radioéléments émetteurs α (phénomène dans lequel un petit nombre de cellules ont été fortement irradiées mais sont environnées par des cellules saines) avec l’existence, dans ce cas, d’un seuil chez l’homme comme chez l’animal[13]. L'effet biologique des irradiations ne paraît pas déterminé par le nombre de mutations élémentaires qu'elles créent, mais par leur poids sur le système de régulation biologique qui compense en permanence l'agression de l'ADN par les agents oxydants[71].
« Vu le mécanisme en plusieurs étapes de la carcinogenèse, on ne sait pas si la linéarité dose-effet pour la lésion primaire complexe de l'ADN et les lésions cellulaires fixées, qui sont critiques, entraîne une relation dose-effet linéaire en ce qui concerne les cancers induits par l'exposition aux rayonnements»[65].
Débat sur l'effet des faibles doses
Argumentation contre l'hypothèse « linéaire sans seuil »
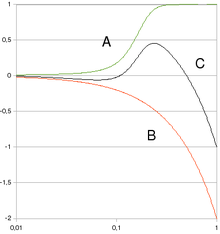
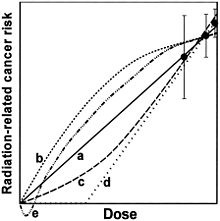 Représentation schématique de différentes extrapolations de l'excès relatif de risque vers les faibles doses d'irradiation, toutes compatibles, en principe, avec les données épidémiologiques sur les fortes doses.
Représentation schématique de différentes extrapolations de l'excès relatif de risque vers les faibles doses d'irradiation, toutes compatibles, en principe, avec les données épidémiologiques sur les fortes doses.
(a) Extrapolation linéaire.
(b) Supralinéaire en n (pente diminuant avec la dose).
(c) Courbe en J (pente augmentant avec la dose).
(d) Linéaire à effet de seuil.
(e) Hormèse, effet inverse des faibles doses.L'utilisation systématique de ce modèle « linéaire sans seuil » est contestée (depuis la fin des années 1990) par d'autres institutions, comme l'Agence internationale de l'énergie atomique ou l'Académie nationale de médecine, qui considèrent que les travaux en radiobiologie et en carcinogenèse démontrent que la relation ne peut être linéaire, et que la possibilité d'un seuil, voire d'un effet d'hormèse, doit être retenue. La relation « linéaire sans seuil » peut constituer un outil pragmatique utile pour fixer les règles de la radioprotection pour des doses supérieures à une dizaine de mSv ; mais, n’étant pas fondée sur des concepts biologiques correspondant à nos connaissances actuelles, elle ne peut pas être utilisée sans précaution pour estimer par extrapolation l’effet des faibles et surtout des très faibles doses (< 10 mSv)[13].
Ce modèle se fonde en effet sur deux hypothèses implicites, qui sont :
- la constance de la probabilité de mutation (par unité de dose) quels que soient la dose et le débit de dose ;
- l'indépendance des cellules dans le tissu, qui permet au processus de cancérogenèse, après avoir été initié dans une cellule, d'évoluer indépendamment des lésions éventuellement présentes dans les cellules environnantes.
Cependant, un organisme vivant diffère d'un dosimètre ou d'une pellicule photographique sur deux points importants : d'une part, la relation dose-effet n'est pas nécessairement linéaire, mais peut comporter des seuils en deçà desquels la nature ou l'efficacité des mécanismes de défense peut changer radicalement ; mais surtout, d'autre part, les cellules individuelles et les organismes pluricellulaires sont des systèmes complexes régulés, capables de se réparer et de se maintenir sur leur point de fonctionnement malgré des perturbations internes ou externes.
De fait, on savait que l’efficacité de la réparation de l'ADN est plus grande à faible débit de dose, mais les travaux récents en montrant l’ampleur de ces différences ont enlevé tout fondement scientifique aux extrapolations des fortes doses vers les faibles doses[13]. L’ensemble de ces données expérimentales montre une variation de l’efficacité des systèmes de réparation en fonction de la dose ou du débit de dose qui peut être causée par divers mécanismes (activation des systèmes de réparation, arrêt temporaire du cycle, augmentation de l’efficacité de la réparation quand le nombre de lésion est petit, etc.)[12]
La remise en cause de la validité des hypothèses sur lesquelles se fonde l'approche « linéaire sans seuil » ne signifie pas qu'il n'y a pas d’effet cancérogène pour des faibles doses, et de fait, les données ne permettent pas d’exclure un effet cancérogène. Cependant, cet effet peut être beaucoup plus faible par unité de dose que ce que prédit la théorie « linéaire sans seuil ». Il pourrait par exemple exister une relation dose-effet sans seuil mais non linéaire avec une baisse considérable de l’efficacité pour des doses inférieures à une dizaine de mSv, et un effet trivial pour des doses de l’ordre d’un mSv ou inférieures[12]. La superposition d'effets à seuil peut même conduire à des effets d'hormèse, où pour certaines valeurs de l'irradiation, un accroissement de la dose pourrait conduire à une diminution de l'effet.
Études statistiques
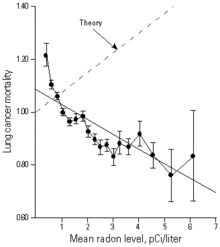
Taux de mortalité par cancer du poumon, en fonction du taux moyen de radon domestique. Comparaison entre l'hypothèse linéaire sans seuil (droite pointillée) et les données expérimentales. On observe en réalité un taux d'autant plus faible de cancers que le taux de radon est élevé.
L'hypothèse « linéaire sans seuil » a été mise à l'épreuve par le Pr Cohen[72], qui a comparé le taux de cancer du poumon et l'exposition au radon pour 1601 comtés couvrant pratiquement 90% de la population des États-Unis. Après correction des variations dues au tabagisme, l'étude montre nettement que le risque relatif de cancer du poumon diminue quand le taux de radon augmente. Ce résultat est en complète contradiction avec le modèle linéaire sans seuil proposé par le BEIR IV de 1988, l'écart atteignant 20 écarts types. L'étude du Pr Cohen examine l'effet possible de 54 facteurs socioéconomiques et 7 variables géographiques ou climatiques, sans identifier de variable explicative. L'explication naturelle du résultat statistique est que la stimulation d'un mécanisme biologique par le radon fait plus que compenser la production de cancer annoncée par la théorie, et que le radon agit en pratique comme un agent réduisant le risque de cancer dans cette zone de faible dose et de faible débit de dose[73]. Des observations similaires ont pu être faites en France[74] ou dans d'autres pays.
La région de Yangjiang, en Chine, présente un taux de radioactivité plus élevé que la moyenne, à cause de sables contenant de la monazite (un minerai de thorium). Une population de près de 80.000 personnes vit dans un environnement où le débit de dose est de l'ordre de 6.4 mSv/an, soit 4 mSv/an au-dessus de la moyenne mondiale, et a fait l'objet d'études répétées[75]. L'étude statistique de l'excès relatif de cancer sur cette population ne montre pas d'effet statistiquement significatif (le taux de cancer tend même à être plus faible que la moyenne)[76]. Cependant, le caractère « non statistiquement significatif » ne porte que sur la réduction de risque observée. Si l'hypothèse « linéaire sans seuil » avait été valide à raison de 5% de cancer par sievert, le risque supplémentaire sur l'ensemble de la population aurait été de 80 000 x 0,004 x 5% = 16 cancers par an d'exposition soit 640 cancers attendus après quarante années d'exposition. Un habitant de cette région aurait été exposé au bout de 50 ans à une dose supplémentaire de 0,2 Sv, conduisant à un risque de cancer de 1%, ou à un sur-risque relatif de 1,20[77]. Ces chiffres sont à comparer aux 710 décès par cancer effectivement observés, chiffre légèrement inférieur à ce qui aurait été attendu sur une population non sur-exposée : le risque relatif réel trouvé pour les cancers a été de 0,99 (intervalle de confiance entre 0,87 et 1,14)[76]. Bien que des risques relatifs de l'ordre de 20% soient difficiles à mettre en évidence, l'hypothèse « linéaire sans seuil » est nettement au-dehors de l'intervalle de confiance pour cette étude.
Les quelque 600 000 « liquidateurs » qui étaient intervenus sur le site de la catastrophe de Tchernobyl reçurent en moyenne une dose de l'ordre de 100 milli-sievert (de 10 à 500 mSv) ; et le taux de mortalité de ce groupe semble avoir augmenté de quelque 5%, conduisant à une estimation de quatre mille morts supplémentaires[31]. Cependant, si la mortalité a été anormalement élevée, le risque de cancer à proprement parler semble avoir diminué dans ce groupe. Une étude récente sur 8600 de ces liquidateurs qui avaient reçu une moyenne de 50 mSv, montre une sous-incidence significative de 12% de l’ensemble des cancers par rapport la population générale russe (au lieu d'un excès d'une vingtaine de cancers prédits par la théorie linéaire sans seuil)[78]. Cette étude n’a pas permis de mettre en évidence de relation dose-effet significative ; de même l’analyse de l’incidence des leucémies chez ces liquidateurs n’avait pas montré de relation dose effet significative[79].
À Taïwan, dans les années 1980, des constructions neuves furent édifiées avec de l'acier de recyclage fortement contaminé au cobalt 60 (de demi-vie 5.3 an), exposant un total de dix mille personnes à des doses moyennes de 0,4 sievert (avec un débit de dose de l'ordre de 15 mSv/an pour les plus exposées). Sur cette population, on se serait donc attendu à observer en moyenne 232 cancers mortels survenant naturellement (écart-type de 15), plus 70 morts supplémentaires prédites par le modèle « linéaire sans seuil ». En réalité, on n'observa que sept cancers au total (quinze écart-types sous la prédiction)[80], la conclusion des auteurs étant que l'exposition chronique à des faibles radiations semble être un moyen efficace d'améliorer les défenses naturelles contre le cancer. Cependant, cet accident n'a pas fait l'objet d'une étude statistique détaillée.
Critique des études écologiques
Ces études statistiques sont ce que l'on appelle des études « écologiques », qui comparent des populations a priori de mêmes caractéristiques mais vivant dans des milieux différents. Elles s'opposent aux études épidémiologiques de cohortes (où une population particulière est identifiée a priori et suivie dans le temps), qui sont beaucoup plus précises, mais beaucoup plus coûteuses. Il est bien connu en épidémiologie que des études de type écologique ne peuvent pas servir de base à des relations dose-effet, parce qu'elles ne permettent pas d'accéder aux doses individuellement reçues, et que l'effet réel d'une dose moyenne n'est généralement pas le même que l'effet moyen d'une dose réelle : des phénomènes de non-linéarité et/ou de couplage entre facteurs peuvent conduire à des effets très différents de l'effet réel, pouvant aller jusqu'à l'inverser.
C'est sur ces bases que les tenants de l'hypothèse « linéaire sans seuil » rejettent les études écologiques, arguant que par nature ces études n'autorisent pas de conclusion fiable[81],[82].
Cependant, le Pr Cohen souligne que l'argument, dans ce cas, est incorrect[83],[84],[85]. L'hypothèse « linéaire sans seuil » revient précisément à dire que le risque de cancer est directement proportionnel à la dose reçue. On peut facilement montrer mathématiquement que dans cette hypothèse particulière, la dose moyenne détermine directement le risque moyen, parce que -par hypothèse- un effet non-linéaire a été exclu dans ce cas. Par conséquent, si l'hypothèse « linéaire sans seuil » est correcte, une étude écologique doit trouver le résultat annoncé ; et comme le résultat annoncé n'est pas trouvé, c'est bien que l'hypothèse « linéaire sans seuil » est incorrecte. On ne peut pas pour autant dire quel est l'effet réel (puisqu'une étude écologique ne le permet pas), mais on peut affirmer que l'hypothèse « linéaire sans seuil » est invalide pour les faibles doses d'irradiation.
Peut-on pour autant affirmer à partir de telles études qu'il existe un effet d'hormèse? En théorie, à partir d'une étude écologique, non ; parce que même quand l'effet de certains facteurs explicatifs potentiels a été écarté (ici, le tabac et le niveau de vie), la nature même de l'étude ne permet pas de garantir que tous les facteurs explicatifs potentiels ont été correctement pris en compte. Cependant, comme le souligne le Pr. Cohen[72], même si son existence reste logiquement possible, le portrait robot d'un facteur explicatif bénéfique agissant par accident à l'inverse de la concentration en radon serait très contraignant :
- Il doit être très corrélé avec le cancer du poumon, à un niveau comparable à celui du tabagisme, mais n'a pas encore été identifié.
- Il doit être fortement et négativement corrélé avec le niveau ambiant de radon.
- Il ne doit être corrélé avec aucune des 54 variables socio-économiques examinées par l'étude.
- Il doit rester valide dans de nombreuses régions géographiques, indépendamment de l'altitude ou du climat.
Pour le Pr. Cohen[72], « l'existence d'un tel facteur explicatif hypothétique est irréaliste. »
Hypothèse d'un effet d'Hormèse
Globalement, la méta-analyse qui a été faite des résultats de l’expérimentation animale montre dans 40 % de ces études une diminution de la fréquence spontanée des cancers chez les animaux après de faibles doses, observation qui avait été négligée car on ne savait pas l’expliquer[13]. Les statistiques disponibles ne sont pas compatibles avec une loi « linéaire sans seuil », mais suggèrent au contraire un effet d'hormèse (effet inverse d’un agent, toxique à fortes doses, mais qui à faible dose a un effet favorable protecteur.)
Les radiations de l'ordre du mGy ont globalement un double effet sur les cellules et leur ADN. D'une part, il y a une faible probabilité pour que l'ADN soit endommagé, et cette probabilité croît avec la dose. L'autre effet découle de la réponse adaptative de la cellule contre tout dommage important de l'ADN, quelle qu'en soit la source. Si des cellules exposées à une faible dose (1 cGy) de rayons X sont ultérieurement exposées à une forte dose (1 Gy), on n'observe que la moitié des ruptures d'ADN normalement observées à cette forte dose[86]. Cette protection adaptative stimule le système de protection et de réparation de la cellule. La réponse apparaît en quelques heures, et peut durer plusieurs jours voire des mois. Elle sature puis décroît fortement au-delà de doses d'une centaine de mGy, et n'apparaît plus au-delà de 500 mGy[87].
À faible dose d'irradiation, l'avantage provenant de cette réponse adaptative peut l'emporter sur les dommages primaires induits sur l'ADN : une irradiation ponctuelle de l'ordre du cGy jouant le rôle d'un vaccin stimulant la radiorésistance et diminuant l'effet d'autres doses.
Enjeux sur la politique sanitaire
Doses collectives morts virtuelles
L'utilisation polémique de la loi « linéaire sans seuil » consiste à calculer le nombre de cancers provoqués par une très faible dose de radiation à laquelle est exposée une très grande population. La relation « linéaire sans seuil » conduit directement à des calculs impliquant une « dose collective », exprimée en homme.sievert, où une faible dose est multipliée par la population qui la subit. Dans l'hypothèse linéaire, en effet, on obtiendra le même résultat en exposant vingt million de personnes à un micro-sievert, ou vingt mille personnes à un milli-sievert, ou vingt personne à un sievert : dans tous les cas, la dose collective de vingt personnes.sievert conduira à un cancer supplémentaire (à raison de 5 % de cancer par sievert)[88]. Typiquement, si la population française (de 60 millions d'habitants) est exposée à une radioactivité moyenne de 2,5 milli-sievert par an (l'exposition moyenne aux radiations naturelles), et qu'une exposition aux rayonnements provoque un excès de cancer de 5% de cancer par sievert, cette exposition provoque globalement 60.106 x 2,5.10-3 x 5 % = 7 500 cancers par an, c'est-à-dire 2,3 % des cancers observés.
En 1973, le comité de l'http://www.nas.edu/ Académie des Sciences américaines] spécialisé dans l'étude des effets biologiques des radiations (BEIR) avait estimé que la radioactivité naturelle pouvait induire 6 000 morts par cancers par an aux États-Unis (soit environ le double, si on prend en compte les cancers non mortels à cette époque),mais ce type d'évaluation peut être réévaluée si l'on tient compte de modèles plus récents[89].
Le rapport conjoint de l'académie des sciences et de l'académie de médecine d'avril 2005[13] a été publié en réaction à une étude de l’estimation de la part de cancer attribuable au radiodiagnostic[90] construite précisément sur l'hypothèse de linéarité, sans seuil, de la relation entre le risque de cancer et la dose de radiations ionisantes. Cette étude concluait que 0,6 % à 3 % des cancers seraient attribuables au radiodiagnostic, mais si la relation « linéaire sans seuil » n’est pas fondée, ces estimations ne seraient que des constructions de l’esprit[12].
Le dilemme est manifeste si l'on prend par exemple le cas de la présence domestique du radon. Si l'on transpose les résultats observés sur les mineurs par une loi « linéaire sans seuil », il serait alors responsable de près de 5 à 10 % des cancers du poumon, causant entre 1000 et 3000 morts par an en France[91] parce que les faibles doses d'irradiation correspondantes concernent une très grande population. Dans cette logique, on peut être conduit à penser qu'il serait bon de supprimer totalement le radon dans les habitations. Cependant, si l'effet inverse suggéré par les travaux du Pr. Cohen n'est pas pas un artefact, une telle politique empêcherait la population concernée de profiter d'un effet d'hormèse qui semble présenter un maximum aux alentours de 200 ou 300 Bq/m3. Dans ce cas, outre le fait qu'une telle politique d'éradication serait extrêmement coûteuse, c'est au contraire cette même politique qui provoquerait entre 1000 et 2000 morts par an en France, parce que la population n'aurait pas pu profiter de l'effet de vaccination éventuel de faibles doses d'irradiations. Dans un contexte où l'on sait par ailleurs que les statistiques disponibles ne permettent pas de trancher avec certitude, on comprend que ces questions soient extrêmement polémiques.
Évaluation bénéfice / risque en radiologie médicale
 Radiographie dentaire à l'ancienne (1950).
Radiographie dentaire à l'ancienne (1950).
Environ 50 millions d’examens radiologiques sont effectués en France chaque année qui délivrent en moyenne 1 milli-sievert par an à chaque Français. Selon la fonction utilisée, on peut déduire, soit qu’ils pourraient induire quelques milliers de cancer, soit qu’ils ne présentent aucun danger significatif[13].
L’évaluation du rapport entre bénéfice et risque est imposée en radiologie par la directive européenne 97-43. Les risques éventuels dans la gamme de dose des examens radiologiques (0,1 à 5 mSv ; jusqu’à 20 mSv pour certains examens) doivent être estimés en tenant compte des données radiobiologiques et de l’expérimentation animale. Cependant, il apparaît que les mécanismes biologiques sont différents pour des doses inférieures à quelques dizaines de mSv et pour des doses supérieures. L’usage d’une relation empirique qui n’est validée que pour des doses supérieures à 200 mSv pourrait, en surévaluant les risques faire renoncer à des examens susceptibles d’apporter au malade des informations utiles[13],[12]. Elle pourrait aussi en radioprotection conduire à des conclusions erronées.
Le risque dépend de l'âge du patient puisqu'il est à distance : un scanner multicoupe à 80 ans n'a pratiquement aucun risque (le patient a toute chance de mourir d'autre chose dans les quarante ans à venir). Ce n'est pas le cas chez un adolescent.
Coûts de décontamination
Les décideurs confrontés au problème des déchets radioactifs ou au risque de contamination doivent réexaminer la méthodologie utilisée pour évaluer les risques des très faibles doses et des doses délivrées avec un très faible débit[13]. Si les effets des faibles doses d'irradiation sur la santé ne sont pas seulement faibles (donc difficiles à identifier) mais pratiquement nuls en dessous d’un niveau qui resterait à définir, de nombreux pans des politiques publiques dans ce domaine n’ont pas de justifications scientifiques[12].
Faibles doses, électronique et nanotechnologies
L'effet des faibles doses à échelle nanométrique intéresse aussi le domaine de la microélectronique (dont pour les détecteurs électroniques qui ne doivent pas donner de mesure biaisées par la radioactivité elle-même).
La miniaturisation des composants les rends en effet plus sensibles à des modifications intervenant à l'échelle atomique et susceptibles de produire des erreurs dans le fonctionnement de certaines puces électroniques, système de mémoires ou logiciels les utilisant.
Une expérience a été conduite avec du matériel Intel dans un milieu très pauvre en radiation ; au fond d'une cavité creusée dans une profonde couche de sel pour l'entreposage futur de déchets radioactifs[92] (à près d'un demi mile de profondeur sous le désert de Chihuahua aux Etats-Unis), de manière à être le moins exposé au rayonnement ambiant (alpha notamment), solaire et cosmiques (neutrons surtout). Il s'agissait aussi de vérifier si les faibles radiations émises par les matériaux tels que ceux de la carte-mère ou le silicium des puces était responsables de ces petites erreurs, et en quelle proportion. Le fonctionnement d'une SRAM 45nm a ainsi été testé durant un an, faisant conclure à Intel que plus de 90% des particules ionisantes causant ces petites erreurs dans le fonctionnement des puces viennent de l'environnement et non du silicium, ce qui repose la question du blindage électromagnétique de matériels sensible [93].Annexes
Notes et références
- D'après Risques sanitaires liés aux radiations
- Little et al. 2009, Risks associated with low doses and low dose rates of ionizing radiations: Why Linearity May Be (Almost) the Best We Can Do, Radiology 251:6-12, 2009
- [PDF] Irradiation médicale, déchets, désinformation : un avis de l’Académie de médecine. Guy de Thé et Maurice Tubiana. Communiqué adopté le 4 décembre 2001.
- (en) The somatic effects of exposure to atomic radiation: The Japanese experience, 1947–1997
- Mobbs 2010, "Risks from Ionising Radiations", Rapport HPA-RPD-066, Heatlh Protection Agency 2010
- Bithell JF and Stewart AM, Pre-natal irradiation and childhood malignancy: a review of British data from the Oxford Survey, Br J Cancer, 31, 271-87.
- Raaschou-Nielsen O. Indoor radon and childhood leukaemia. Radiat Prot Dosimetry. 2008 ; 132 : 175-181.
- Bräuner EV, Andersen CE, Andersen HP, Gravesen P, Lind M, UlbakK, Hertel O, Schüz J, Raaschou-Nielsen O. Is there any interactionbetween domestic radon exposure and air pollution from traffic inrelation to childhood leukemia risk ? Cancer Causes Control. 2010 ;21 : 1961-1964.
- Krestinina L, Preston DL, Davis FG, Epifanova S, Ostroumova E,Ron E, Akleyev A. Leukemia incidence among people exposed tochronic radiation from the contaminated Techa River, 1953-2005. Radiat Environ Biophys. 2010 ; 49 : 195-201.
- Cohorte suivie par les médecins du centre médical de recherche sur les effets des radiations de l'Oural (URCRM)
- Risk analysis of leukaemia incidence among people living along the Techa River: a nested case-control study, Ostroumova et al, Journal of radiological protection 26 (2006) 17–32.
- [PDF] Controverse : les faibles doses de radiations ionisantes sont-elles carcinogéniques ? in Bulletin Épidémiologique Hebdomadaire n° 15-16/2006 (18 avril 2006) : Exposition aux radiations ionisantes d’origine médicale.
- La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants, rapport commun de l'Académie des sciences et de l'Académie nationale de Médecine - Mars 2005. Éditions Nucléon, diffusion par EDP sciences.
- Brenner DJ., Doll R., Goodhead DT. et al : Cancer risk attributable to low doses of ionizing radiation : Assessing what we really know. Proc. Natl. Acad. Sci USA, 2003, 100, 13761-13766.
- Voir par exemple une présentation dans [1] ou [2].
- ICRP Draft report of Committee I/Task Group. Low dose extrapolation of radiation related cancer risk. Dec. 10, 2004.
- Un gray correspond à un joule par kilogramme, donc 0,241.10^-3 calorie par gramme : un kilogray augmentera donc d'un quart de degré la température d'un milieu liquide.
- Voir [3] : 20' de cuisson dans un four de 800W transfèrent 1MJ à un rôti de ~1kg.
- Rapport UNSCEAR 2000, Comité scientifique des Nations Unies pour l'étude des effets des rayonnements ionisants, Rapport à l'Assemblée générale, avec annexes scientifiques, 2000 A/55/46, ISSN 0255-1381 (2000)
- Radioactivité et repères naturels, Jacques Pradel, Société Française d'Énergie Nucléaire.
- Quelques repères sur la radioactivité, CEA.
- Publication 65 de la CIPR, citée d'après Estimation de l’impact sanitaire collectif de la contamination des terrains par la radioactivité présente à Gif sur Yvette, Institut de veille sanitaire, juin 2002.
- Le seul cas est celui du meurtre de Alexandre Litvinenko, empoisonné au Polonium.
- High Levels of Natural Radiation in Ramsar, Iran Mortazavi1 & Karam
- High natural background radiation areas in Ramsar, Iran: can inhabitants feel safe? International Journal of Low Radiation 2006 - Vol. 3, No.2/3 pp. 171 - 177
- Cancer incidence in areas with elevated levels of natural radiation, S.M.J. Mortazavi, M. Ghiassi-Nejad, P.A. Karam, T. Ikushima, A. Niroomand-Rad, J.R. Cameron, International Journal of Low Radiation 2006 - Vol. 2, No.1/2 pp. 20 - 27.
- (en) M. Ghiassi-nejad, S. M. J. Mortazavi, J. R. Cameron, A. Niroomand-rad et P. A. Karam, « Very high background radiation areas of Ramsar, Iran: preliminary biological studies », dans Health Physics, vol. 82, no 1, 2002, p. 87-93 [résumé, texte intégral (pages consultées le 20 novembre 2011)]
- (en) Alireza Mosavi-Jarrahi, Mohammadali Mohagheghi, Suminori Akiba, Bahareh Yazdizadeh, Nilofar Motamedi et Ali Shabestani Monfared, « Mortality and morbidity from cancer in the population exposed to high level of natural radiation area in Ramsar, Iran », dans International Congress Series, vol. 1276, 2005, p. 106–109 [résumé (page consultée le 20 novembre 2011)]
- (en) Y. Tabarraie, S. Refahi, M.H. Dehghan et M. Mashoufi, « Impact of High Natural Background Radiation on Woman`s Primary Infertility », dans Research Journal of Biological Sciences, vol. 3, no 5, 2008, p. 534-536 [résumé, texte intégral (pages consultées le 20 novembre 2011)]
- (en) Ionizing radiation in the 20th centyry and beyond, Zbigniew Jaworowski, Symposium "Entwicklungen im Strahleschutz", Munich, 29 November, 2001.
- Chernobyl’s Legacy: Health, Environmental and Socio-Economic Impacts. The Chernobyl Forum: 2003–2005 - Second revised version. IAEA Division of Public Information
- [PDF] [disc.vjf.inserm.fr/BASIS/medsci/fqmb/medsci/DDD/4743.pdf Les mutations de l'ADN après Tchernobyl], A. Kahn, MS. Médecine sciences 1996, vol. 12, no6-7 - ISSN 0767-0974.
- Voir par exemple les résultats d'une recherche sur le net sur "mutation+tchernobyl"
- O. RIGAUD, La radioadaptation : aspects cellulaires et moléculaires d’une réponse aux faibles doses de radiations ionisantes, Radioprotection 1998 Vol. 33, no 4, pages 389 à 404. [4]
- Ethique et imagerie médicale. A. Bonnin, Claude Broussouloux, Jean-Paul Convard ; Elsevier Masson, 1998 (ISBN 2225830967 et 9782225830969) (sur Google)
- [PDF] Avis de l'Académie Nationale de Médecine sur l'exposition aux faibles doses (22 juin 1999), rapport par Maurice Tubiana et André Aurengo.
- Document du CEA
- Rapport parlementaire sur les incidences environnementales et sanitaires des essais nucléaires effectués par la France, assemblée nationale, 2001.
- Voir Risques et effets des rayonnements ionisants, rapport principal de la commission Ampère.
- Tanooka H. Threshold dose-response in radiation carcinogenesis: an approach from chronic beta-irradiation experiments and a review of non-tumor doses. Int J Radiat Biol 2001;77:541-551. Cité par [5].
- Effets des radiations, Roland Masse
- Situation radiologique dans l'environnement des anciens sites miniers du Lodevois (Hérault), Bruno Chareyron, CRIIRAD, septembre 2004 [6]
- D'après [7]
- D'après [8].
- High levels of natural radiation Report of an international conference in Ramsar
- M. Sohrabi, Recent radiological studies of high level natural radiation areas of Ramsar, ICHLNR 39 (1990), pp. 39–47.
- D'après le service de protection radiologique des armées (SPRA), 2000.
- Radon Trickery, World Nuclear University.
- Jean-Michel Bader, Le secret du polonium 210 dans la fumée de cigarette, Le Figaro.fr, 28 août 2008.
- Responsabilités occidentales dans les conséquences sanitaires de la catastrophe de Tchernobyl, en Biélorussie, Ukraine et Russie, Bella Belbéoch.
- Estimation du United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR, 2000)
- D'après [9].
- L'exposition radiologique des personnes du public aux stériles miniers, fiche IRSN, février 2009.
- Examen critique du programme de recherche de l'ANDRA pour déterminer l'aptitude du site de Bure au confinement géologique des déchets à haute activité et à vie longue, IEER Technical Reports (décembre 2004)
- Guidelines for drinking-water quality, third edition, World Health Organization 2006.
- Résultats de la surveillance de l’environnement, Résultats 2nd semestre 2008.
- Fiche Andra Quels effets sur la santé?
- Les recommandations de la CIPR : les raisons d'un changement. A. Sugier, J.-C. Nénot & J.-F. Lecomte, Radioprotection Vol. 40 No. 3 (Juillet-Septembre 2005).
- De la réglementation à la culture de radioprotection, Boehler, Radioprotection 1996 Vol. 31, n° 4, pages 501 à 514
- [PDF] Recommendations 2007 de la Commission Internationale de Protection Radiologique, Publication CIPR 103, 2009.
- Les faibles doses dans la vie quotidienne, Lars-Erik Holm (ICPR), 2007.
- Linear-no-threshold is a radiation-protection standard rather than a mechanistic effect model, Joachim Breckow, Radiation and Environmental Biophysics Volume 44, Number 4 / mars 2006.
- National Academies' National Research Council, "Health Risks from Exposure to Low Levels of Ionizing Radiation: BEIR VII Phase 2", National Academies Press, 2006
- Biophysique (p. 62 & suivantes), Pierre Galle, Raymond Paulin, Elsevier Masson, 2000 (ISBN 2225856362).
- W. Burkart et al., Damage pattern as a function of radiation quality and other factors (Caractéristiques des lésions provoquées dans les structures cellulaires, en fonction de la qualité du rayonnement et des autres facteurs), Comptes Rendus de l’Académie des Sciences - Series III - Sciences de la Vie Volume 322, Issues 2-3, February-March 1999, Pages 89-101 Paris, pp. 89–101
- D'après La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants. Maurice Tubiana et André Aurengo, Rapport à l'Académie nationale de médecine, octobre 2004.
- D'après Effet bystander, Institut de Physiologie et Biologie Cellulaires- UMR 6187 U. Poitiers & C.N.R.S.
- Mothersill, Seymour, Radiation-induced bystander effects: Relevance for radiation protection of human and non-human biota, Radioprotection 2005 Vol. 40, n° 3, pages 297 à 306.
- The radiation-induced bystander effect, Oleg V. Belyakov
- 2000: Chenal C; Legue F; Nourgalieva K; Brouazin-Jousseaume V; Durel S; Guitton N, Exposition of humans to low doses and low dose rate irradiation : an urgent need for new markers and new models in Radiatsionnaia biologiia, radioecologiia / Rossiiskaia akademiia nauk 2000;40(5):627-9.
- Molecular biology, epidemiology, and the demise of the linear no-threshold (LNT) hypothesis (Biologie moléculaire, épidémiologie et la fin de la relation linéaire sans seuil), Myron Pollycove & Ludwig E. Feinendegen, Comptes Rendus de l’Académie des Sciences - Series III - Sciences de la Vie ; Volume 322, Issues 2-3, February-March 1999, Pages 197-204 Accès par Elsevier
- Cohen BL. Test of the linear no-threshold theory of radiation carcinogenesis in the low dose, low dose rate region. Health Phys 68:157-174 (1995).
- D'après Nonlinearity of Radiation Health Effects, Myron Pollycove, U.S. Nuclear Regulatory Commission, Washington, DC (February 1998).
- http://www.futura-sciences.com/fr/doc/t/developpement-durable/d/la-pollution-atmospherique_40/c3/221/p10/
- Voir le numéro spécial de Journal of Radiation Research Vol. 41 (2000), SUPPL High Background Radiation Area in China
- Cancer mortality in the high background radiation areas of Yangjiang, China during the period between 1979 and 1995., Tao Z, Zha Y, Akiba S, Sun Q, Zou J, Li J, Liu Y, Kato H, Sugahara T, Wei L. J Radiat Res , 41: SUPPL., 31– 41 (2000) [10]
- Health Physics Society, Answer to Question #1254 Submitted to "Ask the Experts", [11].
- Ivanov V, Ilyin L, Gorski A, Tukov A, Naumenko R. Radiation and epidemiological analysis for solid cancer incidence among nuclear workers who participated in recovery operations following the accident at the Chernobyl NPP. J. Radiat. Res. (Tokyo), 2004, 45, 41-44.
- La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants. Maurice Tubiana et André Aurengo, Rapport à l'Académie nationale de médecine, octobre 2004. p. 26.
- Is Chronic Radiation an Effective Prophylaxis Against Cancer?, Chen WL, Luan YC, Shieh MC, et al., Journal of American Physicians and Surgeons Volume 9 Number 1 Spring 2004.
- Voir par exemple l'argument présenté par J H Lubin, The potential for bias in Cohen's ecological analysis of lung cancer and residential radon Jay H Lubin 2002 J. Radiol. Prot. 22 141-148, et Reply to Cohen's letter on `The potential for bias in Cohen's ecological analysis of lung cancer and residential radon'2002 J. Radiol. Prot. 22 307-309
- Fundamental Flaws of Hormesis for Public Health Decisions, Kristina A. Thayer, Ronald Melnick, Kathy Burns, Devra Davis, and James Huff, Environmental Health Perspectives Volume 113, Number 10, October 2005
- Test of the Linear-No Threshold Theory: Rationale for Procedures
- Ecological versus case-control studies for testing a linear-no threshold dose-response relationship. B. Cohen, International Journal of Epidemiology 1990, 19: 680– 684. (accès payant
- Radon exposure and the risk of lung cancer, Bernard L Cohen, Letter to the Editor, 2001 J. Radiol. Prot. 21 64-65.
- The adaptive response in radiobiology: evolving insights and implications, S Wolff, Environ Health Perspect. 1998 February; 106(Suppl 1): 277–283.
- Evidence for beneficial low level radiation effects and radiation hormesis, L E Feinendegen, British Journal of Radiology (2005) 78, 3-7.
- Faibles doses de radioactivité : une révolution dans la radioprotection, Emmanuel Grenier, Fusion n°77, 1999.
- BRER, Health Risks from Exposure to Low Levels of Ionizing Radiation: BEIR VII Phase 2 (2006) Board on Radiation Effects Research ; 424 pages, (ISBN 0-309-09156-X et 978-0-309-09156-5) ; lien
- Berrington dG, Darby S. Risk of cancer from diagnostic X-rays: estimates for the UK and 14 other countries. Lancet 2004;363:345-51.
- Impact sanitaire du radon domestique : de la connaissance à l’action. Institut de veille sanitaire, Bulletin Epidémiologique Hebdomadaire 15 mai 2007 / n° 18-19.
- US Department of Energy's Waste Isolation Pilot Plant (WIPP),
- Tom Foremski, http://www.siliconvalleywatcher.com/mt/archives/2011/08/intel_investiga.php Intel Is Investigating Server Errors Caused By Background Radiation] ; Silicon valley watcher ; 2011-08-15
Bibliographie
- Le nucléaire expliqué par des physiciens, Paul Bonche et Jean-Marc Cavedon, ISBN 2-86883-575-9, EDP 2002.
- (en)[PDF] Draft recommendations of the international commission on radiological protection, 02/276/06 - 5 June 2006.
- [PDF] La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants, rapport commun de l'Académie des sciences et de l'Académie nationale de Médecine - Mars 2005. Éditions Nucléon, diffusion par EDP sciences.
- [PDF] Dossier du CEA : Les recherches sur les effets des faibles doses d’irradiation (février 2009).
- Le DARI : Unité de mesure adaptée à l'évaluation de l'effet des Faibles doses d'irradiation, de Georges Charpak.
- Remy, E., Estades J., 2006,.Déconfiner l’expertise sur les faibles doses de rayonnements ionisants, Hydroécol. Appl., Tome 15, 123-137.
- Biological and Epidemiological Information on Health Risks Attributable to Ionising Radiation: A Summary of Judgements for the Purposes of Radiological Protection of Humans, Annals of the ICRP, 2007 ;
- (en) Australasian Radiation Protection Society, submission to the ICRP on the 5 June 2006 draft Recommendations.
- (en) United Nations Scientific Committee on the Effects of Atomic Radiation : UNSCEAR 1994 Report to the General Assembly, with Scientific Annexes.
- (en) Radiation risk in perspective : Position statement of the Health Physics Society; January 1996, rev August 2004.
- (en) Radiological Dispersal Devices: Select Issues in Consequence Management (CRS Report for Congress, December 2004) (accessible en ligne [12]).
- (en) Radiation and Risk: A Hard Look at the Data. Los Alamos Science Number 23 1995.
- (en) [PDF] The Linear No-Threshold Theory of Radiation Carcinogenesis Should Be Rejected, Bernard L. Cohen, Journal of American Physicians and Surgeons Volume 13 Number 3 Fall 2008.
- Radiation-Induced Cancer From Low-Dose Exposure. John W. Gofman, M.D., Ph.D. 1990.
- (en) Health Risks from Exposure to Low Levels of Ionizing Radiation: BEIR VII – Phase 2. Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, National Research Council. SBN: 978-0-309-09156-5
- (en)[PDF] Draft report of High Level Expert Group on European Low Dose Risk Research, 8 September 2008
- (en) Ionizing radiation in the 20th centyry and beyond, Zbigniew Jaworowski, Symposium "Entwicklungen im Strahleschutz" , Munich, 29 November, 2001.
Liens internes
Liens externes
- projet RISC-RAD (Radiosensitivity of Individuals and Susceptibility to Cancer induced by ionizing radiations.
- (en) Low Dose Radiation Research Program aux USA.
- (en) BELLE - Biological Effects of Low Level Exposures
- Portail de la médecine
- Portail de la physique
- Portail de la biologie cellulaire et moléculaire
- Portail du nucléaire
Wikimedia Foundation. 2010.