- Syndrome d'apnées du sommeil
-
Syndrome d'apnées du sommeil
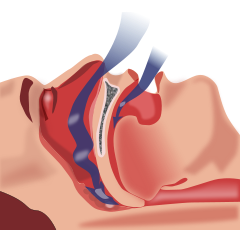
Classification et ressources externesIllustration de l'obstruction de la ventilation CIM-10 G47.3 CIM-9 780.57 eMedicine ped/2114 MeSH D012891 Le syndrome d'apnées du sommeil (« SAS ») ou plus précisément syndrome d'apnées-hypopnées du sommeil (« SAHS ») est un trouble du sommeil caractérisé par un arrêt du flux respiratoire (apnée) ou une diminution de ce flux (hypopnée). Ce trouble est souvent très invalidant et peut dans certains cas entraîner la mort.
Ses causes sont diverses mais peuvent être classées en deux catégories. Elles peuvent être obstructives et associées à une obésité ou à un syndrome métabolique : il est alors question de « syndrome d'apnées obstructives du sommeil » (« SAOS »). Une apnée est dite « obstructive » quand elle résulte d'efforts respiratoires pour lutter contre une obstruction des voies aériennes supérieures (nez, bouche, pharynx, larynx). Elles peuvent être aussi neurologiques, par anomalie du contrôle de la respiration et il n'y a donc alors pas d'effort d'inspiration comme dans le cas précédent. Il est question de « syndrome d'apnées centrales du sommeil » (« SACS »).
Ce syndrome affecte la qualité de vie non seulement des personnes qui en sont atteintes, mais aussi celle de leur entourage. En effet, les apnées, en dégradant la qualité du sommeil (diminution du sommeil profond et paradoxal, micro-éveils), provoquent l'apparition d'une somnolence diurne excessive[1] parfois associée à une irritabilité, à une baisse de la libido[1], ou à un état dépressif. D'autre part, les apnées diminuent la pression partielle en oxygène dans le sang et provoquent une désaturation en oxygène. L'hypoxémie chronique qui en résulte est elle-même responsable d'une hypertension artérielle et de l'apparition d'autres troubles cardio-vasculaires.
La prévalence du SAS est estimée entre 0,5 et 5 %. Ce syndrome est souvent méconnu, bien que son diagnostic soit maintenant bien codifié et obéisse à des critères précis. Les traitements sont nombreux et leurs indications varient selon les cas. Ce n'est que depuis 1981 qu'existe un traitement constamment efficace, la ventilation en pression positive continue (PPC). L'entourage des patients joue un rôle essentiel dans l'accompagnement du traitement.
Longtemps ignoré, le SAS, dans sa forme la plus fréquente (« SAOS »), a été décrit en 1956 sous le nom de « syndrome de Pickwick ». De nombreux personnages historiques en furent atteints, tel Dionysius d'Héraclée, Napoléon Ier ou encore Winston Churchill.
Sommaire
Définition
 Le SAOS a longtemps porté le nom de « syndrome de Pickwick[2] » (syndrome obésité-hypoventilation), nom tiré des Papiers posthumes du Pickwick Club de Charles Dickens. Le personnage de Joe apparaît au 4e chapitre du volume I[3].
Le SAOS a longtemps porté le nom de « syndrome de Pickwick[2] » (syndrome obésité-hypoventilation), nom tiré des Papiers posthumes du Pickwick Club de Charles Dickens. Le personnage de Joe apparaît au 4e chapitre du volume I[3].
Le syndrome SAOS est défini par la survenue durant le sommeil d’épisodes anormalement fréquents d’obstruction complète ou partielle des voies aériennes supérieures, responsables d’interruptions (apnées) ou de réductions significatives (hypopnées) de la ventilation, et associés à des manifestations cliniques le plus souvent dominées par une somnolence diurne excessive avec parfois des endormissements incoercibles.
Les autres symptômes principaux sont le ronflement, la somnolence et les céphalées matinales, et la constatation d’apnées au cours du sommeil par l’entourage.
Plusieurs symptômes et signes sont communs à ceux d'une aggravation de la déglutition salivaire atypique, reliquat de la déglutition infantile : interruption prématurée de la croissance, du développement et de la maturation des organes buccaux (infraclusion des dents, palais étroit et profond, etc. Voir aussi "Auxologie"), laxité musculaire (langue, voile du palais, pharynx), respiration buccale, souffrance respiratoire (hypoxémie), infections fréquentes des voies respiratoires, prédisposition aux allergies, bruxisme, acouphènes (angl. tinitus), etc.
Le diagnostic est posé sur un nombre excessif d’évènements (apnées et hypopnées) constaté au cours d’un enregistrement polysomnographique.
Évènements respiratoires
L'apnée est définie par une interruption du débit aérien de plus de 10 secondes. Il n'existe aucun consensus de définition pour l'hypopnée. Cette dernière est souvent associée, en polysomnographie, à des phases de désaturation en oxygène (diminution de 3 à 4 % de la saturation, voire plus pour les cas les plus graves), ces événements s'accompagnant d'un allègement du sommeil responsable de somnolence excessive.
La mesure des efforts respiratoires permet de qualifier les apnées en séparant les apnées obstructives (avec efforts respiratoires), les centrales (sans effort) ou les mixtes. Il n'existe pas de consensus de définition du seuil pathologique où il est question de ronflements : 45 à 60 dB (conversation courante) sans standardisation de la mesure. Les analyses acoustiques ne présentent pas d'intérêt. Les micro-réveils sont induits par l’augmentation de l’effort respiratoire (et pas par la diminution de la saturation en O2). Il n'existe pas de consensus sur la durée les définissant, le seuil le plus courant étant une période supérieure à 3 secondes.
Syndromes
Apnées obstructives du sommeil
Le diagnostic n’est posé qu'après une mesure polysomnographique. Aux États-Unis, ce syndrome est défini par une fréquence supérieure à cinq apnées par heure de sommeil[4]. En France, le seuil est de dix apnées par heure de sommeil[réf. nécessaire]. Hormis les effets potentiels de la déglutition salivaire atypique, il n'existe pas d'étude de corrélation entre seuils et pathologie ou souffrance ressentie.
Apnées centrales du sommeil
Le diagnostic est également posé après un examen polysomnographique qui ne retrouve pas d'obstruction comme cause des apnées. Il existe cependant des syndromes mixtes.
Ronflement
Le phénomène est banal (86 % des hommes ronflent si les conjointes sont interrogées). L’interrogatoire reste très peu fiable. Les facteurs favorisant sont le sexe masculin, l'âge (maximum à 60-70 ans), la surcharge pondérale, l'alcool, la prise de certains médicaments induisant un relâchement musculaire. Il constitue une plainte initiale fréquente dans la découverte des SAOS.
Un index de ronflement (nombre de ronflements/heure de sommeil) peut être calculé. Un ronfleur a un index supérieur à 30. Il s'agit d'un cas sévère s'il est supérieur à 300. Là aussi, les valeurs seuils influent sur la prévalence.
Ronfler a été défini comme un facteur de risque cardio-vasculaire indépendant du SAOS. Sans SAOS, il existe une somnolence diurne chez certains ronfleurs.
Hautes résistances des voies aériennes supérieures
C’est une définition clinique et polysomnographique. Il s'agit de l'association d'une somnolence diurne excessive, d'« évènements respiratoires nocturnes hors apnées-hypopnées » (ronflements, micro-réveils, limitation du débit, etc.) et d'un test thérapeutique : amélioration par la ventilation en pression positive continue.
Ce syndrome se différencie du SAOS par l’absence d’apnées ou d’hypopnées telles qu’elles sont définies plus haut (inférieur à 10 apnées par heure, en France), et par l’absence de retentissement sur la saturation artérielle en oxygène au cours du sommeil, même s'il existe une similitude entre ces deux syndromes sur le plan des symptômes (altération de la vigilance, somnolence diurne) et de leur mécanisme (fragmentation du sommeil en rapport avec une élévation des résistances des voies aériennes supérieures).
Épidémiologie
Son incidence dépend de la définition des hypopnées et des valeurs seuils. La prévalence varie de 24 % si le seuil d’IAH retenu (Index d’Apnées et Hypopnées par heure) est de 5, à 15 % si le seuil d’IAH retenu est de 10 et à 5 % si le seuil d’IAH retenu est de 15. La plupart des cas restent cependant sans diagnostic et donc, sans prise en charge[5].
La méthode de référence est la polysomnographie (PSG). Cette technique est cependant lourde et coûteuse (un peu moins de 200 € en France en 2008) avec des limites (surestimation selon la position de sommeil, effet première nuit, etc.). Elle est, par conséquent, inutilisable en épidémiologie.
Cette dernière repose sur l'utilisation de questionnaires directs ou téléphoniques mais dont les résultats sont de manière imparfaite à ceux de la PSG[6] [pas clair]. La prévalence, dans ce cas, est de 5 % à 9 % chez l’homme et 2,5 % chez la femme.
Facteurs favorisants
Ce sont le sexe masculin, l'âge (maximum à 60-70 ans), la présence d'une surcharge pondérale de type androïde, la prise d'alcool avant le coucher, la prise de certains médicaments induisant un relâchement musculaire, la présence d'un asthme ou autres symptômes respiratoires, le tabagisme. Même si le tableau concerne typiquement un homme âgé et obèse, il peut se voir chez d'autres personnes, même chez la femme longiligne.
La présence d'une maladie cardio-vasculaire augmente de deux à trois fois le risque de développer une apnée du sommeil[7]. De même, ce syndrome est plus fréquent chez le diabétique de type II[8], chez l'hypertendu[9]. La raison de ces corrélations n'est pas claire, et s'agissant de maladies chroniques, il est impossible de savoir si l'apnée augmente le risque de ces maladies ou si ces maladies augmentent le risque d'apnée.
Il existe des formes familiales caractérisées par des similitudes anatomiques. Certaines maladies endocrines (hypothyroïdie, acromégalie, Cushing, diabète) favorisent la survenue d'apnées du sommeil ; de même, l'obstruction nasale, saisonnière ou non, responsable d'une respiration anormale par la bouche. Déglutition atypique : les interpositions de la langue entre les dents supérieures et les dents inférieures, au cours des 1 500 à 2 000 déglutitions salivaires (« DS ») quotidiennes (appelé DS infantile chez l'enfant, DS atypique ou DS dysfonctionnelle chez l'adulte) favorise également cette anomalie respiratoire.
L'hypodéveloppement des maxillaires (mâchoires, fosses nasales et sinus étroits), la présence d'un palais effondré ou palais creux en ogive, toujours associé à des fosses nasales étroites (le palais est le plancher des fosses nasales), une mandibule (mâchoire du bas) trop petite (micrognathie) et placée trop en arrière (rétrognathie avec menton fuyant, ne pouvant jouer son rôle protecteur des voies respiratoires pendant le sommeil, l'arc mandibulaire devant normalement empêcher la langue de retomber en arrière en position allongée pendant le sommeil) sont également associés au syndrome d'apnées du sommeil.
Histoire naturelle
L'apnée du sommeil, sans intervention, tend à s'aggraver avec le temps[10]. La concomitance de maladies chroniques (diabète, hypertension artérielle ou maladies cardiovasculaires) ne permet pas d'affirmer si ces dernières sont le terrain ou la conséquence d'une apnée du sommeil. Seule la surveillance des patients porteurs de ce syndrome sur le long terme permet de suspecter une relation causale.
Le risque de survenue d'une HTA semble étroitement corrélé au nombre d'apnées[11]. Le traitement du SAOS par ventilation par pression positive continue permet une régression modeste des chiffres tensionnels[12]. Il existe une augmentation sensible de la mortalité, essentiellement cardio-vasculaire, chez les patients porteurs d'une apnée du sommeil. Cela est démontré de manière indirecte par une amélioration des chiffres de mortalité chez le patient traité[10].
Le ronflement est un facteur de risque de faire un infarctus (risque relatif de 4,4). L'hypopnée, si et seulement si elle s'accompagne d'une hypoxie transitoire, semble également être un facteur de risque cardio-vasculaire[13]. L’hypoxie a des conséquences à long terme, mais la somnolence diurne a des conséquences immédiates, en particulier sur les fonctions cognitives, l'humeur et le comportement (irritabilité, agressivité, dépression) et augmente le risque d’accident de la route.
Mécanismes
Les apnées obstructives du sommeil sont dues à la fermeture (« collapsus ») des voies aériennes lors de l’inspiration, qui génère une pression négative endopharyngée (pression de « succion »). Ce collapsus peut survenir en un ou plusieurs sites de l’oropharynx ou de l’hypopharynx. De nombreux facteurs peuvent participer à leur genèse, à des degrés divers selon les sujets :
- facteurs anatomiques : hypertrophie amygdalienne, micro-(rétro)gnathie, obstruction nasale, obésité, etc. Ces facteurs réduisent le calibre des voies aériennes supérieures et augmentent leur résistance ; cette augmentation de résistance est accrue dans certaines positions, comme la flexion du cou et le décubitus dorsal, et lors de l’hyperventilation réflexe qui fait suite aux apnées ;
- augmentation de la compliance des voies aériennes supérieures (« flaccidité ») ;
- facteurs neuro-musculaires (aggravés par la consommation d’alcool ou d’hypnotiques) : réduction trop importante du tonus des muscles dilatateurs du pharynx (muscles affectant la position de la langue, de l’os hyoïde, du palais) au cours du sommeil (d’autant plus que celui-ci est profond ou paradoxal), à l’état de base et en réponse aux stimuli mécaniques (anomalies des réflexes induits par la pression négative inspiratoire stimulant des récepteurs pharyngés, ou par le volume pulmonaire) ou chimiques (diminution de la sensibilité des centres respiratoires à l’hypoxémie et à l’hypercapnie) ;
- désynchronisation entre l’activité des muscles dilatateurs et celle du diaphragme ;
- retard à l’éveil en cas de collapsus des voies aériennes supérieures.
Les intrications sont complexes entre ces différents mécanismes. Cette apnée provoque un défaut d'oxygénation sanguin (hypoxie) et un défaut d'évacuation du gaz carbonique (hypercapnie). Cette dernière stimule la ventilation, quitte à provoquer un bref réveil.
Aspects cliniques
Le SAOS est responsable de plusieurs manifestations cliniques.
Pendant la veille
- somnolence
- sommeil non réparateur (ex: fatigue)
- céphalées matinales
- accidents (ex: accident domestiques, accident du travail, accident de la route)
- syndrome dépressif
- hallucinations hypnagogiques
- comportement automatique
- troubles de la mémoire
- impuissances, troubles de la libido
- troubles du comportement
Pendant le sommeil
- ronflements
- apnées
- mouvements du corps
- réveils en sursaut
- nycturie
- hypersialorrhée
- énurésie
- sueurs nocturnes
- somnambulisme
Informations complémentaires
Le ronflement du SAOS est souvent intense, interrompu par des apnées (silence) avec une reprise « explosive » qu’accompagnent des mouvements des jambes. Mais il existe des SAOS sans ronflement (grande insuffisance respiratoire, patients opérés)
Les apnées ne sont pas toujours perçues par le patient mais constituent une source d’inquiétude pour le conjoint. Elles sont responsables de réveils en sursaut avec sensation d’étouffement. Les sueurs nocturnes sont décrites dans 66 % des cas. Le somnambulisme est présent dans 10 % des cas. La nycturie correspond au fait de se lever trop fréquemment la nuit pour uriner. Elle est présente dans 28 % des cas (par probable sécrétion de facteur natriurétique auriculaire provoqué par les apnées et la dépression thoracique). Les troubles de la libido sont retrouvés chez 28 % des patients. La somnolence diurne est causée par une déstructuration du sommeil et disparition des phases de sommeil profond. Elle se manifeste essentiellement après les repas ou lors d’absence de stimulation (réunion, conduite, en lisant, etc.). Elle est évaluée par l’échelle de somnolence d’Epworth. Elle est parfois sous-estimée par le patient car ancienne et banalisée et peut être associée à des comportements automatiques (rasage long, etc.).
Les troubles du comportement sont variés et fréquents : irritabilité et agressivité, dépression, troubles cognitifs, céphalées matinales. Il faut rechercher, par l’interrogatoire, des antécédents de réveils post-opératoires compliqués (extubations difficiles, réanimation post-opératoire), une HTA, une broncho-pneumopathie chronique obstructive, des interventions ORL, la prise de médicaments.
Échelle de somnolence d'Epworth
La probabilité de s’endormir est cotée de 0 à 3 selon le risque d’assoupissement :
- 0 = jamais d’assoupissement ;
- 1 = risque faible d’assoupissement ;
- 2 = risque modéré d’assoupissement ;
- 3 = risque élevé d’assoupissement.
Elle est évaluée pour huit situations différentes :
- assis en train de lire ;
- en regardant la télévision ;
- assis, inactif, dans un lieu public ;
- comme passager dans une voiture roulant pendant 1 heure sans s'arrêter ;
- allongé pour se reposer l’après-midi quand les circonstances le permettent ;
- assis en train de parler à quelqu'un ;
- assis calmement après un repas sans alcool ;
- au volant d'une voiture immobilisée quelques minutes dans un encombrement.
Le total est noté sur 24. Un score supérieur à 12 est témoin d'une somnolence pathologique.
Indication d'un enregistrement polysomnographique
Les éléments cliniques les plus pertinents sont les ronflements, les apnées décrites par le conjoint, la somnolence diurne excessive, la surcharge pondérale (IMC supérieure à 27 kg/m2), l’âge, le sexe masculin, les antécédents familiaux et l’hypertension artérielle. Aucun de ces éléments n’est très spécifique : les apnées sont retrouvées chez 65 à 92 % des SAOS mais aussi chez 31 à 64 % des sujets normaux. L’absence de somnolence diurne estimée (Epworth inférieur à 12) n’exclut pas le SAOS (40 % des SAOS ?) et le score d’Epworth n’est pas lié à la sévérité du SAOS. Il existe une meilleure sensibilité en associant ronflement et somnolence diurne.
Des scores se basant sur l'âge, l'IMC, le périmètre du cou, la présence d’apnées et de ronflements, la présence ou non d'une HTA, ont été élaborés. Ils sont plus sensibles (92 %) mais peu spécifiques (51 %). Ces scores sont utiles pour un dépistage des SAOS mais n'ont été validés que dans des populations restreintes. des critères morphométriques ont été utilisés (mesures de la cavité buccale, BMI , tour de cou) augmentant la spécificité sans permettre pour autant l’élimination de la polysomnographie.
Polysomnographie
La polysomnographie est un enregistrement au cours d’une nuit (voire d’une sieste pour le dépistage) de sommeil, visant à quantifier les évènements respiratoires (apnées, hypopnées) et à les corréler à des variables que sont :
- le stade de sommeil et les micro-réveils ; par enregistrement de l'électroencéphalogramme (électrodes de scalp), d’un électro-oculogramme (électrodes collées à l’angle externe de l’œil) et d’un électromyogramme (électrodes collées sur le menton) ;
- la position du sujet déterminée par des capteurs décelant les réactions aux évènements respiratoires et la position de survenue de ces évènements ;
- les efforts respiratoires par des sangles abdominales et thoracique avec des capteurs sensibles à l’étirement. Des mesures plus fines nécessitent l’utilisation d’une sonde de pression œsophagienne ;
- les répercussions gazométriques par mesure de la saturation en oxymétrie percutanée ;
- les répercussions cardio-vasculaires avec la mesure de la fréquence cardiaque (la mesure de la pression artérielle n’est pas faite en routine).
La mesure des flux ventilatoires met en évidence les évènements respiratoires : ils peuvent être analysés par enregistrement de la température à la bouche et aux deux narines.
Ces mesures dépistent les apnées mais plus difficilement les hypopnées : leurs dépistages reposent sur la modification de signal thermique associé le plus souvent à une désaturation ou à un micro-réveil. Le pneumotachographe reste la méthode de référence pour la mesure des flux ventilatoires.
Pour alléger ces dispositifs, des polysomnographies « partielles » ont été proposées. Cela va de la seule recherche de désaturation nocturne (publications contradictoires) à un examen sans enregistrement des stades du sommeil (sans EEG, EMG ni électro-oculogramme). Ces techniques peuvent être suffisantes si elles sont positives mais ne permettent pas de déceler les micro-réveils. Enfin, certaines équipes font de la polysomnographie ambulatoire (au domicile du patient) mais seuls certains paramètres peuvent être étudiés.
Traitements
De multiples traitements du SAOS ont été évalués : les mesures hygiéno-diététiques (perte de poids, arrêt de la consommation d’alcool ou de sédatifs) ont une efficacité incomplète et transitoire. La réduction du poids est efficace tant dans les apnées modérées[14] que dans les formes intermédiaires et sévères[15]. La démonstration de l'efficacité d'un amaigrissement reste cependant à faire à long terme. Il existe par ailleurs des patients « résistants » (normalisation du poids avec persistance d'une apnée du sommeil) ;
Les traitements positionnels visant à empêcher le décubitus dorsal au cours du sommeil ne sont efficaces que chez une petite fraction des patients seulement ; une trachéotomie est constamment efficace mais comporte de trop importantes conséquences fonctionnelles.
D'autres traitements ont été proposés, de type chirurgical, médical (antidépresseurs stimulants dont les tricycliques, etc.), instrumental (Orthèse d'avancée mandibulaire, sondes d’intubation naso-trachéale, dilatateurs narinaires).
Des investigateurs testent un stimulateur implantable (comme un stimulateur cardiaque) qui envoie pendant le sommeil une légère stimulation du nerf moteur de la langue (nerf hypoglosse) qui peut faire avancer la langue et ainsi élargir les voies aériennes supérieures[16],[17]. Des études suggèrent que cette technologie peut diminuer le IAH chez des patients qui ne tolèrent pas le traitement à la pression positive continue (PPC)[18],[19],[20].
Les recherches médicales doivent aussi s'orienter vers une augmentation de la hauteur clinique des couronnes dentaires naturelles, puisque celle-ci provoque une élévation réflexe de la langue dans le palais et modifie le comportement musculaire oro-pharyngé, avec mise au repos du nerf VII (muscles faciaux). Suite : "déglutition atypique". Actuellement, l'application nocturne d’une pression positive continue (PPC) par masque de ventilation reste le traitement de choix. Toutefois de plus en plus d'étude démontre qu'une solution à l'aide d'une prothèse buccale serait une solution de premier choix pour les patients souffrant de SAOS léger a modéré et de deuxième choix en cas d'échec suite à l'utilisation d'un appareil PPC[réf. nécessaire].
Ventilation en pression positive continue
Article détaillé : Ventilation en pression positive continue.Le traitement de référence reste la ventilation en pression positive continue. Elle maintient ouverte à tous les stades du cycle respiratoire les voies aériennes supérieures. Elle semble aussi en partie efficace sur les apnées centrales.
Elle peut être « simple », l'appareil délivrant le même niveau de pression lors des phases inspiratoires et expiratoires et ce durant toute la nuit. Elle peut être également avec relâchement de pression à l'expiration (C-Flex® Respironics, iSleep 20+ eAdapt Breas) avec une réduction de pression au début de l'expiration afin de réduire la gêne expiratoire, auto-pilotée par adaptation spontanée aux besoins de pression variables au cours de la nuit (position de sommeil, stade du sommeil, réduction d’adaptation en début de traitement, médicaments ou alcool, etc.), à double niveau de pression (BiPAP® Respironics, iSleep 25 Breas) avec l'appareil délivrant une pression moindre à l’expiration et plus forte à l'inspiration pour favoriser le confort respiratoire, ou à double niveau de pression auto-pilotée (BiPAP® Auto Respironics) les deux pressions étant automatiquement ajustées au cours de la nuit selon les besoins du patient.
Les appareils délivrent des pressions de 3 à 20 cm H2O à des débits de 20 à 60 l/min. L’appareil pèse de 1 à 2 kg, son bruit varie de 25 à 30 dB. Les masques sont très variés, en silicone ou en gel avec dispositif de maintien (sangle, harnais, etc.). Il faut une « fuite calibrée » pour éliminer le CO2. Le calibrage des pressions de ventilation se fait au cours d’un deuxième enregistrement polysomnographique en débutant en début de nuit par des pressions faibles progressivement augmentées par paliers de quelques minutes pour faire disparaître les apnées, les hypopnées, les « événements respiratoires » et les ronflements.
Cette première nuit est importante car elle permet parfois un sommeil de qualité, vécu comme réparateur avec régression de la somnolence diurne. Elle est un bon critère de pronostic de compliance à la PPC. À long terme, l’efficacité dépend de l’observance. Le taux initial d’acceptation est de 70 à 80 %, avec un maintien à 80 % à distance mais avec des durées d’utilisation variables (« mouchards » dans les appareils récents). La durée minimale efficace est de 5 heures par nuit. L’observance dépend de la prise en charge et de l’information des patients, et en particulier de la gestion des effets secondaires mineurs de la PPC :
- irritation cutanée par un masque inadapté, ;
- rhinite voire obturation nasale (humidification chauffante) ;
- conjonctivites par fuites du masque (bruit peu souvent évoqué).
La PPC peut avoir des effets secondaires plus importants : épistaxis (saignement de nez), pneumothorax, troubles du rythme cardiaque. Les principaux bénéfices concernent l’amélioration de la vigilance diurne, mais certaines études font état d’une réduction de la mortalité, du nombre d'accidents cardiaques[21], d’une baisse des accidents de la route. L’amélioration de l’HTA est controversée.
Traitement de l'apnée du sommeil avec canule
Il existe un nouveau traitement, conçue pour les patients souffrant de syndromes d'apnées obstructives du sommeil ou ronflements, souvent responsables des troubles du sommeil, insomnies et somnolence diurne. Cette orthèse, dégage parfaitement le larynx pour une ventilation naturelle la nuit[réf. nécessaire]. Elle offre une solution simple et sans effets secondaires aux patients réfractaires à l'utilisation de masques ou à la ventilation. Ce système, encore en développement, pourrait être révolutionnaire et changer la vie des patients[réf. nécessaire].
Liens externes
- Catégorie Apnée du sommeil de l’annuaire dmoz
- Association pulmonaire du Québec - Guide de l'apnée du sommeil
Notes et références
- Emmanuel Weitzenblum et Jean-Louis Racineux, Syndrome d'apnées obstructives du sommeil, Editions Masson, 8 juillet 2004 (ISBN 978-2294015298) [version partielle du livre visible sur Google Livres - lire en ligne]
- Damien Léger 2001
- [lire en ligne] sur Wikisource
- (en) Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. The Report of an American Academy of Sleep Medicine Task Force, Sleep, 1999, 22: 667–689
- (en) DOI:Kapur V, Strohl KP, Redline S, Iber C, O'Connor G, Nieto J, Underdiagnosis of sleep apnea syndrome in U.S. communities, Sleep Breath, 2002; 6: 49–54
- (en) DOI:Netzer NC, Stoohs RA, Netzer CM, Clark K, Strohl KP, Using the Berlin Questionnaire to identify patients at risk for the sleep apnea syndrome, Ann Intern Med, 1999, 131: 485–491
- (en) DOI:Wolk R, Kara T, Somers VK, Sleep-disordered breathing and cardiovascular disease, Circulation, 2003, 108: 9–12
- (en) DOI:Elmasry A, Lindberg E, Berne C et Als. Sleep-disordered breathing and glucose metabolism in hypertensive men: a population-based study, J Intern Med, 2001;249:153–161
- (en) Hu FB, Willett WC, Colditz GA et Als. Prospective study of snoring and risk of hypertension in women, Am J Epidemiol, 1999, 150: 806–816
- (en) DOI:Somers VK, White DP, Amin R et Als, Sleep Apnea and Cardiovascular Disease, Circ, 2008, 118: 1080-1111
- (en) Peppard PE, Young T, Palta M, Skatrud J, Prospective study of the association between sleep-disordered breathing and hypertension, N Engl J Med, 2000, 342: 1378–1384
- (en) DOI:Alajmi M, Mulgrew AT, Fox J et Als. Impact of continuous positive airway pressure therapy on blood pressure in patients with obstructive sleep apnea hypopnea: a meta-analysis of randomized controlled trials, Lung, 2007, 185: 67–72
- (en) DOI:Punjabi NM, Newman A, Young T, Resnick HE, Sanders M, Sleep-disordered breathing and cardiovascular disease: an outcome-based definition of hypopneas, Am J Respir Crit Care Med, 2008, 117: 1150-1155
- (en) DOI:Tuomilehto HPI, Seppa JM, Partinen MM, Peltonen M, Gylling H, Tuomilehto JOI et als. Lifestyle intervention with weight reduction: first-line treatment in mild obstructive sleep apnea, Am J Respir Crit Care Med, 2009, 179: 320-7
- (en) DOI:Johansson K, Neovius M, Lagerros YT, Harlid R, Rössner S, Granath F et als. Effect of a very low energy diet on moderate and severe obstructive sleep apnoea in obese men: a randomised controlled trial, BMJ, 2009, 339: b4609
- (fr)Thérapie par stimulation des voies aériennes supérieures
- (en)Schwartz AR, Bennett M, et. al., « Therapeutic Electrical Stimulation of the Hypoglossal Nerve in Obstructive Sleep Apnea. », dans Arch Otolaryngol Head Neck Surg, vol. 127, 2001, p. 1216-1223 [texte intégral]
- (en)Predictors Of Response For Upper Airway Stimulation In Obstructive Sleep Apnea, Am J Respir Crit Care Med 183;2011:A2727
- (en)Hypoglossal Nerve Stimulation Therapy To Treat Obstructive Sleep Apnea: Interim Feasibility Trial Results, Am J Respir Crit Care Med 183;2011:A2726
- (en)Unilateral Targeted Hypoglossal Neurostimulation (THN) For The Treatment Of Obstructive Sleep Apnea (OSA) - A Phase 1 Safety And Efficacy Study, Am J Respir Crit Care Med 183;2011:A6383
- (en) DOI:Marin JM, Carrizo SJ, Vicente E, Agusti AG, Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study, Lancet, 2005, 365: 1046–1053
Catégories :- Trouble du sommeil
- Syndrome neurologique
- Maladie de l'arbre trachéo-bronchique
- État médical lié à l'obésité
Wikimedia Foundation. 2010.