- Peroxyde d'hydrogène
-
Peroxyde d'hydrogène 
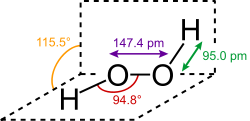
Structure du peroxyde d'hydrogène
(paramètres géométriques à l'état gazeux)Général Nom IUPAC Peroxyde d'hydrogène Synonymes Eau oxygénée,
perhydrolNo CAS No EINECS Code ATC A01, D08, AA06 PubChem ChEBI SMILES InChI Apparence liquide bleu pâle (à l'état pur) Propriétés chimiques Formule brute H2O2 [Isomères] Masse molaire[3] 34,0147 ± 0,0007 g·mol-1
H 5,93 %, O 94,07 %,Moment dipolaire 1,573 ± 0,001 D [1] Susceptibilité magnétique χm -17,3×10-6 cm3·mol-1 Diamètre moléculaire 0,358 nm [2] Propriétés physiques T° fusion -6 °C (10 %m),
-33 °C (35 %m),
-0,4 °C (100 %m)[4]
-52 °C (50 %m),
-40 °C (70 %m),
-11 °C (90 %m),T° ébullition 102 °C (10 %m),
108 °C (35 %m),
150–152 °C (100 %m, décomposition)[4]
114 °C (50 %m),
125 °C (70 %m),
141 °C (90 %m),Solubilité dans l'eau : miscible[5],
sol. dans l’oxyde de diéthyle, insol. dans l’éther de pétrole, décomposé par de nombreux solvants organiques[4]Masse volumique 1,03 g·cm-3 (10 %m, 25 °C),
1,13 g·cm-3 (35 %m, 25 °C),
1,44 g·cm-3 (100 %m, 25 °C)[4]
1,19 g·cm-3 (50 %m, 25 °C),
1,28 g·cm-3 (70 %m, 25 °C),
1,39 g·cm-3 (90 %m, 25 °C),Pression de vapeur saturante à 20 °C : 0.2 (90 %)[5],
0.1 (70 %) kPa[5].
3,9 mbar à 30 °C.
13,2 mbar à 50 °CThermochimie S0gaz, 1 bar 232,95 J/mol·K S0liquide, 1 bar 110 J/mol·K ΔfH0gaz -136,11 kJ·mol-1 ΔfH0liquide -187,5 kJ·mol-1 ΔfH0solide -200 kJ·mol-1 ΔvapH° 51,6 kJ·mol-1 (1 atm, 25 °C)[6] Propriétés électroniques 1re énergie d'ionisation 10,58 ± 0,04 eV (gaz)[7] Propriétés optiques Indice de réfraction  1,407 [2]
1,407 [2]Précautions Directive 67/548/EEC[9] 
C
OPhrases R : 5, 8, 20/22, 35, Phrases S : 1/2, 17, 26, 28, 36/37/39, 45, Transport >60 % : 559 2015
20 à 60 % :58 2014
8 à 20 % :50 2984 NFPA 704[10] SIMDUT[11] 


SGH[12] 

DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[8] Inhalation Irritation sévère, mort possible. Peau Blanchit; nettoyer immédiatement. Yeux Dangereux ; laver immédiatement pendant un quart d'heure. Ingestion Blessure sérieuse, mort possible. autre Plus d’infos :
Hazardous Chemical DatabaseÉcotoxicologie DL50 2 000 mg·kg-1 souris oral
>50 000 mg·kg-1 souris i.v.
1 072 mg·kg-1 souris s.c.
880 mg·kg-1 souris i.p.
12 000 mg·kg-1 souris peauCL50 2000 mg/m³/4 heures rat inhalation Unités du SI & CNTP, sauf indication contraire. Le peroxyde d'hydrogène, communément appelé eau oxygénée, ou encore perhydrol dans l'industrie, est un composé chimique de formule H2O2. Il s'agit d'un liquide clair, légèrement plus visqueux que l'eau, incolore en solution, aux puissantes propriétés oxydantes. C'est un agent blanchissant efficace, utilisé comme désinfectant et jadis comme ergol oxydant (comburant) pour l'aéronautique (le T-Stoff utilisé dans les années 1940 pour le Messerschmitt Me 163B) et l'astronautique (par exemple pour le missile Redstone américain dans les années 1950), voire comme monergol pour rocketbelts dans les années 1960.
Le peroxyde d'hydrogène existe naturellement chez les êtres vivants comme sous-produit de la respiration cellulaire. Tous les organismes aérobies possèdent des enzymes, appelées peroxydases, qui catalysent la dismutation de H2O2 en H2O et O2 :
La concentration des solutions de peroxyde d'hydrogène est parfois indiquée en volumes ; une solution à x volumes correspond au dégagement de x litres d'O2 par la décomposition d'un litre de solution.
Sommaire
Histoire
Le peroxyde d'hydrogène a été isolé pour la première fois en 1818 par Louis Jacques Thénard en faisant réagir du peroxyde de baryum avec de l'acide nitrique[13]. Le procédé a pu être amélioré en utilisant de l'acide chlorhydrique à la place de l'acide nitrique, suivi par l'ajout d'acide sulfurique pour précipiter le sulfate de baryum comme sous-produit. Le procédé Thénard est utilisé de la fin du XIXe siècle jusqu'au milieu du XXe siècle[14]. Les méthodes de productions actuelles sont discutées ci-dessous.
Le peroxyde d'hydrogène a longtemps été considéré comme instable, du fait des nombreuses tentatives pour le séparer de l'eau. Cette instabilité est due aux impuretés de métaux de transitions présentes en solutions, même en très faible quantité, qui catalysent la décomposition du peroxyde d'hydrogène. Une solution pure a pu être obtenue pour la première fois par distillation sous vide en 1894 par Richard Wolffenstein [15]. À la fin du XIXe siècle, Petre Melikichvili et son étudiant L. Pizarjevski ont pu montrer que de toutes les formules proposées pour le peroxyde d'hydrogène, la formule H-O-O-H était correcte.
L'utilisation de peroxyde d'hydrogène comme stérilisant a rapidement été considéré comme une alternative efficace à l'oxyde d'éthylène, et a de fait été largement utilisé dans l'industrie pharmaceutique.
Production
Historiquement, le peroxyde d'hydrogène est préparé par l'électrolyse d'une solution aqueuse d'acide sulfurique ou de bisulfate d'ammonium (NH4HSO4), suivie par l'hydrolyse du peroxodisulfate S2O82− formé.
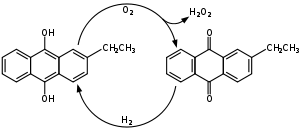
Actuellement, le peroxyde d'hydrogène est produit presque exclusivement par l'autooxydation de la 2-alkyl anthrahydroquinone en 2-alkyl anthraquinone (procédé anthraquinone (en)). Les industriels utilisent plus particulièrement les dérivés 2-éthyle ou 2-amyle. La plupart des procédés industriels utilisent le barbotage d'air comprimé à travers une solution d'un dérivé dihydroxyanthracène, le dioxygène réagissant avec les protons labiles des groupements hydroxyles pour donner le peroxyde d'hydrogène, donnant ainsi le dérivé anthraquinone. Le peroxyde d'hydrogène est ensuite extrait et le dérivé anthraquinone est réduit par le dihydrogène en présence d'un catalyseur métallique pour redonner le dérivé dihydroxyanthracène, le cycle pouvant ainsi être répété[16]. Ce procédé est aussi connu sous le nom de procédé Riedl-Pfleiderer, et a été découvert en 1936[17]. En 2005, la production mondiale de peroxyde d'hydrogène atteignait 2,2 million de tonnes[18].
Utilisation
- Le peroxyde d'hydrogène sert essentiellement au blanchiment de la pâte à papier (environ deux tiers du volume produit dans le monde). Les pâtes blanchies peuvent être chimiques, mécaniques ou recyclées.
- Dans le domaine de l'environnement pour le traitement des eaux, des sols et des gaz (désulfuration, deNox, etc.).
- Naturellement secrété par le corps humain, il inhibe la synthèse de pigments colorés, dont la mélanine et est responsable du blanchissement des cheveux[19]. Il peut servir (à basse concentration, environ 5 %) à décolorer les poils et cheveux, d’où l'expression « blonde peroxydée ». Il est utilisé en coiffure comme fixateur pour achever une permanente.
- Désinfectant pour un traitement local (code ATC : A01AB02 peroxyde d'hydrogène (eau oxygénée)). Le nettoyage des plaies par l'eau oxygénée doit être prompt, car celle-ci endommage les nouvelles cellules. Elle est cependant réputée être efficace contre le tétanos, dont la bactérie est essentiellement anaérobie et contre indiqué pour les bactéries aérobies (ex : staphylocoque).
- Combiné avec l’urée sous forme de peroxyde de carbamide CH6N2O3, le peroxyde d'hydrogène sert au blanchiment dentaire.
- Il entre dans la composition de certains traitements en dermatologie.
- Vaporisé à haute température, il sert à stériliser les emballages alimentaires composites juste avant l'incorporation de leur contenu (liquides UHT tels que lait, jus de fruits, etc.).
- À haute concentration, il peut servir de comburant pour la propulsion de fusées. En se décomposant dans le réacteur il fournit le dioxygène nécessaire à la combustion des combustibles auxquels il est associé. Il a la particularité de pouvoir être aussi utilisé seul comme monergol dans les Rocketbelt. Dans ce dernier cas, c'est la décomposition exothermique du peroxyde d'hydrogène concentré, initiée dans la chambre du réacteur par contact avec un catalyseur, qui génère un jet d'oxygène et de vapeur d'eau à 600 °C.
- L'eau oxygénée a été utilisée pendant plusieurs années comme révélateur d'hémoglobine en police scientifique. Aujourd'hui ce test n'est plus utilisé en médecine légale car des techniques plus précises existent[20]. Cette découverte a été faite par le chimiste allemand Christian Schönbein (1799-1868).
- C'est aussi un désinfectant pour la culture hydroponique et l'oxygénation des racines.
- Le peroxyde d'hydrogène est aussi utilisé lors de la fabrication d'explosifs peroxydés tel de le peroxyde d'acétone ou TATP.
Décomposition
Le peroxyde d'hydrogène se décompose dans une réaction exothermique de dismutation en eau et dioxygène dans des proportions dépendantes de la température, de la concentration de la présence d’impuretés et de stabilisants. Il est décomposé par beaucoup de substances, dont la plupart des métaux de transition et leurs composés, des composés organiques, la poussière, etc. Répandre du peroxyde d'hydrogène sur une substance inflammable peut provoquer un embrasement.
L’utilisation d’un catalyseur (comme le dioxyde de manganèse, le permanganate de potassium, l'argent, ou une enzyme telle que la catalase) augmente considérablement le taux de décomposition du peroxyde d'hydrogène. Ce phénomène produit un dégagement d'oxygène intense ainsi qu'une forte chaleur. Les récipients de stockage doivent être constitués d'une matière compatible comme le polyéthylène ou l'aluminium et nettoyés de toute impureté (un procédé appelé passivation).
La réaction de dismutation est lente et les solutions aqueuses de peroxyde d'hydrogène peuvent être conservées longtemps sous certaines conditions. L'eau oxygénée commerciale dite "stabilisée" contient des agents permettant de complexer ou d'adsorber les impuretés en solution. Celles-ci catalysent la dismutation et accélèrent la décomposition de la solution, parfois violente. Pour empêcher ceci, des agents stabilisants variés peuvent être utilisés, tels des phosphates, stanates ou silicates de sodium, de l'acide phosphorique ou bien encore de l'acétanilide par exemple[4],[21].
La dismutation met en évidence les propriétés oxydantes et réductrices du peroxyde d'hydrogène. La dismutation peut être décrite comme une réaction entre H2O2 oxydant et H2O2 réducteur.
La réaction de dismutation
- 2 H2O2 → 2 H2O + O2 (–23,66 kcal)
est composée des deux demi-équations d'oxydoréduction suivantes :
- H2O2 + 2 H+ + 2 e-
 2 H2O (où H2O2 est l'oxydant)
2 H2O (où H2O2 est l'oxydant) - H2O2
 O2 + 2 H+ + 2 e- (où H2O2 est le réducteur)
O2 + 2 H+ + 2 e- (où H2O2 est le réducteur)
Le peroxyde d'hydrogène a aussi été utilisé comme monergol. Dans les années 1930 et 1940 Hellmuth Walter en fut le pionnier. Cependant, son utilisation dans les torpilles a été abandonnée dans la plupart des marines pour des raisons de sécurité.
Purification
Comme le peroxyde d'hydrogène concentré (pourcentage molaire > 70 %) est en vente restreinte, certains sont tentés de distiller des solutions plus diluées pour obtenir un monergol. C’est extrêmement dangereux.
Le barbotage suivi éventuellement d'une congélation fractionnée constitue un procédé plus sûr. Le barbotage profite du fait que l’air tiède (pas trop chaud) évapore préférentiellement l'eau.
À des concentrations dépassant 62 %, le peroxyde d'hydrogène en solution dans l’eau gèle avant l’eau (c'est l'inverse à des concentrations plus faibles). L'eau oxygénée tend à demeurer en surfusion, un état métastable qui cesse, par exemple si l'on immerge un cristal de « glace oxygénée » dans la solution surfusée.
Composé naturel
Le peroxyde d'hydrogène est non seulement produit par des microorganismes mais aussi par les protéines duox[22],[23]. Il est ensuite détoxifié par les peroxydases afin de produire de l'hypothiocyanite[24],[25].
Toxicité, écotoxicité
Ce puissant biocide est toxique pour de nombreuses espèces, à des doses variant selon les organismes, leur âge et le contexte.
Sa toxicité a fait l'objet d'une réévaluation publiée en 1999 par le Centre international de recherche sur le cancer[8].Voir aussi
Articles connexes
Liens et documents externes
- (fr) Fiche de sécurité
- (fr) Fiche toxicologique de l'INRS
- (fr) Le peroxyde d’hydrogène dans les produits de blanchiment des dents résumé du rapport du CSPC de la Commission européenne (2006)
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hydrogen peroxide » (voir la liste des auteurs)
- (en) D. R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, juin 2008, 89e éd., relié, 2736 p. (ISBN 9781420066791 et 142006679X), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- N. Bonnard, M. Falcy et al., Fiche Toxicologique 123 : Peroxyde d’hydrogène et solutions aqueuses, INRS, 2007, 8 p. (ISBN 9782738915788) [lire en ligne (page consultée le 11 février 2010)]
- PEROXYDE D'HYDROGENE (SOLUTION AQUEUSE, >60 %), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) D. R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, 2009, 90e éd., relié, 2804 p. (ISBN 9781420090840)
- Lide 2008, p. 10-205
- (en) IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 71 : Re-evaluation of Some Organic Chemicals, Hydrazine and Hydrogen Peroxide, IARC, 1999, 1586 p. [lire en ligne], p. 671-689
- « peroxyde d'hydrogene » sur ESIS, consulté le 20 février 2009
- UCB Université du Colorado
- « Peroxyde d’hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- (en)L. J. Thénard, « Observations sur des nouvelles combinaisons entre l’oxigène et divers acides », dans Annal. Chim. Phys., 2e série, vol. 8, 1818, p. 306-312 (ISSN 0365-1444) [texte intégral]
- (en) C. W. Jones, Applications of hydrogen peroxide and derivatives, Royal Society of Chemistry, coll. « RSC clean technology monographs », 1999, 264 p. (ISBN 0854045368 et 9780854045365) [lire en ligne]
- (en)R. Wolffenstein, « Concentration und Destillation von Wasserstoffsuperoxyd », dans Ber. Dtsch. Chem. Ges., vol. 27, no 3, 1894, p. 3307–3312 (ISSN 0365-9496) [lien DOI]
- (en) J. M. Campos-Martin, G. Blanco-Brieva et al., « Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process », dans Angew. Chem. Int. Ed., vol. 45, no 42, 27 octobre 2006, p. 6962–6984 (ISSN 1433-7851 et 1521-3773) [lien PMID, lien DOI]
- Brevet US 2158525 "Production of hydrogen peroxide ", H. Riedl et G. Pfleiderer, 1936
- (en) R. Hage et A. Lienke, « Applications of Transition-Metal Catalysts to Textile and Wood-Pulp Bleaching », dans Angew. Chem. Int. Ed., vol. 45, no 2, 23 décembre 2005, p. 206–222 (ISSN 1433-7851 et 1521-3773) [lien PMID, lien DOI]
- « On connaît la cause des cheveux blancs », dans Science et Vie, no 1100, mai 2009, p. 21 (ISSN 0036-8369)
- cf. Espace Pierre Mendes France à Poitiers – Exposition « Police scientifique ».
- (en) U.S. Peroxide, « Hydrogen Peroxide (H2O2) - A Powerful Oxidizer » sur http://www.h2o2.com. Consulté le 31 octobre 2011
- (en) B. Rada et T. L. Leto, « Oxidative Innate Immune Defenses by Nox/Duox Family NADPH Oxidases », dans Contrib. Microbiol., vol. 15, 2008, p. 164-187 (ISSN 1420-9519) [texte intégral, lien PMID, lien DOI]
- (en) H. Fischer, « Mechanisms and Function of DUOX in Epithelia of the Lung », dans Antioxid. Redox Signal., vol. 11, no 10, 18 septembre 2009, p. 2453–2465 [texte intégral, lien PMID, lien DOI]
- (en) P. Mowska, D. Lorentzen et al., « A Novel Host Defense System of Airways Is Defective in Cystic Fibrosis », dans Am. J. Respir. Crit. Care Med., vol. 172, no 2, 2007, p. 174-183 (ISSN 1073-449X et 1535-4970) [texte intégral, lien PMID, lien DOI]
- (en) W. E. White, K. M. Pruitt et al., « Peroxidase-Thiocyanate-Peroxide Antibacterial System Does Not Damage DNA », dans Antimicrob. Agents Chemother., vol. 23, no 2, février 1983, p. 267-272 (ISSN 0066-4804 et 1098-6596) [texte intégral, lien PMID]
Catégories :- Produit chimique corrosif
- Produit chimique comburant
- Composé de l'hydrogène
- Produit chimique domestique
- Peroxyde
- Antiseptique
Wikimedia Foundation. 2010.