- Peroxyde d'acetone
-
Peroxyde d'acétone
Peroxyde d'acétone 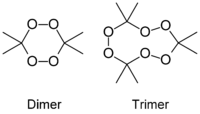
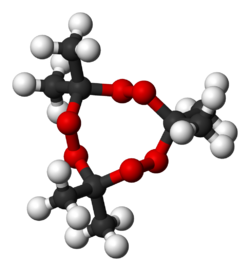
Structure du peroxyde d'acétone Général Nom IUPAC 3,3,6,6-tetramethyl-1,2,4,5-tetraoxane
(dimère)
3,3,6,6,9,9-hexamethyl-1,2,4,5,7,8-hexaoxacyclononane
(trimère)No CAS No E E929 Apparence poudre blanche,
cristaux monocliniques,
odeur âcrePropriétés chimiques Formule brute dimère : C6H12O4 [Isomères]
148,157328 g∙mol-1
trimère : C9H18O6 [Isomères]
222,235992 g∙mol-1
tétramère : C12H24O8 [Isomères]
296,314656 g∙mol-1Propriétés physiques T° fusion 91 °C T° ébullition 130 °C Solubilité Insoluble dans l'eau;
Peu soluble dans l'éthanol, l'isopropanol, la glycérine, l'acide acétique glacial;
Soluble dans l'acétone, l'éther, l'acétate d'éthyle, l'hexane, le benzèneMasse volumique 1,18 Précautions Directive 67/548/EEC 
EUnités du SI & CNTP, sauf indication contraire. Le peroxyde d'acétone est un explosif primaire découvert en 1895 par R. Wolffenstein. C'est une famille de molécules instables constituées de peroxydes organiques cycliques. On le rencontre le plus souvent sous la forme d'une poudre blanche cristalline. Il a une odeur âcre caractéristique.
Sommaire
Chimie
De fabrication simple, il peut être obtenu à partir d’eau oxygénée (peroxyde d'hydrogène) et d’acétone (propanone). L’acide chlorhydrique, l'acide sulfurique (acides forts) ou encore le chlorure d'étain (IV) servent à catalyser la réaction qui doit se faire à froid. L'obtention du précipité (des cristaux blancs) se fait par une réaction fortement exothermique. Les molécules contiennent dans leur cycle des liaisons peroxydes, ce qui explique l'instabilité du produit.
Expérimentalement, si l'on essaie de produire la réaction à chaud, le peroxyde d'acétone et le peroxyde d'hydrogène se vaporisent et se dégagent lentement sous forme d'une fumée blanche, épaisse et âcre, plus lourde que l'air ambiant, qui détone très violemment au contact d'une source de chaleur incandescente (étincelle, filament d'ampoule électrique,...), ce qui est excessivement dangereux et totalement incontrôlable.
La réaction est quasiment complète, mais la réaction produisant beaucoup de chaleur peut vaporiser le peroxyde d'hydrogène ou l'acide fort utilisé comme catalyseur, ce qui peut provoquer des brûlures irréversibles aux mains et aux yeux.
D'ailleurs, si le mélange est "noyé" dans l'acétone, les flocons de peroxyde d'acétone se dissolvent et le mélange se met spontanément à bouillir, jusqu'à disparition complète du peroxyde. À cette occasion, le récipient contenant le mélange peut se fêler ou se briser net sous l'effet de la chaleur intense.Le catalyseur employé lors de la fabrication détermine la proportion des molécules produites. Le peroxyde d'acétone existe sous plusieurs formes oligomères cycliques dont les formules chimiques sont:
- C6H12O4 (diperoxyde d'acétone)
- C9H18O6 (triperoxyde d'acétone)
- C12H24O8 (tetraperoxyde d'acétone)
Le produit connu sous le nom de péroxyde d'acétone contient majoritairement la forme trimère cyclique, le triperoxyde de tricycloacétone (en anglais TATP:triacetone triperoxide ou TCAP: tricyclicacetonperoxide ). Cette molécule est métastable et se décompose lentement en diperoxyde d'acétone qui est moins stable vis à vis de sa décomposition explosive que la forme trimère. Cette baisse de stabilité est en partie explicable par des contraintes structurales accrues chez la forme dimère par rapport au trimère, notamment en ce qui concerne les angles de liaisons des atomes d'oxygène inclus dans le cycle des molécules. C'est une raison supplémentaire pour éviter de stocker ce produit pendant une longue durée.
Explosion
Le peroxyde d'acétone est extrêmement instable, il est très sensible au choc et à la friction. L’explosion de 10 grammes de peroxyde d'acétone produit 250 cm³ de gaz alors que le TNT en produit 285.
Sa vitesse de détonation est de 5529 m/s pour un échantillon de 15 mm de diamètre.
Une caractéristique du peroxyde d'acétone est que son explosion est peu exothermique, elle est dite entropique car le principal facteur favorisant sa réaction de décomposition est la création d'entropie.Non confiné, c'est un explosif soufflant, il produit alors une violente flamme (mais détone s'il est initié par une onde de choc). Il peut aussi être mélangé avec d'autres produits: plastifiant, poudre sans fumée... ce qui lui permet d'exploser sans être confiné. Il devient alors un explosif brisant et produit une détonation.
Note : même les explosifs industriels comme la nitroglycérine ou le TNT brûlent dans certains cas s'ils sont mis à feu par une flamme
Il faut mettre quelques réserves aux propos précédents car les caractéristiques de cet explosif dépendent avant tout de la méthode de fabrication. La méthode la plus simple avec un catalyseur à l'acide chlorhydrique ou sulfurique à froid, donne la formule trimère dont la sensibilité est proche de celle du fulminate de mercure (un choc violent est requis). Mais ce produit est très sensible à la friction (accidents fréquents !).
Expérimentalement, on peut vérifier que la frontière de "confinement" est plus que ténue: lorsqu'on remplit un cylindre métallique de 10cm de long et 5mm de diamètre avec du TATP (formule trimère à l'acide chlorhydrique), approcher une flamme d'une extrémité provoque une flamme quasi-silencieuse aux deux extrémité. La même expérience réalisée avec un tube de 10cm de long et 2mm de diamètre provoque une violente détonation, très surprenante eu égard à la très faible quantité de matière. La différence de comportement semble surtout liée à la manière de tasser le TATP à l'intérieur du cylindre (opération excessivement dangereuse!), ce qui rend son utilisation comme monergol artisanal plus qu'aléatoire.
Expérimentalement, on constate aussi que la forme obtenue avec de l'acide chlorhydrique, puis séchée à l'air libre pendant deux semaines ne réagit pas sous un coup de marteau. Une source de chaleur incandescente semble être requise (flamme, cigarette, filament d'ampoule, étincelle électrique...).
Il a tendance à s'évaporer et doit être conservé dans de l'eau ou un mélange stabilisant pour plus de sécurité.
Utilisation
Réalisé sur site (le mélange acétone et péroxyde d'hydrogène ne réagit pas en l'absence du catalyseur et n'est pas plus dangereux à transporter que l'acétone même), il est utilisé en Bretagne (Ille-et-Vilaine surtout) pour ses caractéristiques d'explosif soufflant pour détruire les taupes, de préférence au chlorate de sodium, qui est bien moins stable au transport et plus sensible à la friction (risques d'enflammement spontané sur des tissus aspergés). De plus, le chlorate de sodium produit une explosion bruyante à même de briser les vitres.
Plus rarement, il peut également être utilisé pour un désouchage rapide, en particulier sur des souches de grandes dimensions (région de Maure-de-Bretagne et dans la vallée du Couesnon).
Cet explosif, extrêmement instable, est facile à fabriquer avec des moyens artisanaux. Il est surtout utilisé par les terroristes kamikazes. Ce fut le cas, par exemple, lors d'un attentat raté par Richard Reid durant le vol Paris-Miami d'American Airlines (les fameuses chaussures piégées) en décembre 2001.
Il est régulièrement utilisé par les terroristes du Hamas. 60 kg de TATP ont été retrouvés à Londres en août 2006. Un jeune homme est mort en France en octobre 2006 lors de l'explosion d'une quantité moyenne de peroxyde d'acétone confiné dans un tube. En 2004, la voiture du préfet Aïssa Dermouche fut détruite par du TATP à Nantes.
Le 28 mai 2008, Frédéric Rabiller, un homme de 29 ans se blesse gravement à son domicile, alors qu'il manipulait du TATP[1]. De son propre aveu membre du FNAR (Fraction Nationaliste AntiRadar)
Le 12 novembre 2008, une explosion de TATP dans une chambre d'une résidence étudiante de Montpellier, bilan : 7 blessés, dont deux graves.
Notes et références
Voir aussi
Articles connexes
Liens et documents externes
- Portail de la chimie
Catégories : Produit chimique explosif | Peroxyde organique
Wikimedia Foundation. 2010.