- Péroxyde d'hydrogène
-
Peroxyde d'hydrogène
Peroxyde d'hydrogène 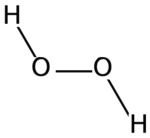
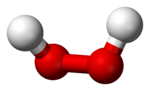
Structure du peroxyde d'hydrogène Général Nom IUPAC Peroxyde d'hydrogène Synonymes Eau oxygénée,
perhydrolNo CAS No EINECS Code ATC A01, D08, SMILES InChI Apparence liquide bleu pale (à l'état pur) Propriétés chimiques Formule brute H2O2 [Isomères] Masse molaire 34,0147 g∙mol-1
H 5,93 %, O 94,07 %,Propriétés physiques T° fusion -11 °C (90%)[1],
-39 °C (70%)[1].
-33 °C (35% de H2O2).T° ébullition 141 °C (90%)[1],
125 °C (70%)[1],
108 °C (35% de H2O2)Solubilité dans l'eau : miscible[1];
Soluble dans l'alcool et l'éther sulfuriqueMasse volumique (eau = 1) : 1.4 (90%)[1],
1.3 (70%)[1].
1,71 g/cm³ à -20 °C.Pression de vapeur saturante à 20 °C : 0.2 (90%)[1],
0.1 (70%) kPa[1].
3,9 mbar à 30 °C.
13,2 mbar à 50 °CThermochimie S0gaz, 1 bar 232,95 J/mol·K S0liquide, 1 bar 110 J/mol·K ΔfH0gaz -136,11 kJ/mol ΔfH0liquide -188 kJ/mol ΔfH0solide -200 kJ/mol Précautions Directive 67/548/EEC 
C
OPhrases R : 5, 8, 20/22, 35, Phrases S : 1/2, 17, 26, 28, 36/37/39, 45, [2] Transport >60% : 559 2015
20 à 60% :58 2014
8 à 20% :50 2984 SIMDUT[4] 


SGH[5] 

DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[3] Inhalation Irritation sévère, mort possible. Peau Blanchit; nettoyer immédiatement. Yeux Dangereux ; laver immédiatement pendant un quart d'heure. Ingestion Blessure sérieuse, mort possible. autre Plus d’infos :
Hazardous Chemical DatabaseÉcotoxicologie DL50 2000 mg/kg souris oral
>50000 mg/kg souris i.v.
1072 mg/kg souris s.c.
880 mg/kg souris i.p.
12000mg/kg souris peauCL50 2000 mg/m³/4 heures rat inhalation Unités du SI & CNTP, sauf indication contraire. Le peroxyde d'hydrogène (H2O2), communément appelé eau oxygénée ou encore perhydrol (appellation industrielle), est un composé chimique liquide et visqueux, aux puissantes propriétés oxydantes (il est aussi réducteur). C'est donc un agent blanchissant efficace qui sert de désinfectant et (à haute concentration) d'oxydant ou monergol dans les fusées spatiales.
Sommaire
Histoire
Le peroxyde d'hydrogène fut isolé pour la première fois en 1818 par Louis Jacques Thénard en faisant réagir du peroxyde de baryum avec de l'acide nitrique.
Utilisation
- Le peroxyde d'hydrogène sert essentiellement au blanchiment de la pâte à papier (environ deux tiers du volume produit dans le monde). Les pâtes blanchies peuvent être chimiques, mécaniques ou recyclées.
- Dans le domaine de l'environnement pour le traitement des eaux, des sols et des gaz (désulfuration, deNox, etc.).
- Naturellement secrété par le corps humain, il inhibe la synthèse de pigments colorés, dont la mélanine et est responsable du blanchissement des cheveux[6]. Il peut servir (à basse concentration, environ 5 %) à décolorer les poils et cheveux, d’où les expressions : « blonde peroxydée » ou « blonde de bouteille ». Il est utilisé en coiffure comme fixateur pour achever une permanente.
- Antiseptique pour un traitement local (code ATC : A01AB02 peroxyde d'hydrogène (eau oxygénée)). Le nettoyage des plaies par l'eau oxygénée doit être prompt, car celle-ci endommage les nouvelles cellules. Elle est cependant réputée être efficace contre le tétanos, dont la bactérie est essentiellement anaérobie.
- Combiné avec l’urée sous forme de peroxyde de carbamide CH6N2O3, le peroxyde d'hydrogène sert à blanchir les dents.
- Il entre dans la composition de certains traitements en dermatologie.
- Vaporisé à haute température, il sert à stériliser les emballages alimentaires composites juste avant l'incorporation de leur contenu.
- À haute concentration, il peut servir de comburant pour la propulsion de fusées. En se décomposant dans le réacteur il fournit le dioxygène nécessaire à la combustion des combustibles auxquels il est associé. Il a la particularité de pouvoir être aussi utilisé seul comme monergol dans les Rocketbelt. Dans ce dernier cas, c'est la décomposition exothermique du peroxyde d'hydrogène concentré, initiée dans la chambre du réacteur par contact avec un catalyseur, qui génère un jet d'oxygène et de vapeur d'eau à 600 °C.
- L'eau oxygénée a été utilisée pendant plusieurs années comme révélateur d'hémoglobine en Police Scientifique. Aujourd'hui ce test n'est plus utilisé en médecine légale car des techniques plus précises existent. (ref : Espace Pierre Mendes France à Poitiers / Exposition Police Scientifique). Cette découverte a été faite par le chimiste allemand Christian Schönbein (1799-1868).
- Désinfectant pour la culture hydroponique et l'oxygénation des racines
Décomposition
Le peroxyde d'hydrogène se décompose dans une réaction exothermique de dismutation en eau et dioxygène dans des proportions dépendantes de la température, de la concentration de la présence d’impuretés et de stabilisants. Il est décomposé par beaucoup de substances, dont la plupart des métaux de transition et leurs composés, des composés organiques, la poussière, etc. Répandre du peroxyde d'hydrogène sur une substance inflammable peut provoquer un embrasement.
L’utilisation d’un catalyseur (comme le dioxyde de manganèse, le Permanganate de potassium, l'argent ou la catalase, une enzyme) augmente considérablement le taux de décomposition du peroxyde d'hydrogène. Ce phénomène produit un dégagement d'oxygène intense ainsi qu'une forte chaleur. Les récipients de stockage doivent être constitués d'une matière compatible comme le polyéthylène ou l'aluminium et nettoyés de toute impureté (un procédé appelé passivation).
La réaction de dismutation est lente et les solutions aqueuses de peroxyde d'hydrogène peuvent être conservées longtemps. L'acétanilide permet de stabiliser le produit.
La dismutation met en évidence les propriétés oxydantes et réductrices du peroxyde d'hydrogène. La dismutation peut être décrite comme une réaction entre H2O2 oxydant et H2O2 réducteur.
La réaction de dismutation 2 H2O2 → 2 H2O + O2 est composée des deux demi-équations d'oxydoréduction suivantes:
- H2O2 + 2H+ + 2e- = 2H2O (où H2O2 est l'oxydant)
- H2O2 = O2 + 2H+ + 2e- (où H2O2 est le réducteur)
Le peroxyde d'hydrogène a aussi été utilisé comme monergol. Dans les années 1930 et 1940 Hellmuth Walter en fut le pionnier. Cependant son utilisation dans les torpilles a été abandonnée dans la plupart des marines pour des raisons de sécurité.
Purification
Comme le peroxyde d'hydrogène concentré (pourcentage molaire > 70 %) est en vente restreinte, certains sont tentés de distiller des solutions plus diluées pour obtenir un monergol. C’est extrêmement dangereux.
Le barbotage suivi éventuellement d'une congélation fractionnée constitue un procédé plus sûr. Le barbotage profite du fait que l’air tiède (pas le chaud) évapore préférentiellement l'eau.
À des concentrations dépassant 62 %, le peroxyde d'hydrogène en solution dans l’eau gèle avant l’eau (c'est l'inverse à des concentrations plus faibles). L'eau oxygénée tend à demeurer en surfusion, un état métastable qui cesse, par exemple si l'on immerge un cristal de « glace oxygénée » dans la solution surfusée.
Voir aussi
Articles connexes
Liens et documents externes
- (fr) Fiche de sécurité
- (fr) Fiche INRS
- (fr) Le peroxyde d’hydrogène dans les produits de blanchiment des dents résumé du rapport du CSPC de la Commission européenne (2006)
Références
- ↑ a , b , c , d , e , f , g , h et i PEROXYDE D'HYDROGENE (SOLUTION AQUEUSE, >60 %), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « peroxyde d'hydrogene » sur ESIS, consulté le 20 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Peroxyde d'hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Sciences et Vie, On connaît la cause des cheveux blancs, nº 1100, mai 2009, p. 21.
- Portail de la chimie
- Portail de la pharmacie
Catégories : Produit chimique corrosif | Produit chimique comburant | Composé de l'hydrogène | Produit chimique domestique | Peroxyde | Antiseptique
Wikimedia Foundation. 2010.


