- Anthraquinone
-
Anthraquinone 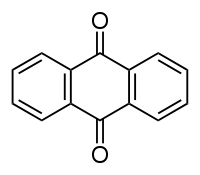
Général Synonymes 9,10-dihydro-9,10-dioxoanthracène, anthradione, 9,10-anthraquinone, anthracène-9,10-quinone, Hoelite, Morkit, Corbit No CAS No EINECS SMILES InChI Apparence solide jaune ou gris-clair à gris-vert Propriétés chimiques Formule brute C14H8O2 [Isomères] Masse molaire[1] 208,2121 ± 0,0124 g·mol-1
C 80,76 %, H 3,87 %, O 15,37 %,Propriétés physiques T° fusion 286 °C T° ébullition 379,8 °C Solubilité 0,12 à 0,60 mg·l-1 dans l'eau à 20 °C,
Sol. dans l'éther, le nitrobenzène, le benzène et l'anilineMasse volumique 1,44 g·cm-3 à 20 °C Point d’éclair 185 °C Pression de vapeur saturante 0,00013 mbar à 50 °C Thermochimie Cp Précautions NFPA 704 Inhalation irritant Peau irritant Yeux irritant Unités du SI & CNTP, sauf indication contraire. L'anthraquinone appartient à la famille chimique des hydrocarbures aromatiques polycycliques. C'est un dérivé de l'anthracène. Présent à l'état naturel chez un certain nombre d'animaux et de plantes, il est aussi une substance active de produit phytosanitaire (ou produit phytopharmaceutique, ou pesticide), qui présente un effet répulsif à l'égard des oiseaux. Isolé, il a l'apparence d'une poudre cristalline solide, du jaune et du gris-clair au gris-vert.
Ses autres noms sont 9,10-dihydro-9,10-dioxoanthracène, anthradione, 9,10-anthraquinone et anthracène-9,10-quinone, et ses noms de vulgarisation sont entre autres anthranoïde, hoelite, morkit,et corbit.
Sommaire
Origines naturelles
 La couleur jaune de certains lichens (ici Caloplaca thallincola) est liée à la présence d'anthraquinones.
La couleur jaune de certains lichens (ici Caloplaca thallincola) est liée à la présence d'anthraquinones.
L'anthraquinone existe à l'état naturel dans certaines plantes (la bourdaine, le séné (senna), l'aloès, la rhubarbe, un type de nerprun nord-américain parfois appelé le cascara), les champignons, les lichens, et la plupart des insectes, où il sert de squelette de base aux pigments. Les dérivés naturels de l'anthraquinone ont tendance à avoir des effets laxatifs.
Chimie
Il y a plusieurs moyens d'obtenir de l'anthraquinone :
- L'oxydation de l'anthracene.
- La condensation du benzène avec l'acide phtalique en présence d'AlCl3 (substitution de Friedel et Crafts). Le produit de cette réaction est l'acide o-benzoylbenzoïque, qui subit ensuite une nouvelle condensation, cette fois intramoléculaire, pour former l'anthraquinone.
- Réaction de Diels-Alder (à partir de la naphtoquinone et du 1,3-butadiène), suivie d'une oxydation.
- Réaction de rétro-Diels-Alder.
Dans une réaction chimique classique appelée la synthèse de Bally-Scholl (1905), l'anthraquinone se condense avec le glycérol pour former le benzanthrone. Dans cette réaction la quinone est d'abord réduite par du cuivre dans de l'acide sulfurique (transformant un groupement cétone en un groupement méthylène), puis on ajoute du glycérol.
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est en révision en vue de l’inscription à l’annexe I de la directive 91/414/CEE.
- pour la France : cette substance active est autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché.
Caractéristiques physico-chimiques
L'anthraquinone est seulement très partiellement soluble dans l'eau, mais est miscible dans l'alcool, le nitrobenzène et l'aniline.Cette substance est chimiquement stable dans des conditions normales.
Les caractéristiques physico-chimiques dont l'ordre de grandeur est indiqué ci-après, influencent les risques de transfert de cette substance active vers les eaux, et le risque de pollution des eaux :
- Hydrolyse à pH 7 : très stable,
- Solubilité : 0,084 mg·l-1,
- Coefficient de partage carbone organique-eau : 3 215 cm3·g-1. Ce paramètre, noté Koc, représente le potentiel de rétention de cette substance active sur la matière organique du sol. La mobilité de la matière active est réduite par son absorption sur les particules du sol.
- Durée de demi-vie : 8 jours. Ce paramètre, noté DT50, représente le potentiel de dégradation de cette substance active, et sa vitesse de dégradation dans le sol.
- Coefficient de partage octanol-eau : 3,52. Ce paramètre, noté log Kow ou log P, mesure l’hydrophilie (valeurs faibles) ou la lipophilie (valeurs fortes) de la substance active.
Écotoxicologie
Sur le plan de l’écotoxicologie, les concentrations létales 50 (CL50) dont l'ordre de grandeur est indiqué ci-après, sont observées :
Applications médicales
L'anthraquinone et ses dérivés naturels sont dotés d'un pouvoir thérapeutique avéré pour soigner tous les troubles fonctionnels intestinaux comme la colopathie fonctionnelle, la laxophobie, la constipation etc. L'anthraquinone et ses dérivés actifs comme les glucosides d'anthraquinone stimulent le péristaltisme de l'intestin grêle et augmentent les mouvements péristaltiques du côlon. Les glucosides d’anthraquinone se transforment dans le côlon en sennosides. Ces derniers sont hydrophiles et réduisent l’absorption de l’eau en vue d’avoir un bol fécal fluide. Ils évitent par conséquent, la formation de selles grumeleuses. L'anthraquinone est utilisé comme laxatif ou purgatif à partir d'un seuil de 30 mg à 36 mg par jour. Au delà du seuil de 30 mg à 36 mg par jour de sennosides, les selles tendent à devenir très molles ou liquides. Les sennosides et les glucosides d'anthraquinone contiennent un groupe d'aglycone (Voir aussi Glycoside). Ils sont présents dans les gousses et les feuilles séné, le rhizome de la rhubarbe, la bourdaine, le cascara et notamment l'aloès.
Mise en garde :
Une utilisation prolongée au delà de 8 semaines, ou un abus mène à un mélanisme du côlon, dû à la libération de lipofuscine (présente dans les histiocytes et mastocytes) dans le côlon[3],[4].
Applications industrielles
- Elle est aussi utilisée dans la fabrication industrielle de pâte à papier.
- Une autre utilisation est celle de répulsif à l'égard des oiseaux pour les plantations.
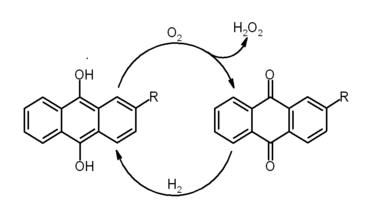
- Un dérivé, le 2-éthylanthraquinone, est utilisé pour la fabrication commerciale du peroxyde d'hydrogène :
Pigments
Les colorants anthroquinoniques existent dans le règne végétal et animal : carmin, garance (alizarine, purpurine), kermès, nerprun.
Depuis le XIXe siècle, ils sont aussi fabriqués de manière synthétique. Environ 25 pigments ont été mis sur le marché mais une dizaine seulement sont employés. Leur prix de revient les rend de plus en plus rares.
Parmi les pigments anthraquinoniques courants, on trouve :
- Bleu d’indanthrène (PB60)
- Jaune anthraquinonique (PY108)
- Rouge anthraquinonique (PR169)
- Rouge anthraquinonique (PR177)
Voir aussi
- Substance active d'un produit phytopharmaceutique
- Liste de substances actives de produits phytosanitaires
- Liste de substances actives de produits phytopharmaceutiques autorisées par l'Union européenne
- Liste de substances actives de produits phytopharmaceutiques interdites par l'Union européenne
- Liste des couleurs (pigments)
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-859-4)
- Müller-Lissner SA, « Adverse effects of laxatives: fact and fiction », dans Pharmacology, vol. 47 Suppl 1, 1993, p. 138-45 [lien PMID]
- 3280173
- Portail de la chimie
- Portail de l’agriculture et l’agronomie
Catégories :- Substance active de produit phytosanitaire
- Répulsif contre le gibier et les oiseaux
- Anthraquinone
Wikimedia Foundation. 2010.