- Cycle De L'urée
-
Cycle de l'urée
Le cycle de l'urée ou cycle de l'ornithine est un cycle de réactions biochimiques chez divers animaux qui produisent de l'urée à partir de l'ammoniaque. Il s'agit du premier cycle métabolique identifié dès 1932 par Krebs et Hensenleit. Ce cycle se déroule dans le foie, dans les hépatocytes périportaux. L'une des particularités de ce cycle est d'être à cheval entre deux compartiments subcellulaires : le cytosol et la mitochondrie.
Chez les animaux uréotéliques (notamment les mammifères, dont l'homme), l'urée est le principal produit d'élimination du métabolisme azoté. L'uréotélie est caractéristique de la vie en milieu aérien, alors que l'ammoniotélie caractérise les organismes animaux aquatiques. Il existe des déficits du cycle de l'urée, se déclarant généralement après la naissance qui consistent généralement en un déficit d'activité d'une des quatre premières enzymes du cycle. C'est un diagnostic sévère (> 50% de mortalité). Le traitement consiste en une alimentation appauvrie en protéines, parfois selon les cas enrichie en arginine. Une molécule, le phénylbutyrate permet de traiter certains déficits en évitant le cycle de l'urée en se condensant avec la glutamine pour donner la phénylacétylglutamine, éliminée par ultrafiltration rénale.
Réactions biochimiques
- Dans la mitochondrie
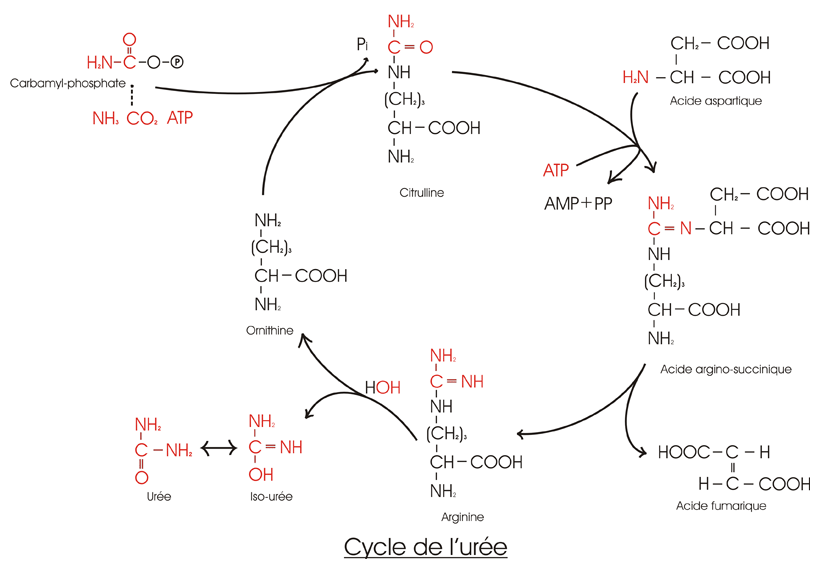
Dans la mitochondrie, une enzyme, la Carbamyl Phosphate Synthétase I (CPS I), produit le carbamyl-phosphate à partir de l'NH4+, de l'ATP et du CO2. Cette réaction se fait en deux étapes consommant chacune une molécule d'ATP. Le carbamyl apporte l'atome de carbone et un atome d'azote de la future molécule d'urée. LA CPS I doit être activée par le N-acétylglutamate, effecteur allostérique. Chez certains animaux, dont les dipneustes, cette réaction est catalysée par une CPS III. NB La CPS II est impliquée dans la synthèse des bases pyrimidiques, cette isoenzyme est cytosolique.
Le carbamyl-phosphate résultant se condense ensuite avec l'ornithine pour donner la citrulline. Cette réaction est catalysée par l'ornithine transcarbamylase (OTC). La citrulline est exportée dans le cytoplasme par diffusion facilitée.
- Dans le cytoplasme
La citrulline se condense, en présence d'ATP, avec une molécule d'acide aspartique qui apporte le deuxième atome d'azote de l'urée. L'enzyme (arginosuccinate synthase AS) possède la particularité de produire de l'AMP à partir de l'ATP, clivage qui permet la libération d'une énergie de réaction plus importante pour la réaction grâce à la pyrophosphatase qui hydrolyse l'ion pyrophasphate alors formé. En effet, l'étude de l'énergétique de la réaction montre que l'hydrolyse classique de l'ATP en ADP n'apporterait pas suffisamment d'énergie pour la réaction, la variation d'énergie libre entre les substrats principaux et l'arginossucinate étant trop élevée. Dans un second temps, l'AMP réagit avec une molécule d'ATP dans le cytoplasme pour régénérer de l'ADP : au final deux ATP sont bel et bien consommés.
Ensuite, l'acide argino-succinique est converti en arginine et en acide fumarique par l'arginosuccinate lyase (AL).
L'arginase catalyse l'hydrolyse de l'arginine en ornithine et urée en consommant une molécule d'eau. L'ornithine est ainsi régénérée et peut regagner la mitochondrie pour fixer une nouvelle molécule de carbamyl-phosphate.
Pathologie
Le cycle de l'urée est utilisé par l'organisme afin de le détoxifier de l'ammoniaque, une molécule neurotoxique. L'inactivation par mutations des enzymes du cycle de l'urée sont à l'origine des anomalies du cycle de l'urée. Ces désordres génétiques causant une déficience d'enzymes du cycle de l'urée (principalement l'ornithine transcarbamylase) ou un dysfonctionnement du foie résulte en une accumulation d'ammoniaque dans le sang. L'encéphalopathie hépatique découle de cette hyperammonémie.
Lien externe
- http://www.chups.jussieu.fr/polys/biochimie/CNbioch/POLY.Chp.2.html
- (en) [1]
- (en) The chemical logic behind the urea cycle
- Portail de la biochimie
- Portail de la médecine
- Portail de la chimie
Catégories : Métabolisme de l'azote | Carbamide
Wikimedia Foundation. 2010.