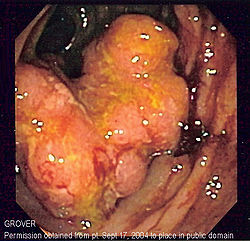
- Cancer colorectal
-
Cancer du côlon
Le cancer du côlon se développe à partir de la muqueuse du « gros intestin » ou côlon. Dans 70% des cas, la tumeur se développe dans le sigmoïde (boucle située dans la fosse iliaque gauche). Les cancers du côlon et du rectum étant assez semblables, on les regroupe sous le terme de cancer colorectal. Il s'agit toujours d'une tumeur maligne ; adénocarcinome liebekunien, développé à partir de la muqueuse.
Sommaire
Épidémiologie
C'est le second cancer, en termes de fréquence, chez la femme (après le cancer du sein) et le troisième chez l'homme (après le cancer du poumon et celui de la prostate)[1]. Les cancers coliques ont une fréquence élevée en France : chaque jour, 100 personnes apprennent qu'elles ont un cancer colorectal. Plus exactement, on découvre 33 000 nouveaux cas par an, et 16 000 personnes en meurent[2]. Chez les non-fumeurs, ils sont la deuxième cause de mortalité par cancer. Les hommes sont un peu plus touchés que les femmes (taux d'incidence de 40 et 27 pour cent-mille, respectivement[3]. En Afrique et en Asie, il y a beaucoup moins de cancers colorectaux qu'en Europe du Nord ou aux États-Unis (jusque 20 fois moins). De plus, les émigrants qui quittent un pays pauvre pour un pays où le risque est important, voient leur taux de cancer colorectal augmenter dans les 10-20 ans qui suivent leur migration. Ces faits suggèrent que le mode de vie, alimentation et efforts physiques, joue un rôle important sur le risque de cancer. Ceci conduit à penser qu'une prévention efficace est possible (voir bas de page).
Il s'agit essentiellement d'un cancer de l'âge mûr, près de 85 % des cas survenant après 65 ans[4]. Sa fréquence semble augmenter[4].
Les formes héréditaires (transmission mendélienne) sont rares (moins de 5% des cas) même si un antécédent familial est retrouvé dans près d'un cinquième des cas[5]. Les formes familiales seraient de meilleur pronostic[6].
Causes ou facteurs de risques
- L'âge : rare avant cinquante ans, les cancers colorectaux deviennent assez fréquents vers 65 ans.
- L'hérédité ou des mutations : le risque d'avoir un cancer colorectal est plus élevé si un proche a (eu) un cancer colorectal.
Le risque est d'autant plus fort qu'il y a plus de gens atteints dans la famille, que ce(s) cas sont proche(s) (père, mère, frère, sœur), et que ce(s) cas sont jeunes.
On a identifié des familles à très haut risque, où les gens ont une mutation spécifique qui les prédispose à ce cancer. Ces familles ne représentent cependant que 5 % des cancers colorectaux :- Polypose recto-colique familiale (en anglais FAP) où une multitude de polypes apparaissent chez tous les porteurs du gène Apc muté. À l'âge adulte, l'un de ces polypes dégénère forcément en cancer, sauf si on enlève le côlon par une opération chirurgicale. Le gène Apc est un gène suppresseur de tumeur et son altération est considérée comme initiatrice de la cancérogenèse colorectale (1 % environ des cancers colorectaux). Il agit en amont de la voie de signalisation Wnt. Il suffit d'une mutation d'une des deux copies de gène pour induire des polyposes adénomateuses familiales (avec apparition dès l'adolescence de centaines à milliers de polypes dans le colon[7] ;
- Syndrome de Lynch, ou cancer héréditaire du côlon sans polypose (en anglais HNPCC). Il y a moins de polypes que dans la FAP, et un risque moindre de cancer, mais la surveillance est nécessaire par colonoscopies régulières.
- Outre des mutations qui peuvent être induites au cours de la vie (exposition à de la radioactivité ou à des produits mutagènes présents dans la nourriture), une mutation du gène « Notch » peut fortement accélérer ou aggraver la cancérogenèse colorectale. Ce gène est une protéine qui agit comme un "interrupteur" qui quand il est allumé induit une cascade de réactions à l'intérieur de la cellule, permettant une prolifération cellulaire (normale et nécessaire tant qu'elle est contrôlée, dans toute cellule, de tout organisme, et notamment lors du développement embryonnaire) [8] ; Ce gène Notch, avec le gène Wnt jouent un rôle majeur dans la signalisation cellulaire intestinale, assurant le développement et l'organisation de l'intestin qui est un organe devant se renouveller en permanence (il est entièrement renouvelé en moins de 5 jours, sur ne surface de villosités et de circonvolutions qui, si elles étaient « étendues à plat » serait comparable à la taille d'un court de tennis joué en double. Des cellules progénitrices situées dans les creux des villosités intestinales doivent sans cesse produire des cellules neuves, tout en étant régulées...
Or, l'activation simultanée (artificielle ou anormale) de ces deux voies de signalisation accroît de plus de vingt fois le risque quantitatif d'apparition d'adénomes (tumeurs bénignes) intestinaux chez la souris, par rapport à l'altération de la seule voie Wnt. Le gène Notch semble donc particulièrement en cause dans un phénomène probablement synergique et déclenché par l'activation couplée de ces deux voies, créant les conditions favorisant le processus tumoral.. De plus, chez la souris, ces tumeurs se développent de façon inhabituellement rapide et importante dans le côlon, évoquant la physiopathologie du cancer du côlon chez l'homme.
- Les maladies inflammatoires chroniques intestinales (MICI), notamment la maladie de Crohn et la colite ulcéreuse : après une vingtaine d'années, le risque d'avoir un cancer est d'environ 1/3 si tout le côlon est atteint.
- Le mode de vie joue aussi un rôle important, comme indiqué ci-dessous dans le paragraphe « prévention ». En effet, si nous ne pouvons changer notre âge ou notre hérédité, nous pouvons cesser de fumer, boire moins d'alcool, manger moins de charcuteries mais plus de légumes, et faire plus de sport.
On sait que des causes environnementales sont également en jeu ;
Une alimentation riche en graisse d'origine animale prédispose à ce cancer, soit directement à cause de la richesse de celle-ci, soit à cause de substances toxiques persistantes lipophiles (solubles dans le gras) (certains pesticides, certains organochlorés, dont les Poly Chloro Biphenyls (PCB)...), apportées par cette alimentation (viande, chair de mammifères marins, poissons gras ou situé en tête de la pyramide alimentaire).Les PCB non passés dans le sang ou évacués via les excréments sont potentiellement en contact avec la muqueuse intestinale durant 1 à 2 jours, ce qui leur laisse le temps d'agir comme cancérogènes. Une équipe médicale[9] a établi en 2007 qu'un taux sanguin élevé de contaminants de type PCB exposait à un risque accru de cancer colorectal. C'est la conclusion[10] d'un suivi de 208 patients atteints de ce cancer ; ils présentaient en moyenne des taux de PCB doubles de ceux relevés dans la population (moyenne). En Catalogne, cette étude a estimé qu'un adulte moyen absorbait de très faibles doses de PCB (3,5 pico grammes de PCB par kilo de poids corporel), mais ces molécules étant stables, actives à faible dose, et très bioaccumulables, elles semblent capables d'induire des mutations génétiques (cette étude montre une relation directe la mutation de l’oncogene K-Ras et le degré d’exposition aux PCB, de même pour le gène suppresseur de tumeur « P53 »). Ces chercheurs et bien d'autres plaident pour une meilleure évaluation du risque induit par une exposition à de faibles doses de certains polluants et de synergies entre ces polluants ou entre ces polluants et d'autres molécules.
Diagnostic
Signes fonctionnels
Un cancer colorectal ne donne pas forcément des signes. C'est pourquoi, après cinquante ans, on recommande des tests de détection.
Il peut se manifester par :
- du sang dans les selles (sang fécal, apparent ou occulte, en ce cas détectable par un test) ;
- une constipation continue d'apparition récente. Parfois, une obstruction complète, ou une diarrhée persistante. À l'extrême, une occlusion peut survenir, ou une perforation de la tumeur avec péritonite. La présence de signes digestifs apparus dans les mois précédant l'accident aigu orientent vers l'origine cancéreuse de la complication aiguë ;
- une douleur abdominale
Les symptômes sont souvent moins spécifiques, avec, par exemple :
- une anémie qui donne une fatigue persistante et un teint de plus en plus pâle (due aux hémorragies intestinales). Elle est typiquement par carence en fer (taux bas du fer sérique et de la ferritine sanguine). La recherche d'un saignement occulte dans ce cas conduit à un diagnostic de cancer du côlon dans environ 10 % des cas[11].
- un amaigrissement inexpliqué ;
- tardivement, les métastases hépatiques peuvent donner un foie très gros à la palpation.
Examen clinique
Il est, en règle général, décevant. Le toucher rectal permet, par un doigt ganté introduit dans l'anus, de chercher de possibles anomalies rectales. Rapide et peu coûteux, cet examen ne détecte que des anomalies aux alentours du rectum (dépistage de 30% des tumeurs rectales).
Examens complémentaires
Coloscopie
La colonoscopie (ou coloscopie) est l'examen de référence : une sonde (long flexible enrobé de plastique) est insérée par l'anus puis glissée peu à peu dans l'intestin, le plus souvent au cours d'une anesthésie générale. Il permet d'observer la muqueuse de l'anus jusqu'à la jonction iléo-colique, au niveau du cæcum et de l'appendice, et de faire des prélèvements. Si l'on constate un polype, celui-ci est enlevé entièrement et sera analysé au laboratoire par histologie, et son exérèse diminue beaucoup le risque de cancer (voir ci-dessous le paragraphe Prévention). La sigmoïdoscopie, un examen plus rapide et moins complet, utilise une courte sonde semi-rigide qui permet l'exploration du rectum et du côlon sigmoïde, mais pas du restant du côlon.
Le tissu des prélèvements est inclus dans un bloc de paraffine pour en extraire des coupes fines de quelques micromètres. Après coloration, ces coupes sont examinées au microscope par un médecin spécialisé en anatomo-pathologie (ou histologie). Cet examen permet de classer le prélèvement suivant la forme de la tumeur et le type des cellules.
On trouve le plus souvent dans l'intestin des adénomes (= polypes adénomateux). Considéré comme bénin, le polype risque d'évoluer vers un cancer si on le laisse en place, s'il est gros (plus d'un centimètre de diamètre), et/ou s'il est villeux (=avec des villosités). Les petits polypes et les polypes tubulaires présentent moins de risques. On trouve aussi des polypes hyperplasiques considérés comme pratiquement sans risque. Enfin, on trouve dans les côlons des adénocarcinomes qui sont les véritables cancers, dont les cellules dysplasiques franchissent la lamina propria. Ce premier stade de l'invasion peut évoluer pour s'étendre à d'autres organes et conduire à l'apparition de métastases hépatiques le plus souvent, qui provoquent la mort plus fréquemment que la tumeur initiale.
Radiologie
Le coloscanner
Aujourd'hui le diagnostic en imagerie repose sur l'utilisation de la tomodensitométrie ou scanner en s'aidant d'une technique de distension colique. Cette technique particulière justifie le terme spécifique de coloscanner. La distension peut se faire avec un lavement à l'eau ou avec une insufflation gazeuse.
- Dans le premier cas de lavement à l'eau on parle de coloscanner à l'eau. Son indication est essentiellement le diagnostic d'un cancer colorectal et il est proposé en alternative à la coloscopie devant des symptômes évoquant un cancer colique, en particulier chez les sujets âgés ou fragiles pour lesquels il est préférable de se dispenser d'une anesthésie générale en première intention. Cette technique permet de faire le diagnostic du cancer et le bilan complet de recherche d'une métastase, en particulier hépatique ou pulmonaire.
- La deuxième technique dite de coloscanner avec coloscopie virtuelle obtenue par distension gazeuse, de préférence par du gaz carbonique, est maintenant une alternative performante à la coloscopie pour le diagnostic non seulement des cancers mais aussi pour celui des lésions précancéreuses, les adénomes. Cette méthode d'exploration en plein essor impose une préparation colique préalable sur 48 heures, assez similaire à celle de la coloscopie. Le scanner se fait en externe sans injection de produit de contraste et avec une irradiation très faible, jusqu'à 10 fois inférieure à celle d'un scanner abdominal habituel. Avec un contrôle précis, en temps réel, de la pression d'insufflation les risques de perforation sont quasi-inexistants et en tout cas très inférieurs à ceux de la coloscopie. Un radiologue formé à cette technique peut atteindre un taux de détection, des lésions significatives, supérieur à celui obtenu par une coloscopie [12] car certaines lésions, en particulier derrière les plis, peuvent être manquées en coloscopie. Le coloscanner ne permet pas la résection d'un polype mais il a été montré, sur des grandes séries de patients, que l'on pouvait, en commençant par le scanner, réduire de 90% le nombre de coloscopies nécessaires [13]. Pour l'instant, en France, la coloscopie reste l'examen proposé en première intention en cas de dépistage chez un patient à risque élevé. Le coloscanner est donc actuellement indiqué pour les patients qui n'ont pas pu avoir une coloscopie complète ou qui devrait en avoir une mais qui refusent sa réalisation. Le coloscanner est aussi préféré si le patient est considéré comme fragile, car le coloscanner ne nécessite pas d'anesthésie générale.
Le lavement baryté
La radiographie après lavement au sulfate de baryum (appelé couramment lavement baryté) : le baryum, très lourd, est opaque aux rayons X. Cette technique est nettement moins performante que le coloscanner et va progressivement disparaitre dans cette indication.
D'autres types d'examens sont peu utilisés, trop coûteux, trop nouveaux, ou pas assez spécifiques ou sensibles (vidéocapsule, PET, CEA…).Anatomopathologie
Les adénocarcinomes représentent 95% des cas, dont 17% d'adénocarcinomes colloïdes ou mucineux.
Pronostic
La seule classification utilisée en préopératoire est la classification TNM dont la 6e version date de 2002.
Classification TNM
T (tumeur)
- Tis intra-épithéliale ou chorion
- T1 sous-muqueuse
- T2 musculeuse
- T3 à travers la muscularis propria dans la sous-séreuse ou dans les tissus péricoliques non péritonealisés.
- T4 organe ou structure de voisinage et/ou perforation du péritoine viscérale
N (ganglion)
- N0 pas de métastase ganglionnaire
- Nx ganglions non évalués ou moins de 8 ganglions examinés
- N1 1 à 3 ganglions métastatiques régionaux
- N2 4 ganglions métastatiques régionaux ou plus
- N3 gg centraux
M (métastase)
- M0 pas de métastase
- M1 métastases à distance (dont ganglions sus-claviculaires)
Stadification
À partir des données de la classification TNM, les cancers du côlon sont classés en 4 stades. Les chances de guérison varient considérablement du stade I au stade IV. Pour chacun des stades est noté entre parenthèses le taux de survie cinq ans après le traitement[14]. La stratégie thérapeutique est également adaptée à chacun de ces stades.
- Stade I (93.2%): pT1-T2 N0 M0
- Stade II : pT3-T4 N0 M0
- Stade IIA (84.7%) : pT3 N0 M0
- Stade IIB (72.2%) : pT4 N0 M0
- Stade III : tous T N1-N2 M0
- Stade IIIA (83.4%) : pT1T2N1M0
- Stade IIIB (64.1%) : pT3T4N1M0
- Stade IIIC (44.3%) : tous T N2M0
- Stade IV (8.1%) : métastases à distance
Le pronostic est plus mauvais en cas d'occlusion ou de perforation, de cancer colloïde muqueux ou indifférencié. Il est meilleur en cas de phénotype RER+ (MSI).
Traitement
Quand le cancer est détecté à un stade précoce, on le guérit (90% de guérisons pour les stades I). Si le cancer est découvert tardivement, les chances de guérison sont beaucoup plus faibles (moins de 5% de guérison au stade IV). Le premier traitement est la chirurgie, qui permet d'enlever la tumeur et les ganglions environnants (curage ganglionnaire). (Les cancers très superficiels sont parfois totalement réséqués par voie endoscopique, sans chirurgie complémentaire nécessaire s'il n'y a pas franchissement de la musculaire muqueuse). On y associe des traitements adjuvants: chimiothérapie, si le curage contient des métastases ganglionnaires ou s'il existe des métastases hépatiques ou pulmonaires; radiothérapie si l'exerèse chirurgicale n'a pu être totale, avec reliquat tumoral individualisé sur un organe vital.
Dans le cas du cancer du bas rectum, la présence de ganglions visibles sur le scanner ou l'échoendoscopie est une indication de radio-chimiothérapie préopératoire.
Méthodes thérapeutiques
Endoscopie
Tout polype enlevé en endoscopie est étudié en anatomie pathologique. La présence de dysplasie (état précancéreux) ou de cancérisation très superficielle (pas d'envahissement de la musculaire muqueuse, c'est à dire stade Tis) fait que la résection endoscopique est curative. La présence de cancer sur une berge d'exérèse ou un envahissement en profondeur (stade T1 ou plus) entraine une indication de chirurgie complémentaire systématique (sauf si l'état général du patient ne le permet pas).
Chirurgie
Le but de la chirurgie est d'enlever la tumeur et les ganglions qui sont autour par curage ganglionnaire. Les ganglions accompagnant les vaisseaux sanguins irriguant le côlon (situés dans le mésocôlon, lame graisseuse s'étendant entre l'aorte et le côlon), on se trouve donc à enlever un segment de côlon et non simplement la tumeur. L'exérèse, pour être suffisante, doit emporter au moins 5 cm de côlon de part et d'autre du cancer, et au moins 12 ganglions dans le curage.
Du fait de l'anatomie vasculaire du côlon, les interventions les plus couramment pratiquées sont :
- l'hémicolectomie droite, avec anastomose iléo-transverse, emportant tout le mésocôlon jusqu'au bord droit de l'artère mésentérique supérieure ;
- l'hémicolectomie gauche vraie, avec anastomose entre le côlon transverse et le haut rectum. Le curage ganglionnaire emporte l'artère mésentérique inférieure, liée à 1 cm de son origine sur l'aorte et ses branches. ;
- la sigmoïdectomie avec ligature vasculaire après émergence de l'artère colique supérieure gauche ;
- les résections du côlon transverse sont plus atypiques et dépendent de l'anatomie vasculaire mise en évidence en préopératoire.
Enlever la tumeur est le moyen le plus rapide et le plus efficace d'éliminer le cancer. Cependant, si la tumeur a déjà envoyé des métastases loin du côlon, l'exerèse chirurgicale ne suffit pas à guérir le malade.
Ces interventions peuvent être faites par laparotomie (ouverture du ventre) ou par cœlioscopie (on travaille dans un ventre gonflé par du CO2 grâce à des instruments introduits par des orifices de 1 cm. Le cancer est sorti par une petite incision à la fin de l'intervention).
La présence d'une incontinence anale non curable, de complications du cancer à type d'occlusion ou de perforation, ou l'impossibilité de conserver le sphincter anal, conduisent à pratiquer une stomie (ou anus artificiel): le côlon est abouché à la peau de l'abdomen, et les selles sont récupérées dans une poche que le patient positionne lui-même tous les jours ou tous les 3 jours. Les appareillages actuellement disponibles assurent un confort de qualité.
S'il y a découverte de métastases hépatiques pendant la chirurgie d'un cancer du côlon, la résection est envisagée : de façon synchrone (dans le même temps opératoire) si l'exérèse apparaît facile, de façon métachrone (plus tard) en cas de métastases multiples. De récentes études ont montré que la taille et le nombre de lésions avaient peu d'influence sur la survie après chirurgie. Certaines techniques comme l'échographie préopératoire, la chimiothérapie néoadjuvante (avant la chirurgie hépatique) ainsi que l'embolisation de la branche de la veine porte du segment atteint, la radiofréquence, permettent d'augmenter le nombre de patients opérables de leurs métastases et la précision du geste chirurgical.
Si le patient n'est pas opérable, des alternatives existent : chimiothérapie ou plus récemment l'application de traitements physiques sur les métastases (ablation par radiofréquence, traitements thermiques). Les métastases pulmonaires d'un cancer colorectal doivent elles aussi être opérées quand c'est possible. Dans le cas contraire, ici aussi chimiothérapie et traitements physiques sont possibles.
Chimiothérapie
La chimiothérapie consiste à administrer au malade un médicament cytotoxique destiné à tuer les cellules cancéreuses. Ce traitement, quand il est efficace, peut éliminer les métastases ou empêcher leur apparition et/ou rétrécir les tumeurs ou ralentir leur croissance. La chimiothérapie est généralement un traitement adjuvant effectué en plus de l'opération chirurgicale pour augmenter les chances de succès. Parfois aussi le traitement est palliatif quand la chirurgie est impossible, ou permet de diminuer la taille de la tumeur avant l'opération (néo-adjuvant).
Les drogues les plus utilisées sont :
- le 5-fluorouracile (5FU), c'est le médicament de référence en cancérologie intestinale. Il existe aussi sous forme orale (Xéloda®)
- L'oxaliplatine (LOHP) est synergique du 5FU ; c'est une drogue majeure dans le traitement du cancer du côlon. Au stade métastatique, il est utilisé associé au 5FU (Protocole FOLFOX) et parfois avec l'Avastin (FOLFOX-Avastin). En deuxième ligne métastatique, après une première ligne de chimiothérapie à base d'Irinotécan, l'association FOLFOX-Avastin est plus efficace que le FOLFOX seul. En situation adjuvante, après une chirurgie d'éxérèse complète, le FOLFOX4 pendant 6 mois est plus efficace qu'une chimiothérapie à base de 5FU (LV5FU2 ou Fufol). Les résultats actualisés en 2007 de l'étude MOSAIC montrent[15] :
- six ans après la chirurgie pour un cancer du côlon de stade III, 73% des patients traités par FOLFOX4 sont en vie contre 68.6% des patients traité par LV5FU2. En revanche, il n'y a pas d'avantage pour les patients traités pour un cancer de stade II
- 5 ans après la chirurgie, chez les patients traités pour un cancer du côlon de stade III ou de stade II (avec des facteurs de mauvais pronostic) le taux de rechute est plus faible avec le FOLFX qu'avec le LV5FU2.
Le risque d'alopécie est plus faible sous oxaliplatine que sous CPT11. En revanche, on observe des neuropathies invalidantes sous oxaliplatine responsables de dysesthésies (fourmillements) au niveau des doigts et des orteils, parfois invalidantes et prolongées.
- l'Irinotécan® (CPT-11) peut avoir des effets secondaires graves, diarrhée sévère notamment. ( inhibiteur de la topoisomerase 1, non reconnu par le MDR )
- le raltitrexed (Tomudex®), peut entraîner des neutropénies
- le cetuximab (Erbitux®) est un anticorps monoclonal qui bloque l'action du récepteur à l'EGF, celui ci étant présent le plus souvent à la surface des cellules de l'épiderme (d'où son nom), mais aussi à la surface des cellules cancéreuses. Il améliore significativement le pronostic de certains cancers du côlon, même si le gain reste, toutefois, faible (quelques mois)[16].
Il existe en France actuellement deux médicaments "spécifiques" donnés en association avec le 5-FU: l'Erbitux® fabriqué par le laboratoire allemand Merck et l'Avastin® (laboratoires ROCHE). Un 3e médicament qui a reçu l'autorisation de mise sur le marché aux États-Unis arrivera bientôt en France: le Vectibix®(laboratoires AMGEN). Ces trois molécules sont dites "anticorps monoclonaux" et sont voisines dans leur action puisqu'elles inhibent l'action des facteurs de croissance cellulaire. L'Avastin® bloque le signal de prolifération des néo-vaisseaux irriguant les tumeurs (il bloque la néo-vascularisation). En empêchant l'apparition de ces vaisseaux, on diminue l'apport sanguin vers la tumeur, donc on limite son développement. De plus, il semblerait que ces molécules augmentent l'efficacité des chimiothérapies. Les effets secondaires sont moins lourds que les chimiothérapies conventionnelles. L'Erbitux® a pour effet secondaire principal l'apparition d'un rash cutané pseudo-acnéique (qui marque souvent l'efficacité du traitement) de même que le Vectibix® dont le mécanisme d'action est très proche (anti EGFR). L'Avastin® quant à lui peut provoquer des saignements plus ou moins importants ainsi que des retards de cicatrisation (il doit être arrêté deux mois avant une intervention). Ces anticorps, du fait de leur composition, ont cependant un risque d'accident allergique (choc anaphylactique) malgré tout très faible. En effet, ils sont produits à partir d'anticorps d'origine animale, le plus souvent, qui sont ensuite "humanisés", d'où le risque allergique. Ce n'est pas le cas du Vectibix®, car il dérive d'anticorps d'origine humaine : il n'y a donc pas de risques d'allergie.
Radiothérapie
On irradie parfois la tumeur pour tuer les cellules cancéreuses, avant ou après opération chirurgicale. La radiothérapie peut être associée à une chimiothérapie qui sensibilise la tumeur à l'effet létal des rayons. La radiothérapie est le plus souvent utilisée pour les cancers du rectum, parfois en préopératoire. Dans les cancers du côlon, elle peut être utile si le cancer ne peut être réséqué en totalité du fait d'un envahissement (uretère, vaisseaux iliaques).
Soutien nutritionnel
Toute résection d'un cancer du côlon peut entraîner des diarrhées, parfois invalidantes. De même, les chimiothérapies utilisées provoquent souvent une accélération du transit. Les patients se voient donc proposer un régime sans résidu plus ou moins restrictif: éviter de manger des crudités, des légumes riches en fibres ou des viandes en sauce peut améliorer le confort de vie. De même des épaississants digestifs type Smecta ou des ralentisseurs du transit type lopéramide peuvent aider.
Soutien psychologique
Voir l'article Cancer > Soutien psychologique.
Stratégie thérapeutique
Cancer du côlon localisé
Le traitement du cancer du colon localisé est un traitement curatif. Le premier temps consiste a enlever la tumeur, le plus souvent au cours d'une chirurgie. Ensuite, un traitement adjuvant par chimiothérapie est proposée si le risque de rechute est important. En 2008 une chimiothérapie est proposée systématiquement lorsqu'il existe des métastases ganglionnaires (Stade III). En l'absence de métastases ganglionnaires, la chimiothérapie adjuvante est proposée dans les cas suivants :
- T4N0
- emboles lymphatiques
- occlusion,
- perforation
- nombre de ganglions prélevés insuffisants
- aneuploïdie
Dans ces deux cas le protocole de chimiothérapie le plus fréquemment utilisé est le protocole FOLFOX4, une injection tous les quinze jours pendant 6 mois.
Cancer du côlon ou du rectum métastatique d'emblée
Cancer du côlon ou du rectum secondairement métastatique
Prévention du cancer colorectal
La majorité des cancers du côlon et du rectum pourraient être évités par une surveillance accrue, un mode de vie approprié et, probablement aussi, la prise orale de produits de chimioprévention.
- Surveillance : la plupart des cancers colorectaux naissent dans des polypes (ou adénomes). Ces lésions peuvent être détectées et enlevées lors d'une coloscopie. Des études montrent que cette procédure pourrait diminuer de 80% le risque de mort par cancer intestinal si on commençait les examens vers 45 ans, puis tous les 5 ou 10 ans[17]. Le coloscanner, qui est un scanner couplé à un lavement avec un composé radio-opaque, est un choix alternatif possible, avec une sensibilité très correcte et une spécificité un peu moins bonne[18].
- Mode de vie : la comparaison de l'incidence du cancer colorectal dans différentes régions du monde suggère que la sédentarité, l'excès de calories ingérées et peut-être aussi un régime trop riche en viande rouge et en charcuteries, pourraient augmenter le risque de cancer. Inversement, l'activité physique et un régime riche en fruits et légumes, ferait baisser le risque de cancer, probablement parce que les végétaux contiennent des micronutriments protecteurs. En changeant son style de vie, on pourrait donc diminuer le risque de cancer de 60 à 80% [19]. Par ailleurs, une alimentation favorisant les fruits et légumes, les poissons et les volailles, pourrait diminuer le risque de récidive et la mortalité du cancer[20].
- Chimioprévention : plus de 200 produits, notamment les micronutriments cités ci-dessus, ainsi que d'autres nutriments comme le calcium ou l'acide folique (une vitamine B), et des médicaments comme l'aspirine inhibent la cancérogenèse dans des modèles précliniques (chez l'animal). Dans certaines études, on inhibe complètement les tumeurs induites chimiquement dans le côlon des rats. D'autres études montrent l'inhibition importante des polypes intestinaux spontanés chez des souris mutées (souris Min). Les essais cliniques de chimioprévention chez des volontaires humains ont eu moins de succès, mais peu de produits ont été testés à ce jour. Des suppléments de calcium ou d'aspirine donnés chaque jour pendant 3 à 5 ans après l'enlèvement d'un polype, ont diminué la réapparition des polypes chez les volontaires (de 15 à 20%). La base de données de chimioprévention de l'INRA [21] donne les résultats de toutes les études publiées sur les agents de chimioprévention chez l'homme et chez les rongeurs. L'aspirine, par ailleurs, semble améliorer le pronostic des formes tumorales avec sur-expression de la Cyclo-oxygénase de type 2 (COX-2)[22].
Dépistage
Recherche de sang fécal
La recherche du sang fécal occulte (voir ci-dessus) est faite tous les 3 - 5 ans par test Hemoccult consistant à rechercher des traces de sang (humain ou animal) dans les selles : On étale soi-même un peu de matière fécale sur un « carton » spécial, deux jours de suite. Plié, ce carton est envoyé au laboratoire pour y détecter du sang même en très petite quantité. On peut donc détecter le saignement d'un polype intestinal (pas forcément cancéreux). Si ce test est positif, on le refait, et si la positivité se confirme, une coloscopie doit être faite.
Le test Hemoccult est le 1er outil de diagnostic utilisé lors des campagnes de dépistages. Cependant, ce test a des limites : le patient doit s'abstenir de manger des viandes peu cuites, boudin noir et toute source extérieure de sang dans les trois jours qui précèdent le test. Il est trop peu spécifique et sensible chez le sujet considéré à risques où l'on préfère proposer d'emblée une coloscopie[4]. Sa sensibilité est, en particulier, proche de 50%, ce qui signifie qu'un cancer sur deux n'est pas détecté par ce test[23]. Elle est un peu augmentée sur la dernière version du test, Hemoccult Sensa[24]. Cela reste, malgré tout, intéressant en termes de santé publique puisque le dépistage permet de réduire de près de 16% la mortalité due à ce cancer[25].
Il existe des tests sur selles recherchant spécifiquement des traces de sang humain (ou de protéines humaines). Ils seraient plus sensibles et plus spécifiques[24].
L'analyse spectrométrique (spectroscopie) d'un échantillon de selles grâce à un spectromètre à résonance magnétique serait "capable dans 95% des cas d'identifier à la fois la présence d'un cancer et de polypes précancéreux" selon l'Institut du Biodiagnostic de Winnipeg (Centre National de Recherches Canada)[réf. nécessaire]. Cette technique est en cours d'évaluation chez l'homme.
Colonoscopie
Il est recommandé, en première intention, chez les patients ayant des antécédents familiaux de cancer col-rectal et ceux qui ont eu une ablation de polype[26]. L'intervalle entre deux examens reste dicuté.
Autres
La recherche d'Acide désoxyribonucléique anormaux dans les selles pourrait être une technique alternative et serait plus sensible que l'Hémoccult[27].
Le coloscanner n'a pas été évalué dans le dépistage systématique.
Notes et références
- ↑ Boyle P, Ferlay J, Cancer incidence and mortality in Europe 2004, Ann Oncol, 2005;16:481-8
- ↑ données Francim, 1995
- ↑ données CIRC 2002
- ↑ a , b et c Ballinger AB, Anggiansah C, Colorectal cancer, BMJ, 2007;335:715-718
- ↑ Lynch HT, de la Chapelle A, Hereditary colorectal cancer, N Engl J Med, 2003;348:919-932
- ↑ Chan JA, Meyerhardt JA, Niedzwiecki D et Als. Association of family history with cancer recurrence and survival among patients with stage III colon cancer, JAMA, 2008;299:2515-2523
- ↑ Communiqué CNRS
- ↑ Travaux publiés en ligne dans PNAS, par le Pr Daniel Louvard (CNRS et Centre de Recherche de l'Institut Curie) et l'équipe Spyros Artavanis-Tsakonas) : Silvia Frea et al. « Notch and Wnt Signals cooperatively control cell proliferation and tumorigenesis in the intestine » ; Proc. Natl. Acad. Sci. USA., février 2009, Lire l'article en ligne (open access)
- ↑ Université Autonome de Barcelone, Institut Catalan d’Oncologie, Conseil Supérieur de Recherches Scientifiques (CSIC), avec l'aide de l'Hôpital Universitaire de Bellvitge de Barcelone
- ↑ Source : Journal espagnol: El Pais en ligne (2005 05 04) citant la revue médicale Environmental Health Perspectives, 2007
- ↑ Rockey DC, Cello JP, Evaluation of the gastrointestinal tract in patients with iron-deficiency anemia, N Engl J Med 1993;329:1691-5
- ↑ PJ Pickhardt, NEJM, Déc 2003
- ↑ PJ Kim, NEJM, Oct 2007
- ↑ O'Connell et al., J Natl Cancer Inst 2004;96:1420-5)
- ↑ ASCO 2007
- ↑ Jonker DJ, O'Callaghan CJ, Karapetis CS et Als. Cetuximab for the treatment of colorectal cancer, N Eng J Med, 2007;357:2040-2048
- ↑ Winawer et al., 1993 NEJM, 329:1977
- ↑ Johnson CD, Mei-Hsiu Chen, Toledano AY et Als. Accuracy of CT Colonography for Detection of Large Adenomas and Cancers, N Eng J Med, 2008;359:1207-1217
- ↑ Cummings and Bingham, 1998, BMJ, 317:1636
- ↑ Meyerhardt JA, Niedzwiecki D, Hollis D, Association of dietary patterns with cancer recurrence and survival in patients with stage III colon cancer, JAMA, 2007;298:754-764
- ↑ chimioprévention
- ↑ Chan AT, Ogino S, Fuchs CS, Aspirin use and survival after diagnosis of colorectal cancer, JAMA, 2009;302:649-658
- ↑ Malila N, Oivanen T, Malminiemi O, Hakama M, Test, episode, and programme sensitivities of screening for colorectal cancer as a public health policy in Finland: experimental design, BMJ, 2008;337:a2261
- ↑ a et b Lieberman DA, Screening for colorectal cancer, N Eng J Med, 2009;361:1179-1187
- ↑ Hewitson P, Glasziou P, Irwig L, Towler B, Watson E, Screening for colorectal cancer using the faecal occult blood test, Hemoccult, Cochrane Database Syst Rev, 2007;(1):CD001216
- ↑ Winawer S, Fletcher R, Rex D et als. Colorectal cancer screening and surveillance: clinical guidelines and rationale -- update based on new evidence, Gastroenterology, 2003;124:544-560
- ↑ Ahlquist DA, Sargent DJ, Loprinzi CL et als. Stool DNA and occult blood testing for screen detection of colorectal neoplasia, Ann Intern Med, 2008;149:441-450
- Portail de la médecine
Catégories : Tumeur de l'appareil digestif | Maladie du côlon et du rectum
Wikimedia Foundation. 2010.