- 501-36-0
-
Resvératrol
trans-resvératrol 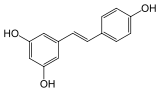
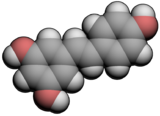
Structure du trans-resvératrol Général Nom IUPAC 5-[(E)-2-(4-hydroxyphenyl)-ethenyl]benzene-1,3-diol No CAS DrugBank PubChem , SMILES InChI Apparence solide Propriétés chimiques Formule brute C14H12O3 [Isomères] Masse molaire 228,2433 g∙mol-1
C 73,67 %, H 5,3 %, O 21,03 %,Propriétés physiques T° fusion 254°C[1] Solubilité eau ~0.03 mg/mL
éthanol 50 mg/mL
DMSO ~16 mg/mLPrécautions Directive 67/548/EEC 
XiPhrases R : 37/38, 41, Phrases S : 26, 39, Unités du SI & CNTP, sauf indication contraire. Le resvératrol est un polyphénol de la classe des stilbènes présent dans certains fruits comme les raisins, les mûres ou les cacahuètes. On le retrouve en quantité notable dans le vin où sa présence a été invoquée pour expliquer les effets bénéfiques pour la santé d’une consommation modérée de vin.
Son nom viendrait[2] de Veratrum album L. var grandiflorum, le vératre blanc, d’où il a été extrait pour la première fois en 1939 par un japonais, Takaoka. Il fut aussi identifié en 1959 dans un eucalyptus puis en 1963 dans la racine du Fallopia japonica (ou Polygonum cuspidatum), une Polygonacée d’Asie orientale utilisée depuis des siècles en médecine traditionnelle chinoise et japonaise. Son identification dans la pellicule du raisin date de 1976 mais il a fallu attendre 16 ans plus tard, pour qu’en 1992, Siemann et Creasy l’identifient finalement dans le vin.
À la même époque, paraissaient deux articles qui allaient avoir un énorme retentissement sur les études du resvératrol. Le premier en 1992, de Renaud et De Lorgeril [3] montrait qu’une consommation modérée de vin pouvait protéger de la maladie coronarienne et le second en 1993, de Frankel et al. [4] démontrait que c’était le resvératrol du vin qui, en inhibant l’oxydation du LDL, devait être responsable de son effet cardioprotecteur. Le resvératrol était donc un bon candidat pour résoudre l’énigme du paradoxe français, expression qui renvoie à la situation surprenante de la région du sud-ouest, où une consommation élevée de graisses animales est associée à un taux relativement bas de maladies cardio-vasculaires (relativement aux pays du nord de l’Europe).
Ces travaux allaient déclencher une pléthore d’études sur le rôle chimiopréventif des polyphénols du vin et en particulier du resvératrol. En dehors de la prévention de la maladie coronarienne, la liste des effets bénéfiques bien documentés de ce composé n’allait cesser de croître : elle concerne l’inflammation, l’activation plaquettaire, l’angiogenèse, le maintien de la masse osseuse, la réduction de la masse adipeuse, la neuroprotection, le vieillissement. Pendant une décennie, les observations étayant les bénéfices pour la santé du resvératol n’ont cessé de s’accumuler mais en s’appuyant toujours sur des preuves indirectes comme les études épidémiologiques ou sur les effets biologiques établis sur des systèmes in vitro ou d’animaux de laboratoire. Pour l'instant, en raison de l'absence de preuve directe, ces résultats ne peuvent être étendus à l'homme qu'avec la plus grande prudence.
Sommaire
Propriétés physiques
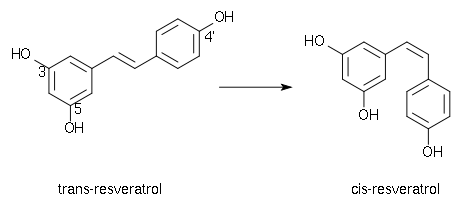
Le resvératrol se présente sous deux formes isomères, trans- et cis-, avec un passage de la forme trans- à la forme cis- par irradiation UV. Le trans-resvératrol est donc une molécule photosensible qu’une simple exposition à la lumière suffit à transformer de manière irréversible dans son isomère cis. C'est un composé instable supportant aussi assez mal la chaleur et les milieux oxydants.
L'isomère trans est la forme bioactive. Il a été montré que l'activité anti-oxydante du cis-resvératrol est 7 fois inférieure à celle du trans-resvératrol[5].
Plantes riches en resvératrol
Le resvératrol est une phytoalexine, c’est-à-dire une substance induite par un stress environnemental ou pathogène (tel qu’une attaque fongique comme le Mildiou ou le Botrytis chez la vigne) et destinée à contenir localement les dégâts du pathogène. La forme isomérique trans- est plus abondante dans les plantes que la forme cis-. On la trouve dans au moins 72 espèces de plantes réparties dans 12 familles[6]. Ce sont les familles de plantes supérieures suivantes : Vitaceae, Myrtaceae, Dipterocarpaceae, Cyperaceae, Gnetaceae, Fabaceae, Pinaceae, Polygonaceae, Moraceae, Fagaceae, Liliaceae.
Parmi les plantes alimentaires, on trouve le resvératrol dans[7],[8],[9] :
- le raisin. Le resvératrol est surtout concentré dans la pellicule du grain et on le trouve en quantité variable suivant le cépage, l’origine géographique et l’exposition aux maladies fongiques[10]. Il est majoritairement présent sous forme de glucoside (trans-resvératrol-3-O-glucoside). Pour le vin, l’importance du resvératrol dépend en outre de la durée de macération des peaux dans le jus. Ce qui explique pourquoi les vins blancs, peu ou pas macérés, ont moins de resvératrol (0,13 mg/l de trans- et 0,06 mg/l de cis-resvératrol) que les rosés et ceux-ci moins que les vins rouges. Les plus riches sont les vins de Pinot noir (Bourgogne), de Merlot, de Grenache ou de Mourvèdre. Le cépage de Pinot noir contient le plus de resvératrol, avec une concentration pouvant aller jusqu’à 11,9 mg/l (en Suisse) ; en France, sa teneur moyenne est de 5,4 ± 1,2 mg/L[11]. Le resvératrol y est majoritairement présent sous forme aglycone, sous les formes isomériques trans- et cis-[12]. La teneur en t-resvératrol du vin rouge varie beaucoup suivant la région de production. Si on classe les cinq plus grands producteurs mondiaux de vin par la teneur moyenne en resvératrol de leur vin rouge[9], on obtient
-
- France > Australie > Italie > Espagne > États-Unis.
- les fèves de cacao constituent une source importante de flavonoïdes et de resvératrol. Le chocolat noir contient 0,4 mg/kg de resvératrol[7], soit la seconde source alimentaire de ce polyphénol après le vin;
- les baies rouges du genre Vaccinium : jus de canneberge avec un taux de 0,278 mg/kg;
- l’arachide (Arachis hypogaea) : les cacahuètes grillées sont relativement pauvres en resvératrol (0,03 à 0,147 mg/kg);
- la rhubarbe (Rheum tataricum), la mûre (Morus spp.), la grenade (Punica granatum), le sorgho etc.
Plantes médicinales riches en resvératrol :
- la renouée du Japon, Reynoutria japonica (ou Fallopia japonica ou Polygonum cuspidatum), est une Polygonacée originaire d’Asie orientale, appelée 虎杖 huzhang en chinois et itadori en japonais. C’est une plante très vigoureuse, pouvant atteindre 3 m de haut, qui a tendance à devenir invasive en Europe et aux États-Unis. La plante entière est utilisée comme matière médicale en Chine (sous le nom de 石莽草 shimangcao) et au Japon (sous le nom d'itadori ou de kojôkon pour la racine). La racine de cette renouée est une des sources les plus riches en resvératrol connue (2,96-3,77 g/kg). Une fois séchée, la racine fournit une infusion, le « thé d’itadori », traditionnellement utilisé depuis des siècles en Chine et au Japon dans le traitement des maladies cardio-vasculaires et comme anti-inflammatoire. Il a été trouvé dans cette infusion 9,74 mg/l de resvératrol, principalement sous forme de glucoside, ce qui place cette boisson dans la moyenne supérieure des vins rouges[12].
- les deux vératres, Veratrum album L. var grandiflorum et Veratrum formosanum ont aussi leurs racines et rhizomes utilisés comme matière médicale dans la médecine traditionnelle chinoise (sous le nom de 藜芦 li lu) et japonaise.
- le Yucca schridigera, le Dracaena loureiri
Absorption et métabolisme
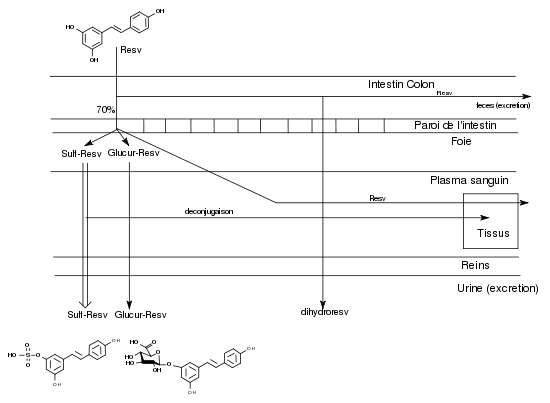
Pendant longtemps, des études sur les activités pharmacologiques du resvératrol ont été menées sans connaître les mécanismes d’absorption et de biodisponibilité de ce composé. Quand l’obtention de trans-resvératrol radiomarqué comme traceur a permis de faire les premières observations, la surprise a été grande de découvrir qu’après une prise orale, on le retrouvait en majorité dans les urines sous des formes conjuguées et qu’il n’était pratiquement pas décelable dans le plasma sanguin. Le resvératrol ingéré oralement est absorbé à hauteur de 70% dans l’intestin, ce qui est un taux remarquablement élevé pour un polyphénol[13]. Il apparaît chez certains sujets très rapidement (30 min environ) après ingestion à l’état de trace dans le plasma sanguin mais très rapidement il est métabolisé dans le foie en resvératrol-3-sulfate (ou -4’-sulfate) ou en resvératrol-3-4’-disulfate (ou 3,5-disulfate) et en resvératrol-3-O-glucuronide (ou 4’-O-glucuronide).La glucuronidation en 4’ semble préférentielle[14]. En 2003, Goldberg[15] en déduisait qu’il « semblait que le rôle bénéfique pour la santé de ces composés sous leur forme non conjuguée, fondé sur des études de leur activité in vitro, était irréaliste et avait été très exagéré ».
L’étude de la distribution du 14C-trans-resvératrol dans tous les tissus de la souris peut se faire de manière très précise par autoradiographie. Vitrac et ses collaborateurs (2003)[16] ont observé que la concentration de la radioactivité dans le sang était relativement basse et constante durant les 6 h de l’expérience. Au bout de 3 h, on trouve la concentration la plus élevée dans le duodénum, puis par ordre décroissant, les reins, le foie et les poumons, la rate et le côlon, le cœur, le cerveau et les testicules. En utilisant la microautoradiographie, les auteurs montrèrent que le trans-resvératrol peut pénétrer les tissus, en particulier le foie où les hépatocytes sont capables d’incorporer la radioactivité. En tenant compte de la présence de glucosides du resvératrol (picéide, astringine) dans le vin rouge et de leur possible hydrolyse dans l’intestin, les auteurs concluent ainsi: « il peut être suggéré qu’une consommation régulière et modérée de vin rouge devrait pouvoir garantir au corps humain la quantité de resvératrol suffisante pour assurer une action chimiopréventive du cancer ».
Il existe de plus des synergies entre les divers polyphénols contenus dans une boisson qui peuvent changer leur biodisponibilité. Il a été montré que le quercétol (contenu aussi dans le vin) interférait avec la sulfatation et la glucuronidation du resvératrol dans le foie et pouvait ainsi accroître sa biodisponibilité[17].
Activités biologiques
Activités anti-oxydantes
Une production excessive de radicaux libres dans l’organisme peut provoquer des dégâts importants sur les macromolécules et les cellules de cet organisme. La dégradation des lipides par le stress oxydant provoquera des dépôts de lipides oxydés dans les vaisseaux à l’origine des plaques d’athérome, perturbera le fonctionnement des membranes cellulaires et produira des dérivés carcinogènes. Les attaques radicalaires de l’ADN seront source de mutations carcinogènes et celles des protéines inhiberont les enzymes et dérégleront les signaux cellulaires de prolifération ou de défense.
Les antioxydants peuvent agir à deux niveaux de la réaction d’oxydation :
- - dès la phase d’initiation, ils peuvent empêcher la formation de radicaux en bloquant, dans des complexes, les métaux de transition (fer, cuivre) qui agissent autrement comme de puissants catalyseurs. Ce sont des chélateurs de métaux de transition.
- - lors de la phase de propagation, ils peuvent intercepter les radicaux et briser la chaîne de réaction. Ce sont des piégeurs de radicaux.
Le resvératrol, comme tous les polyphénols, possède des groupes hydroxyles phénoliques, Ar-OH, pouvant fournir des H aux radicaux peroxyles L-OO• et par là, les neutraliser sous la forme d’hydroxydes L-OOH :
Ar-OH + L-OO• → Ar-O• + L-OOH
Le radical Ar-O• étant assez stable et moins réactif, va briser la chaîne.
Comme il n’existe pas de mesure absolue d’évaluation du potentiel antioxydant d’un composé, il faut recourir à des évaluations comparatives avec d’autres composés. De plus ces comparaisons vont dépendre de la méthode d’évaluation et en particulier du radical libre péroxyle utilisé.
- En comparant la capacité in vitro à piéger les radicaux libres du DPPH• (2,2-diphényl 1-picrylhydrazyl)[18] par le resvératrol ou certains flavonoïdes du vin, Iacopini et ses collaborateurs[19] ont obtenu la hiérarchie suivante :
- Les flavonoïdes sont plus antioxydants que la vitamines E (Trolox) alors que le resvératrol l’est beaucoup moins.
- Mais si on utilise un générateur de radicaux impliqué dans les processus physiopathologiques comme le peroxynititre ONOO-, on obtient l’ordre suivant:
- Quercétol > Catéchol > Resvératrol > Rutoside > Trolox
- Le resvératrol se retrouve alors dans la moyenne des potentiels antioxydants des flavonoïdes.
- Un test encore plus intéressant sur le plan physiopathologique consiste à évaluer la capacité à réduire la péroxydation des lipoprotéines de basse densité LDL (transporteur du cholestérol)[20]. Il est maintenant largement admis que la formation de radicaux libres à partir des lipides du LDL est un facteur essentiel de la genèse de l’athérosclérose.
- En incubant le LDL avec l’ion cuivrique Cu2+ pour catalyseur, l’effet d’inhibition de la peroxydation des lipides, obtenu en ajoutant des polyphénols, se fait dans l’ordre suivant :
- Resvératrol > Quercétol > Trolox > Catéchol
- Le resvératrol est un puissant antioxydant, plus efficace même que les flavonoïdes à empêcher la péroxydation du LDL. Il agit principalement « en amont » de la réaction en rendant inopérant le catalyseur cuivrique. C’est un chélateur de l’ion cuivrique Cu2+. Le grand pouvoir de chélation du resvératrol est utile in vivo car on sait que le LDL a une forte propension à se lier au cuivre. La capacité de chélation du cis-resvératrol n’est par contre que de la moitié de celle du trans-resvératrol.
- Lorsque le LDL est incubé avec comme générateur de radicaux libres, l’AAPH[21], le resvératrol agit « en aval » de la réaction en piégeant les radicaux libres de lipide péroxyle formés et en empêchant la propagation de la réaction en chaîne d’oxydation. Le resvératrol est toutefois un piégeur de radicaux libres moins puissant que les flavonoïdes et à peu près similaire à la vitamine E :
- Quercétol > Catéchol > Resvératrol > Trolox
- Avec une autre technique conçue pour mettre en évidence le mécanisme de piégeur de radicaux libres (et non pas de chélateur), Sojanovic et collaborateurs (2001)[22] ont montré que le resvératrol et les flavonoïdes, quercétol et épicatéchol, étaient tous également puissants. Tous les trois étaient capables de réduire d’environ 95% la peroxydation lipidique de liposomes[23].
- L’effet antioxydant du vin devrait donc être imputé aux flavonoïdes et aux acides-phénols plutôt qu’au resvératrol, puisque ce dernier y est présent à des doses plusieurs centaines de fois inférieures (0,1 – 10 mg/L de trans-resvératrol contre 1000 – 3000 mg/L de flavonoïdes).
- Ils ont également montré que c’était principalement le groupe hydroxyle OH en position 4’ qui donnait son H pour piéger les radicaux libres.
Activités anti-inflammatoires
Le resvératrol est capable d’inhiber l’agrégation des plaquettes sanguines. Suite à une lésion d’une paroi artérielle, les plaquettes viennent s’accrocher aux parties endommagées du vaisseau et produisent de l’ADP et du thromboxane A2. Ces composés déclenchent l’agrégation des plaquettes entre elles et le thromboxane A2 provoque de surcroît une vasoconstriction. L’accumulation d’un grand nombre de plaquettes forme une masse compacte pouvant obstruer le vaisseau.
En 1995, Pace-Asciak et ses collaborateurs[24] ont montré que deux polyphénols du vin rouge, le quercétol et le resvératrol, pouvaient inhiber in vitro l'agrégation plaquettaire induite par l’ADP (ou par la thrombine). Ils ont aussi établi que le resvératrol était capable de bloquer la synthèse du thromboxane A2 à partir de l’arachidonate. La même équipe poursuivit l’année suivante ses travaux[25] sur 24 sujets humains auxquels ils ont fait boire par période de 4 semaines, du vin rouge, du vin blanc, du jus de raisin et du jus de raisin additionné de 4 mg/L de resvératrol. L’analyse de leurs plaquettes a montré que les groupes qui avaient consommé du vin ou du jus additionné de resvératrol accroissaient leur résistance à l’agrégation plaquettaire et diminuaient leur thromboxane.
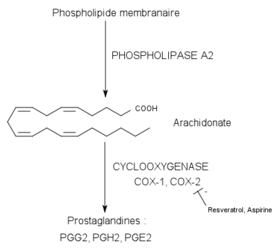
Les propriétés proprement anti-inflammatoires du resvératrol ont été mises en évidence en 1997 sur la souris. On s’est aperçu que le resvératrol pouvait réduire un œdème de la patte de la souris induit par le carraghénane, en agissant au niveau des prostaglandines[26]. Les prostaglandines et les thromboxanes sont des médiateurs lipidiques de l’inflammation dérivés de l’acide arachidonique. L’arachidonate provient lui, en général, des phospholipides de la membrane plasmique (par action de la phospholipase A2). De ce composé dérivent ensuite par la voie de la cyclo-oxygénase (COX-1 et COX-2) les prostaglandines et les thromboxanes (voir schéma).
Plusieurs travaux ont montré que le resvératrol était en mesure d’inhiber l’enzyme cible COX-2. Les études in vitro sur les cellules épithéliales[27] et sur les macrophages[28] ont montré qu’il pouvait réduire la synthèse de prostaglandines en inhibant l’expression du gène de la COX-2 et en diminuant directement l’activité de la COX-2.
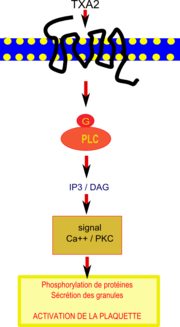
Voie de transduction du signal inhibée par le resvératrol dans une plaquette. IP3 va stimuler l’augmentation du calcium intracellulaire et le DAG déclenche des phosphorilations de protéines provoquant la sécrétion des granules et conduisant au final à l'activation de la plaquette
L’aspirine est un médicament antithrombotique très souvent prescrit bien qu’une proportion importante des patients y soit résistante. En traitant des prélèvements sanguins avec le collagène (pour provoquer l’agrégation plaquettaire), Stef et ses collaborateurs[29] ont montré le resvératrol pouvait réduire l’agrégation des plaquettes des patients cardiaques résistants à l’aspirine, là où l’aspirine échouait. Toutefois le mécanisme précis d’action du resvératrol n’est pas parfaitement compris.
Des travaux récents[30]suggèrent que l’effet cardioprotecteur du resvératrol, obtenu grâce à sa puissante inhibition de l’agrégation plaquettaire et son atténuation de l’expression d’une protéine de surface, la P-sélectine[31], serait lié en amont à la diminution de l’activité de la phospholipase C β (PLC β). Le thromboxane A2 active les plaquettes en se fixant sur un récepteur spécifique de celles-ci couplé à une protéine G et à la phospholipase C (PLC) qui catalyse des réactions produisant IP3 (inositol triphosphate) et DAG (diacylglycérol).
Activité antitumorale
Allongement de la durée de vie
- Levure de bière
L’intérêt pour le resvératrol allait être relancé en 2003 lorsqu’Howitz et ses collaborateurs[32] après avoir testé de nombreux polyphénols sur la longévité de la levure de bière (Saccharomyces cerevisiae) s’aperçurent que le resvératrol était le plus efficace de tous. Lorsqu’une cellule de levure se divise, on peut distinguer la cellule mère de la cellule fille qui est plus petite et compter ainsi le nombre de divisions de la cellule mère jusqu’à sa mort. Alors que la longévité moyenne de la levure sauvage est de 21 générations, celle de la levure avec du resvératrol dans son milieu de culture est 35,7 générations, soit une augmentation de durée de vie de 70%.
Les auteurs ont immédiatement essayé de voir si cet effet pouvait être rapproché d’un autre mécanisme très étudié d’allongement de vie par restriction alimentaire (restriction calorique). On sait depuis les années 30 que le moyen le plus simple et le plus efficace de rallonger la durée de vie d’un animal est de restreindre sa prise alimentaire. En diminuant sa ration alimentaire normale de 30 à 40%, on permet à l’animal de vivre en meilleure santé et plus longtemps. Cet effet de restriction calorique (RC) sans malnutrition a été observé chez des espèces aussi diverses que les mouches, les vers ou les rongeurs. Lin et collaborateurs[33],[34] (2000, 2002) ont montré qu’en réduisant la concentration en glucose dans le milieu de culture de 2% à 0,5%, on peut allonger la durée de vie réplicative de la levure, accroître sa respiration et activer le gène Sir2. Et inversement, en invalidant le gène Sir2, la restriction calorique (RC) ne produit plus d’extension de durée de vie. Le mécanisme d’action de la restriction calorique modérée (confirmé et précisé depuis) pouvait donc être résumé ainsi :
RC ⇒ activation des mitochondries ⇒ activation de SIR2 ⇒ allongement de vie
Peu de temps après ces travaux, Howitz et ses collaborateurs[32] s’aperçurent que, parmi les polyphénols testés, le resvératrol non seulement allongeait le plus la durée de vie de la levure mais aussi produisait la meilleure activation de SIR2. Ils postulèrent donc que le resvératrol mimait l’effet de la restriction calorique sur l’allongement de vie. La protéine SIR2 qui appartient à la famille des protéines antivieillissement, les sirtuines, possède chez les mammifères, un orthologue, SIRT1. Les sirtuines sont des enzymes dépendantes du NAD, capables de désacétyler des protéines et d’accroître la durée de vie de la levure, du ver Caenorhabditis elegans et de la mouche Drosophile[35].
On comprend donc les espoirs considérables suscités par le resvératrol : voilà une molécule vraiment miraculeuse qui pourrait nous permettre d’obtenir des bénéfices subtantiels pour la santé et la longévité sans devoir se priver de nourriture !!
D’autres analyses génétiques ont montré que dans la restriction calorique sévère, avec moins de 0,05% de glucose (soit 1/10 de la RC modérée), l’allongement de vie se produisait aussi mais sans activer les mitochondries et Sir2[36]. Il semble donc que le degré de restriction calorique et son déroulement temporel puissent influencer la relation entre mitochondries, sirtuines et longévité. Plusieurs voies métaboliques d’allongement de la vie par RC sont possibles[37].
- Les vertébrés
Une des première études de l’effet du resvératrol sur la durée de vie des vertébrés a porté sur un petit poisson à durée de vie courte, le Nothobranchius furzei. Grâce à une supplémentation en resvératrol, ce poisson voit sa durée de vie médiane et maximum s’allonger et les effets du vieillissement sur l’activité motrice se faire moins sentir[38].
Deux études récentes indiquent qu’un traitement au resvératrol étend la durée de vie de la souris obèse et permet de contrecarrer les effets délétères d’un régime riche en graisse. Le groupe d’Auwerx près de Strasbourg (Lagouge et al. 2006)[39] et le groupe de Sinclair de Boston (Baur et al., 2006)[40] ont montré que les effets bénéfiques du resvératrol sur le niveau de glucose et d’insuline des souris obèses ouvraient des perspectives intéressantes pour le traitement du diabète de type 2. Lagouge et ses collaborateurs ont administré pendant 9 semaines un régime riche en graisse, représentatif de l’alimentation des pays occidentaux, à deux groupes de souris. Le groupe dont l’alimentation était très fortement enrichi en resvératrol[41] a montré une prise de poids inférieure de 40%. En analysant les tissus musculaires, ils se sont aperçus qu’ils contenaient beaucoup plus de mitochondries et que celles-ci étaient très actives. En accroissant la consommation d’oxygène dans les mitochondries, le resvératrol permet d’éviter une prise de poids indue et fournit une meilleure résistance à la fatigue. Lors d'un test d’endurance, les souris ayant reçu du resvératrol pouvaient courir deux fois plus loin que les autres. L’équipe a établi que l’action du resvératrol passe par l’activation de la sirtuine SIRT1 et d’un co-activateur de transcription PGC-1α qui joue un rôle fondamental dans la biogenèse mitochondriale et l’adipogenèse[42].
Le groupe de Sinclair eut recours à un protocole expérimental différent de celui d’Auwerx : il utilisa des doses beaucoup plus faibles de resvératrol (1/18e de la dose d’Auwerx), durant une période plus longue (deux ans) sur les souris plus âgées. Mais même avec ce traitement à faible dose au long cours, les souris recevant une alimentation grasse additionnée de resvératrol améliorent leur sensibilité à l’insuline et accroissent leur durée de vie de manière sensible par rapport aux souris recevant seulement une nourriture grasse. Par contre, elles connaissent à peu près la même prise de poids. Les études des deux groupes montrent un accroissement de la biogenèse mitochondriale, de l’activité PGC-1α, de la protéine kinase activée par AMP et des fonctions motrices.
Pour les souris nourries normalement, ad libitum, on constate qu’elles ne vivent pas plus longtemps lorsqu’elles reçoivent du resvératrol. Mais elles manifestent une plus grande résistance aux affections liées à l’âge telle une moindre albuminurie, une diminution de l’inflammation, moins de cataractes, une plus grande coordination motrice, une perte de la densité osseuse moins importante[43].
On ne dispose pas encore de publications portant sur les effets du resvératrol sur l’activation des sirtuines chez l’homme, mais l’étude de Civitarese et de ses collaborateurs (2007)[44] portant sur l’effet de la restriction calorique sur l’expression de SIRT1 est assez instructive. Grâce à un petit groupe de personnes qui ont accepté de réduire de 25% la valeur calorique de leur alimentation pendant 6 mois, ces auteurs ont pu observer une plus grande expression de SIRT1, un plus grand nombre de mitochondries dans les muscles, de moindre dégâts de l’ADN et une amélioration de la fonction mitochondriale.
 Voies métaboliques de la RC et du resvératrol, d'après Guarente[37]
Voies métaboliques de la RC et du resvératrol, d'après Guarente[37]
En raison d’une forte exposition aux espèces réactives oxygénées, l’ADN mitochondrial accumule au cours du temps des mutations qui provoquent le déclin des enzymes mitochondriales. Les dysfonctionnements des mitochondries pourraient être le facteur majeur des maladies neurodégénératives.[45],[46] Le resvératrol qui peut passer la barrière hémato-encéphalique pourrait avoir un rôle protecteur vis-à-vis des processus neurodégénératifs dans la maladie de Huntington, de Parkinson et d'Alzheimer.
L’effet du resvératrol a été étudié sur deux modèles animaux de la maladie d’Huntington : le ver Caenorhabditis elegans surexprimant la huntingtine mutée responsable de la maladie, sur lequel des tests in vivo ont été effectués et une souris transgénique portant le gène muté (codant la huntingtine) dont les neurones ont été analysés in vitro. Dans les deux modèles, le resvératrol supprime les effets toxiques de la huntingtine mutée. Les neurones du ver retrouvent leur réactions normales et la mort neuronale est diminuée chez la souris. L’activation de SIRT1 par le resvératrol conduit à une moindre toxicité dans les cellules neurales qui expriment une forme mutée de la huntingtine[47].
La destruction par un neurotoxique des neurones dopaminergiques de la substantia nigra permet de simuler chez le rat la maladie de Parkinson. Après avoir fait ingérer du resvératrol (10, 20, 40 mg/kg) à ces rats, Jin et ses collaborateurs[48] ont montré qu’au bout de 2 semaines les animaux pouvaient récupérer une partie de leur fonction. Ils ont testé les réponses des rats en leur injectant de l’amphétamine : les animaux n’étant lésés que d’un côté, vont se mettre à tourner rapidement sur eux-mêmes, mais ceux qui ont ingéré du resvératrol tournent beaucoup moins.
L’effet du resvératrol a été testé sur deux modèles murins de la maladie d’Alzheimer (MA) : soit des souris transgéniques portant le gène muté de l’APP, lié à la forme familiale de la MA et développant d’importantes plaques β-amyloïdes sans perte neurale[49], soit des souris transgéniques surexprimant la protéine p25 qui provoque une dérégulation de la protéine tau et une dégénérescence neuronale massive.[50] On constate que les souris p25 ont un niveau de SIRT1 qui croît au fur et à mesure de la perte neurale alors que les souris du premier type ne montrent aucune augmentation de la SIRT1. En additionnant durant 45 jours à la nourriture des souris APP du resvératrol (à raison de 300 mg/kg/jour), Karuppagounder et ses collaborateurs[49] ont pu observer une diminution importante de la surface des plaques amyloïdes dans le cortex médial, le striatum et l’hypothalamus. Par contre, aucun changement significatif n’a été trouvé dans l’hippocampe, foyer principal de la maladie d’Alzheimer. Kim et ses collaborateurs[50] ont observé in vitro que le resvératrol via l’activation de SIRT1, diminuait de moitié la mort neurale de cellules transfectées par p25-GFP. Pour réduire in vivo la neurodégénération au niveau de l’hippocampe, ils ont dû injecter directement le resvératrol dans les ventricules du cerveau des souris p25. Ils ont alors pu observer une réduction du déficit d’apprentissage et du déclin cognitif. Le resvératrol active SIRT1 qui désacétyle la protéine p53 et l'inhibition de l'apoptose a un effet neuroprotecteur.
== Effets contradictoires du Resvératrol == [51]
Malgré tous ces résultats très favorables, l’efficacité et la sécurité du resvératrol n’a toujours pas été démontrée chez l’homme. Certaines contre-indications sont déjà connues : un effet sur les plaquettes sanguines qui pourraient augmenter le risque de saignement et l’impact défavorable sur les maladies auto-immunes. L'augmentation de durée de vie de certains animaux traités au resveratrol a été remise en question par plusieurs laboratoires travaillant sur la levure, la drosophile et le nématode. Pour plus de détails et les références d'articles scientifiques, voir la section "Sir2/SIRT1 and resveratrol" de la page calorie restriction (en anglais), montrant que la recherche continue et qu'il n'est encore pas possible de tirer des conclusions définitives quant aux effets du resvératrol sur l'être humain.
Notes et références
- ↑ (en) « Resveratrol » sur ChemIDplus, consulté le 20 août 2009
- ↑ Uni. Freibourg
- ↑ (en) S. Renaud, de Lorgeril, « Wine, alcohol, platelets, and the French paradox for coronary heart disease », dans Lancet, vol. 339, no 8808, 1992, p. 1523-6
- ↑ (en) E. N. Frankel, A. L. Waterhouse and J. E. Kinsella, « Inhibition of human LDL oxidation by resveratrol », dans The Lancet, vol. 341, no 8852, 1993, p. 1103-4
- ↑ (en) Jean-Michel Mérillon, Bernard Fauconneau, Pierre Waffo Teguo, Laurence Barrier, Joseph Vercauteren et François Huguet, « Antioxidant Activity of the Stilbene Astringin, Newly Extracted from Vitis vinifera Cell Cultures », dans Clinical Chemistry, vol. 43, no 6, 1997
- ↑ (en) Jang, M., Cai, L., Udeani, G. O., Slowing, K. V., Thomas, C. F., Beecher, C. W., « Cancer chemopreventive activity of resveratrol, a natural product derived from grapes », dans Science, vol. 275, 1997, p. 218-220
- ↑ a et b (en) Christine Counet, Delphine Callemien, Sonia Collin, « Chocolate and cocoa: New sources of trans-resveratrol and trans-piceid », dans Food Chemistry, vol. 98, 2006, p. 649-657
- ↑ (en) Lucie Frémont, « BIOLOGICAL EFFECTS OF RESVERATROL », dans Life Sciences, vol. 66, no 8, 2000, p. 663-673
- ↑ a et b (en) Ulrik Stervbo, Ole Vang, Christine Bonnesen, « A review of the content of the putative chemopreventive phytoalexin resveratrol in red wine », dans Food Chemistry, vol. 101, 2007, p. 449-457
- ↑ de 5 à 7 ppm dans la pellicule et 1 ppm dans les pépins, d'après Counet et al.(2006) (réf. ci-dessus)
- ↑ en moyenne dans le monde, les Pinot noir ont 3,6 ± 2,9 mg/L, les Merlot 2,8 ± 2,6 mg/L, d'après Stervbo et al (2006), réf. ci-dessus
- ↑ a et b (en) JENNIFER BURNS, TAKAO YOKOTA HIROSHI ASHIHARA,MICHAEL E. J. LEAN, ALAN CROZIER, « Plant Foods and Herbal Sources of Resveratrol », dans J. Agric. Food Chem., vol. 50, 2002
- ↑ (en) Thomas Walle, Faye Hsieh, Mark H. DeLegge, John E. Oatis, Jr., and U. Kristina Walle, « HIGH ABSORPTION BUT VERY LOW BIOAVAILABILITY OF ORAL RESVERATROL IN HUMANS », dans Drug Metabolism and Disposition, vol. 32, no 12, 2004
- ↑ (en) VITAGLIONE Paola, SFORZA Stefano, GALAVERNA Gianni, GHIDINI Cristiana, CAPORASO Nicola, VESCOVI Pier Paolo, FOGLIANO Vincenzo, MARCHELLI Rosangela, « Bioavailability of trans-resveratrol from red wine in humans », dans Molecular nutrition & food research, vol. 49, no 5, 2005, p. 495-504
- ↑ (en) David M. Goldberga,Joseph Yanb, George J. Soleas, « Absorption of three wine-related polyphenols in three different matrices by healthy subjects », dans Clinical Biochemistry, vol. 36, 2003, p. 79-87
- ↑ (en) Xavier Vitrac, Alexis Desmoulière, Brigitte Brouillaud, Stéphanie Krisa, Gérard Deffieux, Nicole Barthe, Jean Rosenbaum, Jean-Michel Mérillon, « Distribution of [14C]-trans-resveratrol, a cancer chemopreventive polyphenol, in mouse tissues after oral administration », dans Life Sciences, vol. 72, 2003, p. 2219-2233
- ↑ (en) De Santi C, Pietrabissa A, Mosca F, Pacifici, « Glucuronidation of resveratrol, a natural product present in grape and wine, in the human liver. », dans Xenobiotica, vol. 30, 2000, p. 1047-54
- ↑ quand un agent antiradicalaire est ajouté au DPPH•, l’électron libre est apparié et la couleur pourpre change en jaune
- ↑ (en) P. Iacopini, M. Baldi, P. Storchi, L. Sebastiani, « Catechin, epicatechin, quercetin, rutin and resveratrol in red grape: Content,in vitro antioxidant activity and interactions », dans Journal of Food Composition and Analysis, vol. 21, 2008, p. 589-598 [[doi:10.1016/j.jfca.2008.03.011 texte intégral]]
- ↑ (en) Leila Belguendouz, Lucie Fremont, Alain Linard, « Resveratrol Inhibits Metal Ion-Dependent and Independent Peroxidation of Porcine Low-Density Lipoproteins », dans Biochemical Pharmacology, vol. 53, 1997, p. 13-47-1355
- ↑ 2,2'-azobis(2-amidinopropane) dihydrochloride
- ↑ (en) Sandra Stojanovic, Helmut Sprinz, and Ortwin Brede, « Efficiency and Mechanism of the Antioxidant Action of trans-Resveratrol and Its Analogues in the Radical Liposome Oxidation », dans Archives of Biochemistry and Biophysics, vol. 391, no 1, 2001 [[doi:10.1006/abbi.2001.2388 texte intégral]]
- ↑ vésicules formés par deux couches de lipide, à l'intérieur desquels est enfermé l'antioxydant étudié. La peroxydation est déclenchée par une irradiation gamma γ
- ↑ (en) Cecil R. Pace-Asciak, Susan Hahn, Eleftherios P. Diamandis, George Soleas, David M. Goldberg, « The red wine phenolics trans-resveratrol and quercetin block human platelet aggregation and eicosanoid synthesis: Implications for protection against coronary heart disease », dans Clinica Chimica Acta, vol. 235, 1995, p. 207-219
- ↑ (en) Cecil R. Pace-Asciak, Olga Rounova, Susan E. Hahn, Eleftherios P. Diamandis, David M. Goldberg, « Wines and grape juices as modulators of platelet aggregation in healthy human subjects », dans Clinica Chimica Acta, vol. 246, no 1-2, 1996
- ↑ (en) Jang M, Cai L, Udeani GO, Slowing KV, Thomas CF, Beecher CW, et al., « Cancer chemopreventive activity of resveratrol, a natural product derived from grapes », dans Science, vol. 275, 1997, p. 218-220
- ↑ (en) Kotha Subbaramaiah, Wen Jing Chung, Pedro Michaluarti, Nitin Telang, Tadashi Tanabe, Hiroyasu Inoue, Meishiang Jang, John M. Pezzuto, and Andrew J. Dannenberg, « Resveratrol Inhibits Cyclooxygenase-2 Transcription and Activity in Phorbol Ester-treated Human Mammary Epithelial Cells », dans The Journal of Biological Chemistry, vol. 273, no 34, 1998
- ↑ (en) Javier Martinez and Juan J. Moreno, « Effect of Resveratrol, a Natural Polyphenolic Compound, on Reactive Oxygen Species and Prostaglandin Production », dans Biochemical Pharmacology, vol. 59, 2000, p. 865-870
- ↑ (en) Stef G, Csiszar A, Lerea K, Ungvari Z, Veress G., « Resveratrol inhibits aggregation of platelets from high-risk cardiac patients with aspirin resistance. », dans J Cardiovasc Pharmacol., vol. 48, no 2, 2006, p. 1-5
- ↑ (en) Yu-Min Yang, Jun-Zhu Chen, Xing-Xiang Wang,Shi-Jun Wang, Hu Hu, Hong-Qiang Wang, « Resveratrol attenuates thromboxane A2 receptor agonist-induced platelet activation by reducing phospholipase C activity », dans European Journal of Pharmacology, vol. 583, 2008, p. 148-155
- ↑ La P-sélectine est exprimée à la surface des plaquettes lors de leur activation. Elle intervient de façon précoce dans les interactions des leucocytes avec les plaquettes lors du processus inflammatoire.
- ↑ a et b (en) Konrad T. Howitz, Kevin J. Bitterman, Haim Y. Cohen, Dudley W. Lamming, Siva Lavu, Jason G. Wood, Robert E. Zipkin, Phuong Chung, Anne Kisielewski, Li-Li Zhang, Brandy Scherer & David A. Sinclair, « Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan », dans Nature, vol. 425, 2003, p. 191-6
- ↑ (en) Su-Ju Lin, Pierre-Antoine Defossez, Leonard Guarente, « Requirement of NAD and SIR2 for Life-Span Extension by Calorie Restriction in Saccharomyces cerevisiae », dans Science, vol. 289, 2000
- ↑ (en) Lin SJ, Kaeberlein M, Andalis AA, Sturtz LA, Defossez PA, Culotta VC, Fink GR, Guarente L., « Calorie restriction extends Saccharomyces cerevisiae lifespan by increasing respiration », dans Nature, vol. 418, 2002, p. 344-8
- ↑ (en) Guarente L, Picard F., « Calorie restriction--the SIR2 connection. », dans Cell, vol. 120, no 4, 2005, p. 473-82
- ↑ (en) Kaeberlein, M., Powers, R.W., 3rd, Steffen, K.K., Westman, E.A., Hu, D., Dang,N., Kerr, E.O., Kirkland, K.T., Fields, S., and Kennedy, B.K., « Regulation of yeast replicative life span by TOR and Sch9 in response to nutrients », dans Science, 2005, p. 1193-1196
- ↑ a et b (en) Guarente Leonard, « Mitochondria – A Nexus for Aging, Calorie Restriction, and Sirtuins? », dans Cell, vol. 132, 2008
- ↑ (en) Valenzano, D.R., Cellerino, A.,, « Resveratrol and the pharmacology of aging: a new vertebrate model to validate an old molecule », dans Cell Cycle, vol. 5, 2006, p. 1027-1032
- ↑ (en) Marie Lagouge, Carmen Argmann, Zachary Gerhart-Hines, Hamid Meziane, Carles Lerin, Frederic Daussin, Nadia Messadeq, Jill Milne, Philip Lambert, Peter Elliott, Bernard Geny, Markku Laakso, Pere Puigserver, and Johan Auwerx, « Resveratrol Improves Mitochondrial Function and Protects against Metabolic Disease by Activating SIRT1 and PGC-1a », dans Cell, vol. 127, 2006, p. 1109-1122
- ↑
- ↑ à la dose de 400 mg/kg/jour
- ↑ ainsi que dans la différentiation cellulaire du muscle et le métabolisme énergétique
- ↑
- ↑ (en) Anthony E. Civitarese, Stacy Carling, Leonie K. Heilbronn, Mathew H. Hulver, Barbara Ukropcova, Walter A. Deutsch,Steven R. Smith, Eric Ravussin, « Calorie Restriction Increases Muscle Mitochondrial Biogenesis in Healthy Humans », dans PloS Medicine, vol. 4, no 3, 2007, p. 0485-0494
- ↑ (en) Douglas C. Wallace, « The mitochondrial genome in human adaptive radiation and disease:On the road to therapeutics and performance enhancement », dans Gene, vol. 354, 2005, p. 169-180
- ↑ S. Rasouri, M. Lagouge, J. Auwerx, « SIRT1/PGC-1 Un axe neuroprotecteur ? », dans m/s médecine/sciences, vol. 23, 2007, p. 840-4
- ↑ (en) Parker JA, Arango M, Abderrahmane S, Lambert E, Tourette C, Catoire H, Néri C., « Resveratrol rescues mutant polyglutamine cytotoxicity in nematode and mammalian neurons », dans Nat. Genet., vol. 37, no 4, 2005
- ↑ (en) Feng Jin, Qin Wu, Yuan-Fu Lu, Qi-Hai Gong, Jing-Shan Shi, « Neuroprotective effect of resveratrol on 6-OHDA-induced Parkinson's disease in rats », dans European Journal of Pharmacology, vol. 600, 2008, p. 78-82
- ↑ a et b (en) Saravanan S. Karuppagounder, John T. Pinto, Hui Xu, Huan-Lian Chen, M. Flint Beal, Gary E. Gibson, « Dietary supplementation with resveratrol reduces plaque pathology in a transgenic model of Alzheimer’s disease », dans Neurochemistry International, 2008
- ↑ a et b (en) Dohoon Kim, Minh Dang Nguyen, Matthew M Dobbin, Andre Fischer, Farahnaz Sananbenesi, Joseph T Rodgers, Ivana Delalle, Joseph A Baur, Guangchao Sui, Sean M Armour, Pere Puigserver, David A Sinclair, and Li-Huei Tsai, « SIRT1 deacetylase protects against neurodegeneration in models for Alzheimer’s disease and amyotrophic lateral sclerosis », dans EMBO Journal, vol. 26, no 13, 2007
- ↑ (références précises nécessaires)
Liens externes
- YVERY Cosmétiques: Articles sur le Resveratrol
- Analyse du Resvératrol et de ses Dérives dans les Vins, Adrian M. et al. Université de Bourgogne;
- Étude sur le resvératrol et le cancer de l'utérus, Université de Trois-Rivière Cyberpresse.
(article non-disponible)
- Portail de la biochimie
- Portail de la médecine
- Portail de la chimie
Catégories : Produit chimique irritant | Antioxydant | Stilbénoïde
Wikimedia Foundation. 2010.