- Épigénétique
-
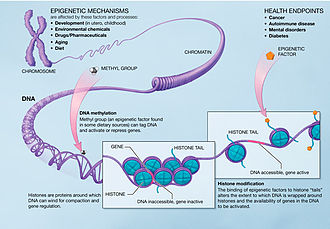 Les mécanismes épigénétiques peuvent être perturbés ou influencés in utero et dans l'enfance. La pollution chimique, les médicaments et les drogues, le vieillissement et l'alimentation sont des facteurs qui peuvent agir sur l'épigénome. Les histones sont des protéines autour desquelles l'ADN peut s'enrouler, ce qui le rend plus compact et en régule l'expression génique. Le cancer, l'autoimmunité, les troubles psychiatriques et le diabète peuvent résulter de dérangements épigénétiques. Les modifications d'histones consistent en la liaison de facteurs épigénétiques aux « queues » des histones, qui modifie l'enroulement de l'ADN autour des histones et, par conséquent, la disponibilité de certains gènes pour la transcription[1].
Les mécanismes épigénétiques peuvent être perturbés ou influencés in utero et dans l'enfance. La pollution chimique, les médicaments et les drogues, le vieillissement et l'alimentation sont des facteurs qui peuvent agir sur l'épigénome. Les histones sont des protéines autour desquelles l'ADN peut s'enrouler, ce qui le rend plus compact et en régule l'expression génique. Le cancer, l'autoimmunité, les troubles psychiatriques et le diabète peuvent résulter de dérangements épigénétiques. Les modifications d'histones consistent en la liaison de facteurs épigénétiques aux « queues » des histones, qui modifie l'enroulement de l'ADN autour des histones et, par conséquent, la disponibilité de certains gènes pour la transcription[1].
L'épigénétique est le domaine qui étudie comment l'environnement et l'histoire individuelle influent sur l'expression des gènes, et plus précisément l'ensemble des modifications transmissibles d'une génération à l'autre et réversibles de l'expression génique sans altération des séquences nucléotidiques.
L'existence de phénomènes épigénétiques se retrouve dans l'interrogation de Thomas Morgan « Si les caractères de l'individu sont déterminés par les gènes, pourquoi toutes les cellules d'un organisme ne sont-elles pas identiques ? »
En effet, chaque cellule d'un même organisme ayant un même patrimoine génétique - mis à part quelques rares mutations somatiques - leurs différences supposent une expression différentielle des gènes. Les phénomènes épigénétiques peuvent donc être définis dans un sens restreint comme les phénomènes de modification du patron d'expression des gènes sans modification de la séquence nucléotidique : par exemple méthylation des cytosines ou des protéines histones liées à l’ADN. Ces changements peuvent se produire spontanément, en réponse à l'environnement, y compris psychologique[2], ou du fait de la présence d'un allèle particulier. Elles ont la particularité d'être héritables d'une génération de cellule à l'autre au cours de la mitose voire sur plusieurs générations d'organismes au cours de la méiose, même si leur cause a disparu.
Une autre preuve de l'existence de l'épigénétique est l'ensemble des différences physiques et biologiques qui apparaissent chez les vrais jumeaux (monozygotes) qui vivent et se nourrissent dans des environnements différents.
Au cours du développement, vient ainsi s’ajouter à l’héritage génétique une programmation par des processus épigénétiques, elle-même sous l’influence d’une multitude de facteurs environnementaux.
- « On peut sans doute comparer la distinction entre la génétique et l’épigénétique à la différence entre l’écriture d’un livre et sa lecture. Une fois que le livre est écrit, le texte (les gènes ou l’information stockée sous forme d’ADN) seront les mêmes dans tous les exemplaires distribués au public. Cependant, chaque lecteur d’un livre donné aura une interprétation légèrement différente de l’histoire, qui suscitera en lui des émotions et des projections personnelles au fil des chapitres. D’une manière très comparable, l’épigénétique permettrait plusieurs lectures d’une matrice fixe (le livre ou le code génétique), donnant lieu à diverses interprétations, selon les conditions dans lesquelles on interroge cette matrice. »[3].
Des phénomènes épigénétiques ont été mis en évidence chez les Eucaryotes et les procaryotes, et d'abord chez les plantes (où des caractères acquis par un individu, peuvent être transmis aux générations suivantes, propriété utilisées par les sélectionneurs).
Les épimutations sont bien plus fréquentes que les mutations classiques de l’ADN. L'épigénome a une stabilité dynamique.Les phénomènes épigénétiques couvrent les paramutations, le bookmarking (en), le phénomème d'empreinte, l'extinction de gène, l'Inactivation du chromosome X, l' effet de position (en), la reprogrammation (en), la transvection (en)[4], l'effet maternel (l'effet paternel est plus rare car le sperme est un vecteur moins important de matériel non nucléotidique), la régulation des modifications d'histone et de l'hétérochromatine. Ils sont entre autres impliqués dans l'évolution des cancers, la tératogenèse, certaines maladies génétiques (disomie uniparentale ou maladie lié à l'empreinte génomique) ainsi que dans les limitations de la parthénogenèse ou du clonage.
Sommaire
Rappels historiques
Le mot « épigenèse » remonte à Aristote qui nomme ainsi le développement d'un œuf informe de façon graduelle aboutissant à un organisme aux tissus différenciés. Cette théorie s'opposa au préformationisme qui postulait que l'être vivant préexistait en miniature dans le germe. La controverse entre épigénisme et préformationnisme fut une controverse majeure de la biologie au XIXe siècle.
On attribue la paternité de l'épigénétique dans son sens moderne au biologiste Conrad H. Waddington qui la définit en 1942 comme une branche de la biologie étudiant les implications entre les systèmes gènes + environnement et leurs produits donnant naissance au phénotype d'un individu.
Il apparut d'abord que le « modèle génétique » postulant une équivalence unique entre phénotype et génotype, ne pouvait expliquer tous les phénomènes liés à la différenciation cellulaire (cf. citation de Morgan en introduction). Par exemple : le noyau d'une cellule de peau d'amphibien transféré dans un œuf énucléé donne des animaux entiers (clones) ; un même génome peut donc avoir plusieurs destinées et sa détermination est réversible. Il fut alors élaboré une théorie dans laquelle chaque cellule indifférenciée passait par un état critique qui serait responsable de son développement futur non uniquement lié à ses gènes (et pour cette raison qualifié d'épigénétique). Avec la découverte de la double-hélice, cette théorie a été mise à l'écart jusque dans les années 90, durant lesquelles le séquençage complet de plusieurs génomes et l'incapacité de les déchiffrer remirent sur le devant de la scène l'épigénétique. L'épigénétique, ainsi redéfinie, se veut un prolongement de la génétique classique.
L'épigénome
L’épigénome est l'état épigénétique de la cellule. À l'image des cellules embryonnaires qui peuvent avoir plusieurs fonctions finales, un unique génome peut être modifié de multiples manières pour donner des épigénomes différents. Il est actuellement conjecturé par un grand nombre de chercheurs en épigénétique qu'un code épigénétique existe dans chaque cellule eucaryote - par analogie au code génétique. À l'extrême, ce code épigénétique représente le type et la position de chaque molécule de la cellule.
Processus de transmission épigénétique
Plusieurs processus de transmission épigénétique peuvent jouer un rôle dans ce qu'on appelle quelquefois la mémoire de la cellule.
Transcription d'ARN
Ce mécanisme est en quelque sorte une autoactivation du gène. En effet, après transcription du gène en ARN, on observe un entretien de l'activation de ce même gène ou d'autres afférents. Par exemple, chez l'homme HNF4 et MyoD augmentent leur propre transcription. Même si le stimulus à l'origine de l'activation d'un gène est absent, les cellules filles peuvent hériter de cette activation chez la cellule mère. Le plus souvent l'activation d'un gène se produit par transduction, mais il est possible que l'ARN se transmette aux autres cellules par simple diffusion.
Système de transmission structurelle
La transmission structurelle est un mécanisme encore très mystérieux. Il implique la transmission entre cellules (voire entre cellules de générations différentes) de structures particulières (par exemple de protéines). Ces structures modifiées semblent jouer le rôle de "patron" pour l'organisation structurelle de génération suivante. Ce mécanisme de transmission a été mis en évidence dans les organismes unicellulaires ciliés comme la tetrahymena ou la paramécie. En effet, pour des cellules semblables au niveau génétique, on peut observer des différences dans l'organisation des cils de surface. Cette organisation est transmissible à la génération suivante. On soupçonne une telle transmission d'être possible pour les organismes multicellulaires.
Les modifications de la chromatine
Puisque le phénotype d'une cellule ou d'un individu est affecté par l'expression de ses gènes, les états issus de ces transcriptions peuvent donner lieux à des traces épigénétiques. Une des manières dont l'expression d'un gène peut être régulée est l'état de la chromatine. Celle-ci est soit décondensée ou "ouverte" (euchromatine) permettant ainsi l'accès à la machinerie transcriptionnelle et l'expression génique soit condensée ou "fermée" (hétérochromatine), empêchant l'expression d'un gène. L'état de la chromatine est dicté par les modifications post-traductionnelles des protéines histones liées à l'ADN. La méthylation de ces protéines au niveau de résidus lysines entraîne une fermeture de la chromatine. Au contraire, l'acétylation également de lysines entraîne une ouverture de la chromatine permettant ainsi la transcription. Certaines régions du génome sont constitutivement dans un état chromatinien fermé. C'est le cas des centromères et des télomères. Puisque l'ADN n'est pas entièrement entouré de nucléosomes au cours de la réplication, les histones modifiées (méthylées ou acétylées) restantes sont supposées guider les modifications des nouvelles histones après la formation des nucléosomes. On peut noter cependant que les modifications d'histones ne sont pas toutes transmises d'une génération à l'autre.
Modification chimique de l'ADN
L'expression d'un gène peut également être guidée par une modification chimique de l'ADN : la méthylation de cytosine en 5-methylcytosine[5] dans les dimères C-G de l'ADN. Le nombre et la façon dont sont méthylées ces bases influencent souvent l'expression des gènes composés de ces bases : une faible méthylation se traduit le plus souvent par une forte expression du gène alors qu'un haut niveau de méthylation inactive le gène. Cependant il existe des exemples où une forte méthylation n'a pas de répercussions sur le niveau d'expression. La méthylation de l'ADN est l'acteur majeur de la mise en place de l'empreinte parentale, mécanisme par lequel l'expression d'un gène va dépendre de l'origine parentale. Par exemple, dans le cas d'un gène à expression maternelle, l'allèle paternel est méthylé et entièrement éteint alors que l'allèle maternel est non-méthylé et entièrement exprimé. L'empreinte parentale dépend également des modifications de la chromatine. La méthylation de l'ADN est souvent observée dans les gènes répétés et pourrait être un mécanisme naturel pour l'inactivation des gènes inutiles. Les méthylations de l'ADN peuvent soit être héritées soit créées ou modifiées en réponse à un facteur environnemental. Dans ce dernier cas, la modification créée par l'environnement sera transmise aux descendants au même titre qu'une marque héritée.
Chez l’Homme, la méthylation de l’ADN s’effectue au niveau des résidus cytosines des îlots CpG[6] qui se trouvent essentiellement dans les régions proximales des promoteurs de 60 % des gènes. Dans les cellules normales, ces îlots sont non méthylés, une petite portion devient méthylée pendant le développement rendant ainsi quelques gènes silencieux de manière stable.
Il existe une interdépendance entre la méthylation de l’ADN et celle des histones : on a montré une interaction entre certaines protéines à activité de méthylation de l’ADN et un système de méthylation des histones. Nous sommes donc en présence d’un lien direct entre les activités enzymatiques responsables de deux mécanismes épigénétiques distincts. L’épigénétique est donc un système régulateur fondamental au-delà de l’information contenue dans la séquence d'ADN. Le gène défini par Mendel doit maintenant être considéré avec la chromatine qui l’entoure puisqu’elle joue un rôle primordial dans la régulation transcriptionnelle et que, de plus, elle est héréditaire tout comme les gènes Mendéliens.
Prions
Les maladies infectieuses ne sont pas habituellement décrites comme des régulateurs épigénétiques, mais l'infection et la transmission verticale de virus fonctionnent de manière identique. De plus, certains prions ont montré des effets[7] bénéfiques et, comme ils décrivent la nature adaptative des protéines, ils ont été décrits comme des mécanismes de transmission épigénétique.
Codage épigénétique et évolution
L'épigénétique peut être interprétée comme une réminiscence de la transmission des caractères acquis admise depuis Aristote jusqu'à Weismann en passant par Darwin, qui, contrairement à Lamarck et à l'opposé de ce que l'on croit généralement, en fit la théorie avec son "hypothèse de la pangénèse"[8] ou à celles de Mitchourine). Mais contrairement à ces anciennes théories, l'épigénétique admet la prééminence de la sélection naturelle et de l'altération aléatoire du génome[réf. nécessaire].
Effets épigénétiques possibles sur l'être humain
Sans avoir identifié les porteurs de ces modifications transmissibles, des études sur les humains (étude du poids des nouveau-nés lors de la famine aux Pays-Bas en 1947[9], ainsi que chez leurs descendants), les drosophiles (larves soumises à des températures élevées)[10] ont montré l'influence de l'environnement sur la diversité du vivant.
Une étude faite sur une population dont étaient référencés tous les individus ainsi que leur alimentation en fonction des récoltes a montré qu'une grand-mère ayant vécu une famine transmet cette information à sa descendance et par conséquent modifie l'ADN de son petit-fils, qui peut développer des maladies alors qu'il n'a jamais connu de famine[11].
De même, les femmes enceintes durant les événements du 11 septembre 2001 ont montré que l'enfant possédait un taux de cortisol plus élevé[12].
Ce phénomène impliquerait que certaines maladies ne sont pas dues à une variation de la séquence d’ADN mais peut-être à des épimutations. Les mécanismes épigénétiques constitueraient de nouvelles cibles pour la mise au point de médicaments spécifiques. En attendant cette confirmation, nous pouvons déjà reconsidérer notre hérédité et défendre l’idée que nous ne sommes pas que le pur produit de nos gènes.
L'épigénétique et le cancer
Le cancer est clairement une maladie des gènes. Chez l’Homme, l’incidence des cancers augmente exponentiellement dans les dernières décennies de la vie, avec un développement prédominant de carcinomes. Les cellules humaines en culture présentent un taux de mutations spontanées de 2.10 − 7 mutation/gène/division cellulaire. Étant donné la faible incidence spontanée de ces mutations, d’autres mécanismes doivent être mis en place pour entraîner l’apparition des cancers.
Plusieurs types de cancers sont associés à une réduction globale du taux de méthyl-cytosines dans le génome par rapport au tissu normal, alors que plusieurs gènes suppresseurs de tumeurs sont rendus silencieux par méthylation de novo de leur promoteur.
Des tumeurs peuvent maintenir stablement une mutation sur un allèle de gène alors que l'autre est hyperméthylé, et ainsi inactivé.
De plus, les gènes suppresseurs de tumeurs résident souvent au sein de régions caractérisées par des délétions fréquentes, aboutissant à une perte d’hétérozygotie (LOH).
Enfin, dans certaines de ces régions sont observés des événements épigénétiques au lieu d’une altération génétique.
Ces altérations épigénétiques, telles que méthylation de l’ADN et modifications des histones, semblent initier des processus qui résultent en une perte ou une activation de la transcription des gènes. Même une mutation peut être initialement due à un mécanisme épigénétique puisque, par exemple, une 5-méthyl-cytosine peut se désaminer (perte de la fonction amine) spontanément en thymine (autre base de l’ADN). Dans ce cas la cause primaire est un phénomène épigénétique. On espère donc un jour pouvoir traiter certains cancers par des médicaments ciblant les modifications épigénétiques (moins fixes que les modifications génétiques, et parfois réversibles).Le terme d'épigénétique en psychologie
Le psychologue Erik Erikson développa une « théorie épigénétique du développement humain » traitant des crises psycho-sociales vécues par l'individu, servant ainsi à décrire différentes étapes développementales entrecoupées par ces crises. Selon lui, même si ces crises ont le plus souvent une origine génétique, la manière dont elles se vivent ne peut être expliquée par la génétique et donc, en écho à la théorie en biologie, sont qualifiées d'épigénétiques.
Thérapeutique
Thérapies épigénétiques
Il existe aujourd’hui peu de thérapeutiques agissant directement sur l'épigénome. Plusieurs sont en cours d’études dans des essais cliniques ou ont été approuvées pour des types spécifiques de cancer.
Les analogues nucléosides comme la 5-azacytidine sont incorporés dans l’ADN en réplication. Ils inhibent ainsi la méthylation de l'ADN et réactivent des gènes silencieux. La 5-azacitidine a montré une efficacité dans des essais cliniques de phase 1 dans le traitement de syndromes myélodysplasiques et de leucémies, sièges d’une hyperméthylation génique.
Thérapies indirectement épigénétiques
Une intervention indirecte sur l'épigénome consiste à moduler la disponibilité des groupements méthyles. Pour ce faire, il est possible
- de faire varier les concentrations de cofacteurs transportant les groupes méthyles (plus couramment la cobalamine (vitamine B12) et l'acide folique[13],[14], mais aussi la choline et la triméthylglycine, une bétaïne) ou
- d'intervenir sur les xénobiotiques et les autres facteurs reconnus pour avoir un impact sur la méthylation. Ces traitements sont le plus souvent préventifs,
- de contrer le stress oxydatif, reconnu pour son impact négatif sur l'épigénome.
- de réduire les concentrations d'homocystéine,
- de moduler la disponibilité des groupes méthyles en intervenant sur leur incorporation dans les accepteurs de groupes méthyles autres que l'ADN, notamment les phospholipides des membranes cellulaires[15],[16].
Il a été proposé que la vitamine B12, l'acide folique, l'ADH, ainsi que le stress oxydatif avaient un rôle à jouer, via des modifications épigénétiques, dans les altérations dans la neurogenèse observées chez les enfants prématurés[16].
Notes et références
- Référence
- MJ. Essex, « Epigenetic Vestiges of Early Developmental Adversity: Childhood Stress Exposure and DNA Methylation in Adolescence. », dans Child Dev, septembre 2011 [lien DOI]
- Thomas Jenuwein (Research institute of molecular pathology, Vienne, Autriche)
- La transvection est le résultat d'une interaction entre un allèle sur un chromosome et l'allèle sur l'autre chromosome de la même paire
- (en) 5-Methylcytosine
- (en) îlots CpG, site CpG
- Exemple : Inhibition épigénétique relative de la réplication du prion par la biosynthèse in situ de l'hypodermine du Hypoderme (insecte)
- Darwin a exposé son hypothèse de la pangénèse en 1868 dans "De la variation des animaux et des plantes sous l'action de la domestication", cette hypothèse n'a pas été confirmée par l'observation. Voir (en) Pangenesis, voir De la variation des animaux et des plantes sous l'action de la domestication
- Épigénétique Arte, 09/04/2009 à 18:15 (Allemagne, Canada, Japon, 2008, 43 min) ZDF Réalisateur : Frank Papenbroock, Peter Moers
- Rapport d'activité de l'unité Biologie Cellulaire du Noyau, [PDF] Yves Combarnous, Les HORMONES
- Il s'agit des travaux menés par Le généticien clinique Marcus Pembrey (institut de la santé infantile, University college de Londres) et Lars Olov Bygren (Université d'Umea, Suède). Voir l'article d'Hervé Morin paru dans le Monde « Une étude suédoise questionne le darwinisme » 28/12/2002
- Selon des recherches de Gerard Essed et Rachel Yehuda, voir respectivement Le stress rend les nouveau-nés plus petits et Après le choc
- Ciappio ED, Liu Z, Brooks RS, Mason JB, Bronson RT, Crott JW, « Maternal B vitamin supplementation from preconception through weaning suppresses intestinal tumorigenesis in Apc1638N mouse offspring. », dans Gut, 2011 [texte intégral, lien PMID, lien DOI]
- McKay JA, Wong YK, Relton CL, Ford D, Mathers JC, « Maternal folate supply and sex influence gene-specific DNA methylation in the fetal gut. », dans Mol Nutr Food Res, 2011 [lien PMID, lien DOI]
- La disponibilité de l'acide gras oméga-3 ADH conditionne à son tour les concentrations des divers phospholipides
- Dhobale M, Joshi S, « Altered maternal micronutrients (folic acid, vitamin B(12)) and omega 3 fatty acids through oxidative stress may reduce neurotrophic factors in preterm pregnancy. », dans J Matern Fetal Neonatal Med, 2011 [lien PMID, lien DOI]
Voir aussi
Articles connexes
Liens externes
- Quand l’environnement module l’expression des gènes
- (en) Documentaire NOVA: ¨The Ghost in your genes¨
Bibliographie
- Andras Paldi, L’épigénétique est-elle lamarckienne ?, conférence à l'Ecole Normale Supérieure du 29 juin 2009.
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.