- Électropositivité
-
Électronégativité
Le concept d’électronégativité a été introduit pour la première fois par Berzelius en 1835. Par la suite, Pauling a amélioré ce concept et a déduit que l’électronégativité repose plutôt sur l’existence des liaisons ioniques et covalentes, contrairement à ce que Berzelius avait trouvé auparavant.[1]
En chimie, l'électronégativité d'un élément est une grandeur qui caractérise sa capacité à attirer les électrons lors de la formation d'une liaison chimique avec un autre élément (À titre d'exemple, le fluor est l'élément le plus électronégatif tandis que le francium est le moins électronégatif). La différence d'électronégativité entre ces deux éléments détermine la nature de la liaison chimique : covalente lorsque la différence est faible (inférieure à 1,7), ionique lorsque cette différence est plus importante.
- Les gaz inertes n'ont pas d'électronégativité
- Plus un atome est petit, plus son électronégativité est grande
L'électronégativité est notée χX où X est le symbole de l'élément considéré. Plus χX est grand et plus l'élément est susceptible d'attirer des électrons en lui.
Pour calculer les écarts d’électronégativité des éléments, l’échelle de Pauling est généralement la plus utilisée. Dans le tableau périodique, l’électronégativité augmente de gauche à droite le long d’une période et de bas en haut le long d’une famille. Par exemple, le fluor est l’élément le plus électronégatif de tout le tableau périodique avec une valeur de 4,0. Les différences d’électronégativité permettent de d’identifier les liaisons covalentes non polaire, les liaison covalentes polaires et les liaisons de coordinence (ou coordination). L’électronégativité permet d’identifier les charges partielles des atomes d’une molécule donnée. Les symboles δ+ et δ- représentent respectivement les charges partielles positives et négatives d’une liaison dont l'atome le plus électronégatif porte la charge partielle négative.
Il y a trois types de liaisons covalentes. Le premier type est la liaison covalente non polaire (différence d’électronégativité, ΔΕn ≤ 0,4) qui possède un nuage électronique relativement symétrique. Dans ce cas, l’attraction des électrons vers les noyaux des deux atomes en question est égale. Le deuxième type est la liaison covalente polaire (0,4 < ΔΕn < 1,7). Une molécule est polaire si elle possède un moment dipolaire. Un moment dipolaire est une représentation vectorielle de la répartition des charges partielles sur une distance donnée. Cette liaison possède une distribution de charges inégales entre les deux atomes qui la forment en raison de la différence d’électronégativité de ses atomes. Le moment dipolaire est représenté par un vecteur dont la flèche part de l’atome le moins électronégatif vers l’atome le plus électronégatif. Les symboles δ+ et δ- représentent respectivement les charges partielles positives et négatives de la liaison dont l'atome le plus électronégatif porte la charge partielle négative. Il y a donc une attraction inégale des électrons vers les noyaux des deux atomes. Dans ce type de liaison, le nuage électronique n’est pas symétrique comme le premier type de liaison. Le dernier type de liaison covalente est celui de coordinence. Dans ce type de liaison covalente, il y a un partage d’électrons entre deux atomes, par contre le doublet d’électrons formant la liaison provient d’un seul des deux atomes. Autrement dit, les deux électrons partagés viennent du même atome.
Sommaire
Définitions
Il existe plusieurs définitions de l'électronégativité (Pauling, Mulliken, Parr, Allred et Rochow) ce qui a conduit à construire plusieurs échelles.
- Définition de Pauling : la différence d'électronégativité entre les éléments A et B a pour expression
ΔχAB = 0,102 * ((EAB − (EAA + EBB)1 / 2)1 / 2 où EAB,EAA et EBB sont les énergies de liaison des molécules diatomiques A-B, A-A et B-B.
Cette définition ne donne que la différence entre deux électronégativités. On a donc besoin d'une origine qui a été fixée arbitrairement en donnant la valeur de 4 à l'électronégativité du fluor (élément le plus électronégatif de la classification).
- Définition de Mulliken : l'électronégativité d'un élément est la moyenne de son affinité électronique Ae et de son énergie d'ionisation EI
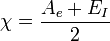
- Définition d'Allred et Rochow : l'électronégativité d'un élément a pour expression
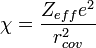
où Zeff est la charge effective du noyau,e la charge élémentaire et rcov le rayon covalent de l'élément
- Définition de Parr: l'électronégativité est l'opposée de la dérivée de l'énergie de l'atome par rapport au nombre d'électrons
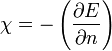
Les échelles d'électronégativité les plus utilisées sont l'échelle de Mulliken, l'échelle d'Allred-Rochow et l'échelle de Pauling.
Les électronégativités des atomes impliqués dans une liaison tendent à être égales (principe d'égalisation des électronégativités de Sanderson, 1951). L'égalisation des électronégativités est réalisée par le transfert de densité électronique vers l'atome le plus électronégatif.
L'électronégativité permet d'estimer le caractère ionique d'une liaison à l'aide de la relation de Pauling
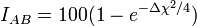
ou de celle de Haney et Smith
IAB = 16Δχ + 3.5Δχ2 L'électronégativité est également la notion à l'origine de la polarité de certaines molécules. En effet, dans une molécule, lorsque les atomes de part et d'autre de la liaison covalente ont des électronégativités différentes, l'atome le plus électronégatif attire davantage les électrons. Le barycentre des charges positives n'est donc pas confondu avec le barycentre des charges négatives. La molécule reste globalement neutre mais un champ électrique apparaît au sein de celle-ci, on dit que la liaison est polarisée ou que la molécule est polaire.
Les éléments dont l'électronégativité est faible sont fréquemment dits électropositifs.
Tableau
→ Rayon atomique décroît → Énergie d'ionisation s'accroît → Électronégativité s'accroît → Groupe (vertical) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Période (horizontal) 1 H
2,20He
2 Li
0,98Be
1,57B
2,04C
2,55N
3,04O
3,44F
3,98Ne
3 Na
0,93Mg
1,31Al
1,61Si
1,90P
2,19S
2,58Cl
3,16Ar
4 K
0,82Ca
1,00Sc
1,36Ti
1,54V
1,63Cr
1,66Mn
1,55Fe
1,83Co
1,88Ni
1,91Cu
1,90Zn
1,65Ga
1,81Ge
2,01As
2,18Se
2,55Br
2,96Kr
3,005 Rb
0,82Sr
0,95Y
1,22Zr
1,33Nb
1,6Mo
2,16Tc
1,9Ru
2,2Rh
2,28Pd
2,20Ag
1,93Cd
1,69In
1,78Sn
1,96Sb
2,05Te
2,1I
2,66Xe
2,66 Cs
0,79Ba
0,89*
Hf
1,3Ta
1,5W
2,36Re
1,9Os
2,2Ir
2,20Pt
2,28Au
2,54Hg
2,00Tl
1,62Pb
2,33Bi
2,02Po
2,0At
2,2Rn
7 Fr
0,7Ra
0,9**
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
Uub
Uut
Uuq
Uup
Uuh
Uus
Uuo
Lanthanides *
La
1,1Ce
1,12Pr
1,13Nd
1,14Pm
1,13Sm
1,17Eu
1,2Gd
1,2Tb
1,1Dy
1,22Ho
1,23Er
1,24Tm
1,25Yb
1,1Lu
1,27Actinides **
Ac
1,1Th
1,3Pa
1,5U
1,38Np
1,36Pu
1,28Am
1,13Cm
1,28Bk
1,3Cf
1,3Es
1,3Fm
1,3Md
1,3No
1,3Lr
1,3Tableau périodique des éléments utilisant l'échelle d'électronégativité de Pauling Notes et références
BALOU, D. FABRITIUS, E. GILLES, A. Toute la chimie, Ellipses Edition Marketing S.A., 2004, p.201-203 CHANG, R. PAPILLON, L. Chimie Fondamentale, Principes et problèmes, Les Editions de la Chandelière Inc., 1998, p.275-278 L. DEKOCK, R. B.GRAY, H. Chemical structure and Bonding, Copyright, 1980, p.90-92 S.ZUMDAHL, S. Chimie générale 2e édition, Les Editions CEC Inc., 1998, p.243-249 S.ZUMDAHL, S. Chimie générale 2e édition, Les Editions CEC Inc., 1998, p.245-247 S.ZUMDAHL, S. Chimie générale 2e édition, Les Editions CEC Inc., 1998, p.240
Liens externes
- Portail de la chimie
Catégorie : Propriété chimique
Wikimedia Foundation. 2010.
