- Sérotonine
-
Sérotonine 

Général Nom IUPAC 3-(2-aminoéthyl)-1H-indol-5-ol No CAS No EINECS PubChem SMILES InChI Propriétés chimiques Formule brute C10H12N2O [Isomères] Masse molaire[2] 176,2151 ± 0,0095 g·mol-1
C 68,16 %, H 6,86 %, N 15,9 %, O 9,08 %,pKa 9.97 (25 °C)[1] Propriétés physiques T° fusion 167,5 °C[1] Solubilité 20 g·l-1 (eau, 27 °C)[1] Précautions Directive 67/548/EEC 
XnPhrases R : 20/21/22, 36/37/38, Phrases S : 26, Écotoxicologie DL50 60 mg·kg-1 (souris, oral)
81 mg·kg-1 (souris, i.v.)
601 mg·kg-1 (souris, s.c.)
160 mg·kg-1 (souris, i.p.)[1]Unités du SI & CNTP, sauf indication contraire. La sérotonine, encore appelée 5-hydroxytryptamine (5-HT), est une monoamine, servant de neurotransmetteur dans le système nerveux central. Elle est majoritairement présente dans l’organisme en qualité d’hormone locale (ou autacoïde). Sa part dans le cerveau où elle joue le rôle de neurotransmetteur ne représente que 1 % du total du corps[3]. Tout comme l’adrénaline, la noradrénaline et l’histamine, elle joue donc un double rôle d’hormone et de neuromédiateur du système nerveux central.
Sommaire
Histoire
La sérotonine a d’abord été identifiée en 1946, sous le nom de entéramine'[4], par le pharmacologue italien Vittorio Erspamer (1909-1999) dans les cellules entérochromaffines du tube digestif[5]. À peu près à la même époque à Cleveland, Maurice M. Rapport qui s’intéressait aux substances hypertensives du sang, isola (en 1948) une substance vasoconstrictive qui apparaissait au moment de la coagulation du sang[6]. Il la dénomma sérotonine. L’année suivante, il l’analysa comme la 5-hydroxytryptamine. Erspamer identifia peu après l’entéramine au 5-hydroxytryptamine.
La présence de sérotonine dans le système nerveux central fut ensuite caractérisée par B. M. Twarog et I. H. Page (Am J Physiol, 1953 175:157-161), peu après que Gaddum eut montré que le LSD (diéthylamide de l’acide lysergique), un puissant psychotrope hallucinogène, se comportait comme un antagoniste de la sérotonine dans les tissus périphériques.
Localisation
La sérotonine a été identifiée dans la muqueuse gastro-intestinale, dans les plaquettes sanguines et dans le système nerveux central[4].
La sérotonine présente dans la muqueuse gastro-intestinale représente environ 80 % de la sérotonine totale de l’organisme. Elle est synthétisée et stockée au niveau des cellules chromaffines. Celles-ci stockent aussi des médiateurs peptidiques (cholécystokinine, neurotensine, peptide PYY). La libération de sérotonine par exocytose joue un rôle dans la motilité intestinale.
Une partie de la sérotonine du tube digestif passe dans le sang où elle est stockée dans les plaquettes sanguines. La sérotonine n’y est pas synthétisée car elle est produite seulement dans les cellules chromaffines et les neurones sérotoninergiques. Dans la première étape de la coagulation sanguine, lorsque les plaquettes s’agrègent entre elles, elles libèrent leur sérotonine qui, via les récepteurs 5-HT1 des muscles lisses vasculaires, provoque une vasoconstriction. L’effet global vasculaire est hypertenseur.
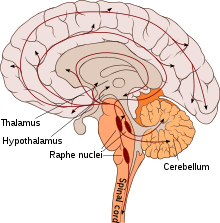
Dans le système nerveux central, le corps cellulaire des neurones sérotoninergiques sont localisés dans les noyaux du raphé du tronc cérébral d’où ils se projettent dans l’ensemble du cerveau et de la moelle épinière. On peut dire[7] que d’une manière générale,
- les neurones sérotoninergiques du mésencéphale se projettent rostralement[8] dans les hémisphères cérébraux
- ceux du pont se ramifient dans le tronc cérébral et le cervelet
- et ceux de la moelle allongée vont à la moelle épinière.Les effets de la sérotonine sur les autres neurones peuvent être excitateurs ou inhibiteurs suivant la nature des récepteurs.
Métabolisme
La biosynthèse de la sérotonine est réalisée dans les neurones ou les cellules entérochromaffines.
Elle est fabriquée à partir du tryptophane (Trp), un acide aminé qui est apporté au cerveau par la circulation sanguine entre autres. Le tryptophane est absorbé par les neurones grâce à un transporteur membranaire non sélectif.
Certains neurones du noyau du raphé, situé au sein du tronc cérébral, transforment le tryptophane en 5-hydroxytryptophane (5-HTP) grâce à une enzyme, la tryptophane hydroxylase. L’activité du tryptophane hydroxylase dépend essentiellement de la disponibilité en substrat.
Le 5-hydroxytryptophane est ensuite converti en sérotonine (5-HT) par une autre enzyme, une décarboxylase, la 5-hydroxytryptophane décarboxylase (L-amino acid décarboxylase, AADC). Cette enzyme n’est pas sélective car elle assure aussi la décarboxylation de la L-dopa. La sérotonine synthétisée dans le cytoplasme est ensuite stockée dans les granules par l’intermédiaire de transporteurs vésiculaires, nommés VAMT-1 et -2, communs aux diverses monoamines.
L’arrivée d’un potentiel d’action à la terminaison synaptique, provoque la libération de la sérotonine par exocytose, dans la fente synaptique. Elle peut alors suivre trois voies :
- être captée par des récepteurs sérotoninergiques postsynaptiques et assurer la transduction du signal neuronal ;
- être recaptée par des récepteurs sérotoninergiques présynaptiques ;
- être recaptée par des neurones (ou des plaquettes) par l’intermédiaire d’un transporteur membranaire sélectif SERT ;
- être dégradée par la monoamine oxydase MAO
La MAO dégrade aussi les catécholamines.L’aldéhyde formée est ensuite oxydé en acide 5-hydroxy-indol-acétique (5-HIAA), éliminé par voie urinaire, grâce à l’aldéhyde déshydrogénase.
Les récepteurs sérotoninergiques
Les neurones du raphé dorsal sont connectés à la plupart des régions du système nerveux central (cerveau, tronc cérébral, moelle épinière). La sérotonine est libérée dans des synapses et se lie à des récepteurs localisés sur la membrane de l’élément post-synaptique. Par l’intermédiaire de leurs axones, les neurones du noyau du raphé libèrent la sérotonine sur d’autres neurones du système nerveux central et, en se liant à des récepteurs spécifiques, modulent leurs propriétés électriques.
La sérotonine agit en se liant à des récepteurs spécifiques situés dans la membrane des cellules cibles. On connaît au moins 14 gènes codant ces récepteurs sérotoninergiques 5-HT, capables de donner (par épissage alternatif) au moins 30 protéines réceptrices différentes[9].
Les différents types de récepteurs ont été répartis conventionnellement en sept groupes différents, notés 5-HT1 à 5-HT7, en fonction des analogies de structure des gènes.
On peut aussi distinguer :
- les récepteurs ionotropes : les récepteurs 5-HT3 sont des récepteurs canaux à perméabilité cationique. Leur stimulation provoque une entrée d’ion sodium Na+ et calcium Ca+ qui diminuent rapidement la charge négative intracellulaire (soit une dépolarisation) du neurone postsynaptique et déclenche un potentiel d’action postsynaptique excitateur (PPSE). Ils sont donc excitateurs.
5-HT3 → entrée de Na+ et Ca++ → dépolarisation → potentiel d’action PPSE - Ces récepteurs 5-HT3 sont situés sur l’extrémité des fibres sensitives extrinsèques vagales et splanchniques. Leur stimulation envoie un signal par la moelle épinière jusqu’au centre de contrôle du vomissement qui induit une sensation de nausée et provoque le vomissement. Les antagonistes sélectifs du récepteur 5-HT3 de la famille des sétrons sont utilisés pour combattre les nausées et vomissements postopératoires ou ceux induits par les traitements anticancéreux.
- les récepteurs couplés aux protéines G : les récepteurs 5-HT1, 2, 4, 5, 6 sont tous heptahélicoïdaux (protéine à sept hélices transmembranaires) couplés aux protéines G. Ces récepteurs modulent l’activité neuronale en augmentant ou diminuant les potentiels d’action postsynaptiques.
La famille des récepteurs 5-HT1 comporte cinq membres, nommés 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F. Ils ont pu être identifiés grâce la spiperone, une molécule à haute affinité pour les récepteurs 5-HT1A et faible affinité pour 5-HT1D.
La fixation de la sérotonine sur un récepteur 5-HT1A (ou 5-HT1B) provoque une modification de sa configuration spatiale, ce qui active la protéine Gi à laquelle il est couplé. Il s’en suit une cascade de réactions[4] :
5-HT1A → Gi → AC inhibé → cAMP ↓ → PKA inactive → sortie de K+ → hyperpolarisation → PA ↓ L’inhibition de l’adénylate cyclase (AC) entraîne une diminution d’AMP cyclique et une inactivation de la protéine kinase A (PKA). Celle-ci permet une augmentation de l’ouverture d’un canal potassique et une sortie importante d’ions K+ de la cellule provoquant une augmentation de la charge négative intracellulaire. Au final, le neurone portant le récepteur se retrouve hyperpolarisé, ce qui entrave la propagation de l’influx nerveux (PA ↓). La sérotonine en activant ces récepteurs 5-HT1A joue ainsi un rôle inhibiteur.
Les corps cellulaires et les dendrites des neurones sérotoninergiques, situés dans les noyaux du raphé, l’hippocampe, l’amygdale et les noyaux de la base, expriment en quantité importante des autorécepteurs 5-HT1A et des canaux potassiques. Plus il y aura de sérotonine émise par le neurone, plus il y en aura de recaptée par les autorécepteurs pour freiner toute nouvelle libération. On a donc un mécanisme de rétroaction négative.
Les récepteurs 5-HT1A sont aussi largement distribués dans le système limbique où ils sont la cible privilégiée de nombreux anxiolytiques et antidépresseurs. Les récepteurs 5-HT1B et 5-HT1D sont surtout présents au niveau présynaptique dans les ganglions de la base où ils forment une boucle de rétroaction négative.
Les récepteurs 5-HT2 n’ayant qu’une affinité modérée pour la sérotonine ne sont stimulés que lorsque les récepteurs 5-HT1 sont saturés. Les récepteurs 5-HT2B/C, couplés à une protéine Gq, entraînent une production de monoxyde d’azote NO et une relaxation des muscles lisses et donc une vasodilatation.
Par contre, la stimulation des récepteurs 5-HT4, 5-HT6, 5-HT7, entraine à une augmentation de l’activité de l’adénylate cyclase (AC) et la cascade réactionnelle :
5-HT4 → Gs → AC → cAMP ↑ → PKA activée → blocage des sorties de K+ → dépolarisation → PA ↑ La diminution de la conductance potassique produit une lente dépolarisation susceptible d’amplifier le potentiel d’action (PA).
Les récepteurs 5-HT4 sont exprimés (avec les récepteurs 5-HT3) dans le tractus intestinal où ils contrôlent le péristaltisme du tube digestif. Dans cerveau, on en trouve en position présynaptique dans le striatum où ils exercent un effet facilitateur sur la libération de l’acétylcholine et ainsi de renforcement des performances cognitives.
Rôles physiologiques de la sérotonine
On trouve la sérotonine dans le cerveau (où elle joue le rôle de neurotransmetteur ou de neuromédiateur) et dans le système digestif. Elle est impliquée dans la régulation de fonctions telles que la thermorégulation, les comportements alimentaires et sexuels, le cycle veille-sommeil, la douleur, l’anxiété ou le contrôle moteur. Plus récemment[Quand ?], des chercheurs du CNRS ont découvert que la sérotonine de la mère jouait un rôle important dans le développement de l’embryon[10]. De même, selon une étude de 2006, un déséquilibre de sérotonine expliquerait 50 % des cas de mort subite du nourrisson[11].
L’activité des neurones du raphé est liée au cycle veille-sommeil. Au cours du sommeil, les neurones du raphé sont silencieux et ne libèrent donc pas de sérotonine. Lorsque le sujet est éveillé, les neurones du raphé produisent des potentiels d’action à intervalles très réguliers. La fréquence des influx nerveux est corrélée à l’activité motrice, ce qui suggère que la quantité de sérotonine libérée dans le système nerveux central est augmentée avec l’activité motrice.
Comme la sérotonine joue un rôle important dans les changements d’état émotionnel, on pense que certaines molécules analogues à la sérotonine peuvent modifier ces états émotionnels. Les inhibiteurs sélectifs de la recapture de la sérotonine (des substances qui bloquent la recapture de la sérotonine, par exemple la fluoxétine), sont utilisés en médecine pour soigner les symptômes liés à la dépression ou aux troubles obsessionnels compulsifs.
- Douleur et sérotonine
La sérotonine est impliquée aux divers niveaux des voies de transmission et de contrôle de la douleur.
- Action périphérique : l’inflammation consécutive à une lésion tissulaire, libère un grand nombre de médiateurs qui vont activer les terminaisons des fibres afférentes primaires (FAP) de type C et Aδ (dont les corps cellulaires sont situés dans les ganglions des racines dorsales) chargés de transmettre l’information nociceptive au cerveau par la voie spino-thalamique. Les terminaisons de ces FAP nociceptives comportent une large panoplie de récepteurs et canaux[12]. Les fibres C déchargent lorsque de la sérotonine se lie aux récepteurs ionotropes 5-HT3 qu’elles expriment. Ces terminaisons comportent aussi des récepteurs couplés à une protéine G, comme les récepteurs sérotoninergiques 5-HT2A et aussi à un moindre degré 5-HT1A, et des récepteurs aux autres molécules algogènes comme la bradykinine, de l’histamine, etc.
La sérotonine provient principalement des plaquettes sanguines mais aussi des mastocytes, lymphocytes et macrophages. Elle permet (via ces récepteurs couplés à une protéine G) une sensibilisation[13] des nocicepteurs aux substances algogènes comme la bradykinine, l’ATP ou les ions H+ qui génèrent l’influx dans les FAP. Quand les fibres C sont elles mêmes lésées, leur contenu en sérotonine augmente et provoque une forte activation et sensibilisation pouvant expliquer l’hypersensibilisation périphérique des douleurs neuropathiques.
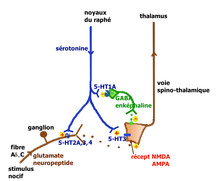
- Action au niveau de la moelle épinière : Le premier relais de la transmission des informations nociceptives se trouve dans la corne dorsale de la moelle épinière. Le premier neurone des fibres Aδ ou C libère dans l’espace synaptique de ce relais des neurotransmetteurs excitateurs (glutamate, aspartate) et des neuropeptides (substance P, neurokinine A, CGRP, somatostatine, CCK et VIP). Le deuxième neurone qui croise la ligne médiane et monte vers le deuxième relais situé dans le thalamus, capte ces médiateurs ainsi que de nombreux médiateurs d’origine diverses :
- . des peptides opioïdes (enképhaline, bêta-endorphine, dynorphine) émis par des interneurones inhibiteurs, eux-même stimulés par les neurones de la voie descendante du raphé magnus
- . la sérotonine émise par les neurones sérotoninergiques qui descendent des noyaux du raphé magnus
Les neurones du raphé magnus, à l’origine de la majorité des projections sérotoninergiques ont un rôle qui peut être pronociceptif ou antinociceptif suivant le contexte physiologique et pharmacologique (Millan[14] 2001). L’explication tient à la présence en des lieux différents de récepteurs sérotoninergiques différents pouvant activer ou ralentir l’activité neuronale. Millan propose les deux voies illustrées ci-contre.
Lors de stimulations nociceptives intenses, la voie rétro-active inhibitrice entraîne la suppression des messages nocicepteurs au niveau de la moelle. On peut observer chez le rat, que la stimulation électrique du raphé provoque la libération de la sérotonine au niveau médullaire avec inhibition des fibres C, stimulation des interneurones GABAergiques et enképhalinergiques bloquant complètement la transmission du message nocicepteur au niveau du deuxième neurone de la voie spino-thalamique.
La voie facilitatrice descendante serait principalement mise en jeu par la stimulation soutenue à la périphérie des fibres afférentes primaires se projetant dans la corne dorsale sur des cellules exprimant le récepteur NK1 de la substance P. Ces cellules activent par une voie indirecte les noyaux du raphé magnus[15]. La facilitation implique la présence des récepteurs 5-HT3 et 5-HT2A.
- Les hallucinogènes et la sérotonine
Les effets comportementaux d’hallucinogènes comme le LSD, la psilocybine, ou la mescaline sont liés à l’activation des récepteurs 5-HT2A. Toutefois, les récepteurs 5-HT1A et 5-HT2C et les récepteurs de la dopamine joueraient aussi un certain rôle.
Le LSD (diméthylamide de l’acide lysergique) est un puissant psychotrope, capable de provoquer des perturbations psychiques profondes accompagnées de distorsions visuelles et d’hallucinations[4] à dose de très faible (1 microgramme/kg). C’est un psychédélique classique, comme la psylocybine et la mescaline, caractérisés par le fait qu’ils ne sont pas toxiques et n’induisent pas de dépendance.
Les premières hypothèses sur la relation du LSD avec les récepteurs de la sérotonine datent des travaux de Gaddum (1953) au milieu du XXe siècle. Pourtant, le mécanisme précis d’action n’est toujours pas complètement établi. Le consensus actuel veut que l’ensemble des hallucinogènes stimule les récepteurs 5-HT2 et particulièrement le 5-HT2A. Un bon appui à cette hypothèse vient de nombreuses études faites sur les rongeurs et plusieurs études cliniques sur l’homme. Dans une étude sur trois groupes de sujets volontaires, Vollenweider et al.[16] (1998) ont montré que des antagonistes sélectifs des 5-HT2A (kétansérine, ritansérine) bloquaient les effets hallucinogènes de la psilocybine.
L’hypothèse que certaines perturbations psychiques induites par le LSD et la psilocybine sont proches de la schizophrénie a reçu de nouveaux soutiens ces dernières années. L’expérience a montré que les effets psychomimétiques de la psilocybine s’obtenait par une suractivation des récepteurs 5-HT2A. D’autre part, les patients schizophrènes ont une densité réduite de ces récepteurs dans le cortex préfrontal[17].
Augmenter la production de sérotonine
Alimentation
L’alimentation a un effet sur le taux de sérotonine. Cependant, la sérotonine ne traverse pas la barrière hémato-encéphalique[18], seul le tryptophane peut le faire. La banane, par exemple, bien qu’elle contienne de la sérotonine, n’a en revanche pas d’effet sur l’humeur lié à sa teneur en ce neurotransmetteur. La dinde n’a pas non plus d’effet sur l’humeur (pas, en tous cas, par ce mécanisme), contrairement à une idée répandue[18]. L’α-lactalbumine, contenue en faible quantités dans le lait, contient relativement plus de tryptophane que la plupart des protéines.
La production de sérotonine dans le cerveau varie directement en fonction du transport du tryptophane dans le cerveau (au travers de la barrière hémato-encéphalique). Le taux de transport est lui-même inversement proportionnel aux concentrations des autres grands acides aminés neutres (leucine, isoleucine, valine, tyrosine, phénylalanine) qui lui font compétition à l’entrée du cerveau. Les concentrations de ces derniers, enfin, varient en fonction de la proportion en glucides et en protéines consommées. C’est ainsi que la consommation de sucre ou de repas sucrés aura pour effet d’augmenter indirectement (et momentanément) les concentrations de tryptophane dans le cerveau, tandis qu’un aliment très protéiné (qui, paradoxalement, contient plus de tous les acides aminés, y compris le tryptophane), aura pour effet de diminuer les concentrations cérébrales de tryptophane et, probablement, de sérotonine[19].
L'humeur
La sérotonine serait liée à l’humeur dans les deux sens. C’est-à-dire que le taux de sérotonine influencerait l’humeur, et que les pensées positives ou négatives influenceraient à leur tour le taux de sérotonine[18].
L'activité physique
La pratique régulière d’un sport augmente la sécrétion naturelle de sérotonine[18].
Divers
L’exposition à la lumière du jour ou la luminothérapie évitent la transformation de la sérotonine en mélatonine[18].
Carences induites par les drogues et les médicaments
Il semblerait que l’ecstasy augmente fortement la production de sérotonine de façon temporaire, causant après coup une carence de l’ordre de 50 à 80 % du niveau normal de sérotonine chez un utilisateur régulier[20].
La consommation d’une formule contenant tous les acides aminés sauf le tryptophane amène à une rapide et brutale baisse de sérotonine dans le cerveau. Ce protocole, appelé Acute Tryptophan Depletion, est utilisé à des fins diagnostiques[18].
Notes et références
- (en) « Serotonin » sur ChemIDplus, consulté le 8 février 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) H P Rang, M M Dale, JM Ritter, RJ Flower, Rang and Dale’s Pharmacology, Churchill Livingstone Elsevier, 2007 (sixth edition), 830 p..
- Yves Landry, Jean-Pierre Gies, Pharmacologie Des cibles vers l’indication thérapeutique, Dunod, 2009 (2e édition).
- Erspamer, Archo Sci. Biol., 1946, 31, 86.
- [PDF].
- MJT FitzGerald, Jean Folan-Curran, Neuro-anatomie clinique et neurosciences connexes, Maloine, 2003.
- vers l’avant.
- (en) John R. Raymond, Yurii V. Mukhinb, Andrew Gelascoa, Justin Turner, Georgiann Collinsworth, Thomas W. Gettys, Jasjit S. Grewal, Maria N. Garnovskaya, « Multiplicity of mechanisms of serotonin receptor signal transduction », dans Pharmacology & Therapeutics, vol. 92, 2001, p. 179-212.
- Le développement cérébral du fœtus est sous la dépendance du génome maternel, Le Monde du 20 décembre 2006.
- (en) Hannah C. Kinney, Multiple Serotonergic Brainstem Abnormalities in Sudden Infant Death Syndrome, JAMA, 1er novembre 2006 ; 296: 2124 - 2132.
- (en) E.J. Nestler, S. E. Hyman, R.C. Malenka, Molecular Neuropharmacology: A Foundation for Clinical Neuroscience, McGraw-Hill Medical, 2008, 516 p..
- La sensibilisation résulte d’une baisse du seuil du nocicepteur et d’une augmentation de son activité.
- (en) Mark J. Millan, « Descending control of pain », dans Progress in neurobiology, vol. 66, 2002, p. 355-474.
- Karine Thibault, Etude comparative de trois modèles de douleurs neuropathiques chez le rat : étude comportementale, pharmacologique et analyse transcriptomique (thèse), Université Pierre et Marie Curie, 2009
- (en) Vollenweider, F. X., Vollenweider-Scherpenhuyzen, M. F., Babler, A., Vogel, H., & Hell, D., « Psilocybin induces schizophrenia-like psychosis in humans via a serotonin-2 agonist action », dans Neuroreport, vol. 9, 1998.
- (en) Mark A. Geyer et Franz X. Vollenweider, « Serotonin research: contributions to understanding psychoses », dans Trends in Pharmacological Sciences, vol. 29, no 9, 2008.
- (en) Simon N. Young - How to increase serotonin in the human brain without drugs - Revue de psychiatrie et de neuroscience - Université McGill.
- (en)(en) Wurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, Breu JJ, « Effects of normal meals rich in carbohydrates or proteins on plasma tryptophan and tyrosine ratios », dans Am. J. Clin. Nutr., vol. 77, no 1, janvier 2003, p. 128–32 [texte intégral, lien PMID]
- (en) Kish SJ, Furukawa Y, Ang L, Vorce SP, Kalasinsky KS - Striatal serotonin is depleted in brain of a human MDMA (Ecstasy) user - Human Neurochemical Pathology Laboratory, Centre for Addiction and Mental Health, Toronto, Canada.
Voir aussi
Liens externes
Wikimedia Foundation. 2010.