- Pyruvate déshydrogénase
-
Pyruvate déshydrogénase (E1) ![Modélisation d'un tétramère de PDHE1avec la TPP en rose[1] (PDB 1NI4).](/pictures/frwiki/50/220px-PDHE1_1NI4.png)
Modélisation d'un tétramère de PDHE1
avec la TPP en rose[1] (PDB 1NI4).N° EC EC N° CAS Bases de données IntEnz Vue IntEnz BRENDA Entrée BRENDA IUBMB 1.2.4.1 à l'IUBMB KEGG Entrée KEGG MetaCyc Voie métabolique PRIAM Profil PDB Structures GO AmiGO / EGO La pyruvate déshydrogénase (E1) — à ne pas confondre avec la pyruvate décarboxylase[2] bien qu'on l'appelle parfois également ainsi — est la première des trois enzymes du complexe pyruvate déshydrogénase (PDC), constitué d'une décarboxylase, d'une acétyltransférase et d'une oxydo-réductase intervenant séquentiellement pour catalyser la décarboxylation oxydative du pyruvate en acétyl-CoA, réaction qui réalise notamment la liaison entre la glycolyse et le cycle de Krebs. Les autres enzymes de ce complexe sont la dihydrolipoamide S-acétyltransférase (E2) et la dihydrolipoyl déshydrogénase (E3).
Le complexe pyruvate déshydrogénase
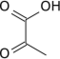
Article principal : complexe pyruvate déshydrogénase.La réaction globale catalysée par le PDC est la suivante :
Le mécanisme de cette réaction est assez complexe, et peut être résumé par le schéma simplifié ci-dessous :
-
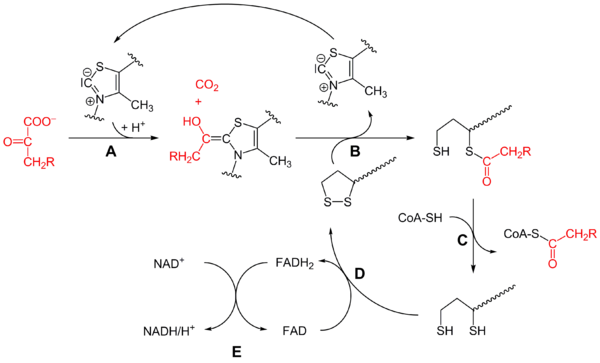 Mécanisme réactionnel du complexe pyruvate déshydrogénase (R = H sur ce schéma) :
Mécanisme réactionnel du complexe pyruvate déshydrogénase (R = H sur ce schéma) :
- la pyruvate déshydrogénase (E1) catalyse les étapes A et B avec la thiamine pyrophosphate (TPP),
- la dihydrolipoamide S-acétyltransférase (E2) catalyse l'étape C avec la lipoamide et la coenzyme A (CoA-SH),
- la dihydrolipoyl déshydrogénase (E3) catalyse les étapes D et E avec la FAD et la NAD+.
La pyruvate déshydrogénase
La pyruvate déshydrogénase proprement dite (E1) catalyse deux réactions successives : la décarboxylation du pyruvate avec la thiamine pyrophosphate (TPP) comme cofacteur, et l'acétylation du lipoamide, ce dernier étant lié à la dihydrolipoamide S-acétyltransférase (E2).
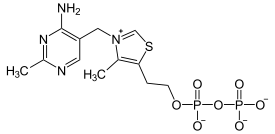
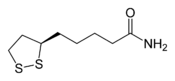
Thiamine pyrophosphate (TPP) Lipoamide Le mécanisme de cette réaction peut être schématisé comme suit :

La forme de résonance ylure de la thiamine pyrophosphate (TPP) commence par attaquer la cétone électrophile du pyruvate. L'intermédiaire β-alcoolate se décarboxyle par la suite en un énol déprotoné sur l'atome de carbone pour former un dipôle 1,3 stabilisé avec un atome d'azote chargé positivement dans l'hétérocycle de la thiamine. Ce dipôle 1,3 est acétylé par la lipoamide liée à un résidu lysine de la dihydrolipoamide S-acétyltransférase (E2).
La TPP est activée sur la pyruvate déshydrogénase par liaison covalente à un résidu glutamate (la Glu-59 chez l'homme) en imposant une conformation en V dans laquelle l'atome N4' du cycle aminopyrimidine — le même cycle que celui de la cytosine — établit un pont hydrogène intramoléculaire avec l'atome C2 du groupe thiazole.
Notes et références
- (en) E. M. Ciszak et al. « Structural basis for flip-flop action of thiamin pyrophosphate-dependent enzymes revealed by human pyruvate dehydrogenase » dans J. Biol. Chem., 2002, 278, 21240-21246. DOI:10.1074/jbc.M300339200
- La pyruvate décarboxylase (EC ) convertit le pyruvate en acétaldéhyde en vue de produire de l'éthanol par fermentation alcoolique.
Catégories :- EC 1.2.4
- Glycolyse
-
Wikimedia Foundation. 2010.