- Dihydrolipoyl déshydrogénase
-
Dihydrolipoyl déshydrogénase 
Structure d'une E3 humaine (PDB 1ZY8).N° EC EC N° CAS Bases de données IntEnz Vue IntEnz BRENDA Entrée BRENDA IUBMB 1.8.1.4 à l'IUBMB KEGG Entrée KEGG MetaCyc Voie métabolique PRIAM Profil PDB Structures GO AmiGO / EGO La dihydrolipoyl déshydrogénase (DLD), également appelée dihydrolipoamide déshydrogénase, est la dernière des trois enzymes du complexe pyruvate déshydrogénase (PDC), du complexe alpha-cétoglutarate déshydrogénase et du complexe alpha-cétoacide ramifié déshydrogénase, constitués chacun d'une décarboxylase, d'une transacétylase et d'une réductase.
Le complexe pyruvate déshydrogénase
Article principal : complexe pyruvate déshydrogénase.Le PDC catalyse la décarboxylation oxydative du pyruvate en acétyl-CoA, réaction qui réalise notamment la liaison entre la glycolyse et le cycle de Krebs ; les autres enzymes du complexe sont la pyruvate déshydrogénase (E1) et la dihydrolipoamide S-acétyltransférase (E2). Cette réaction s'écrit globalement :
Le mécanisme en est assez complexe, et peut être résumé par le schéma simplifié ci-dessous :
-
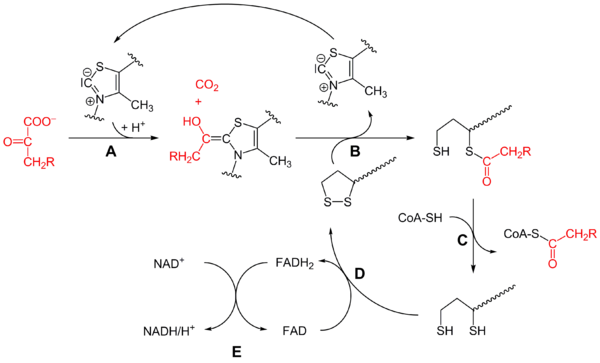 Mécanisme réactionnel du complexe pyruvate déshydrogénase (R = H sur ce schéma) :
Mécanisme réactionnel du complexe pyruvate déshydrogénase (R = H sur ce schéma) :
- la pyruvate déshydrogénase (E1) catalyse les étapes A et B avec la thiamine pyrophosphate (TPP),
- la dihydrolipoamide S-acétyltransférase (E2) catalyse l'étape C avec la lipoamide et la coenzyme A (CoA-SH),
- la dihydrolipoyl déshydrogénase (E3) catalyse les étapes D et E avec la FAD et la NAD+.
La dihydrolipoyl déshydrogénase
La DLD est une flavoprotéine qui, outre sa participation aux trois complexes enzymatiques que sont le complexe pyruvate déshydrogénase, le complexe alpha-cétoglutarate déshydrogénase et le complexe alpha-cétoacide ramifié déshydrogénase, catalyse plus simplement la réduction du lipoamide en dihydrolipoamide.
Son confacteur est la flavine adénine dinucléotide (FAD), qui transfère au nicotinamide adénine dinucléotide (NAD+) les deux atomes d'hydrogène libérés par le dihydrolipoamide lors de son oxydation en lipoamide.
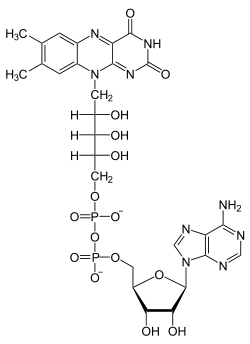
Flavine adénine dinucléotide (FAD) Nicotinamide adénine dinucléotide (NAD+) Catégorie :- EC 1.8.1
-
Wikimedia Foundation. 2010.