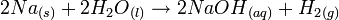- Métaux alcalins
-
Métal alcalin
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Un métal alcalin est un élément chimique de la première colonne (groupe 1, excepté l'hydrogène) du tableau périodique des éléments. Le lithium 3Li, le sodium 9Na, le potassium 19K, le rubidium 37Rb, le césium 55Cs et le francium 87Fr sont des métaux alcalins.
Très réactifs, ils ne se trouvent jamais à l'état élémentaire dans le milieu naturel, et réagissent immédiatement en présence d'humidité ; on les conserve par conséquent immergés dans de l'huile minérale, par exemple de l'huile de vaseline.
Le mot alcalin provient, via le mot d'emprunt alcali, de l'arabe al-qily signifiant la soude.
Sommaire
Propriétés
Les métaux alcalins sont de couleur argentée (le césium a toutefois des reflets dorés), mous, à bas point de fusion et faible densité. Ils réagissent facilement avec les halogènes pour former des sels ioniques, et avec l'eau pour former des hydroxydes fortement basiques.
-
Élément Masse atomique
(u)Température
de fusionTempérature
d'ébullitionMasse volumique
(kg/m3)Électronégativité
(Pauling)Lithium 6,941 180,5 °C 1 341,9 °C 534 0,98 Sodium 22,990 97,7 °C 882,9 °C 968 0,93 Potassium 39,098 63,4 °C 758,9 °C 890 0,82 Rubidium 85,468 39,3 °C 687,9 °C 1 532 0,82 Césium 132,905 28,4 °C 670,9 °C 1 930 0,79 Francium (223) 26,9 °C 676,9 °C 1 870 0,70
Leur configuration électronique est caractérisée par la présence d'un électron unique ns1, facilement perdu pour retrouver la configuration du gaz noble de la période précédente : les métaux alcalins forment donc très facilement des cations. Ils ont toujours le potentiel d'ionisation le plus bas de leur période ; le second potentiel d'ionisation est en revanche très élevé, en raison de la configuration électronique de gaz rare des cations alcalins.
-
Élément chimique Configuration électronique no 3 Li Lithium 1s2 2s1 no 11 Na Sodium 1s2 2s2 2p6 3s1 no 19 K Potassium 1s2 2s2 2p6 3s2 3p6 4s1 no 37 Rb Rubidium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 no 55 Cs Césium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 no 87 Fr Francium 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1
L'hydrogène, avec son électron 1s1 solitaire, devrait normalement appartenir au groupe des métaux alcalins. Toutefois, la perte de cet électron requiert davantage d'énergie que pour les autres éléments du groupe 1. L'hydrogène n'est pas non plus métallique aux conditions normales de température et de pression : il ne devient métallique qu'aux pressions très élevées (cf. Hydrogène métallique).
Identification
Émission atomique
Les vapeurs de métaux alcalins (ou de leurs ions) excités par la chaleur ou l'électricité sont connus pour émettre des couleurs caractéristiques. C'est ainsi que la spectroscopie a vu ses premiers pas se réaliser, grâce aux expériences de Bunsen et Kirchhoff. Les couleurs sont dues au fait que le spectre d'émission atomique est un spectre de raie, et non un spectre continu de type corps noir, preuve de la nature quantique des niveaux d'énergie dans les atomes et ions. Les couleurs caractéristiques sont :
- lithium : rose fuchsia intense ; de fait très utilisé en pyrotechnie,
- sodium : jaune-orangé intense ; utilisé en pyrotechnie et dans les ampoules d'éclairages publics,
- potassium : mauve pâle.
Réactions
Réaction avec l'eau
Les métaux alcalins sont connus pour leur réaction violente avec l’eau. Cette violence augmente quand on descend dans l'ordre du groupe . Voici cette réaction:
Métal alcalin + eau
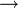 Hydroxyde du métal alcalin + Dihydrogène
Hydroxyde du métal alcalin + DihydrogèneExemple avec le sodium:
Cette réaction est très exothermique et met parfois feu au dihydrogène avec une flamme jaune. Avec le potassium au lieu du sodium, la flamme est de couleur lilas.
Les réactions des métaux alcalins avec l'eau peuvent être, selon les quantités mises en œuvre, très dangereuses.
Réaction dans l'ammoniac
Les métaux alcalins se dissolvent dans l'ammoniac liquide donnant des solutions bleues qui sont paramagnétiques
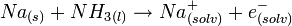
Vu la présence d'électrons libres, la solution occupe plus que la somme des volumes du métal et de l'ammoniac. Les électrons libres font de ces solutions de très bons agents réducteurs.
Liens externes
- UICPA : Page de liens vers le tableau périodique
- UICPA : Tableau périodique officiel du 22/06/2007
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégorie : Métal alcalin -
Wikimedia Foundation. 2010.