- Amidons
-
Amidon
L'amidon (du latin amylum, non moulu) est un glucide complexe (polyoside) composé de chaînes de molécules de D-Glucose. Il s'agit d'une molécule de réserve énergétique pour les végétaux supérieurs et un constituant essentiel de l'alimentation humaine.
Amidon 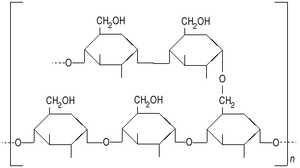 Structure de l'amylopectine
Structure de l'amylopectineGénéral No CAS No EINECS Apparence poudre blanche inodore[1] Propriétés chimiques Formule brute (C6H10O5)n Propriétés physiques T° fusion 200 °C (décomposition)[1] Solubilité 50 g/l (eau, 90 °C)[1] Masse volumique 550 à 700 kg/m³ [1]
1.5 g/cm³ [2]T° d’auto-inflammation environ 400 °C[1] Écotoxicologie DL50 6600mg/kg (souris, i.p.)[3] Unités du SI & CNTP, sauf indication contraire. Sommaire
Origine botanique
L'amidon se trouve dans les organes de réserves de nombreuses plantes :
- les graines (en particulier les céréales (maïs, froment) et les légumineuses),
- les racines,
- tubercules et rhizomes (pomme de terre, patate douce, manioc, etc.) ; dans ce cas il est appelé fécule.
- Fruit (banane), où l'amidon a pour fonction de stimuler la dispersion des graines (quand il y en a) par des animaux.
Structure de l'amidon
L'amidon est un mélange de 2 homopolymères, l'amylose et l'amylopectine composés d'unités D-Anhydroglucopyranose (AGU) qui appartiennent à la famille des polysaccharides (ou polyosides) de formule chimique générale (C6H10O5)n. Les unités AGU sont liées entre elles par des liaisons α (1-4), en général caractéristique des polyosides de réserve (à l'exception de l'inuline) et des liaisons α (1-6) qui sont à l'origine de ramifications dans la structure de la molécule. Ces 2 homopolymères, qui diffèrent par leur degré de branchement et leur degré de polymérisation sont:
- L'amylose, légerement ramifié avec de courtes branches et dont la masse moléculaire peut être comprise entre 10 000 et 1 000 000 Dalton. La molécule est formée de 600 à 1 000 molécules de glucose.
- l'amylopectine, molécule ramifiée avec de longues branches toutes les 24 à 30 unités glucoses par l'intermédaire des liaisons α (1-6). Sa masse moléculaire peut aller de 1 000 000 à 100 000 000 Dalton, selon les estimations scientifiques et son niveau de branchement est de l'ordre de 5%. La chaine totale peut faire entre 10 000 et 100 000 unités glucoses.
Le ratio entre l'amylose et l'amylopectine dépend de la source botanique de l'amidon. Parfois, il y a aussi présence de phytoglycogène (entre 0 et 20 % de l'amidon), un analogue de l'amylopectine mais ramifié tous les 10 à 15 résidus glucose.
Biosynthèse
Les plantes produisent l'amidon en convertissant d'abord le glucose 1-phosphate en ADP-Glucose grâce à l'enzyme glucose-1-phosphate adenylyltransferase. L'enzyme synthase de l'amidon ajoute ensuite l'ADP-Glucose à une chaîne en croissance d'unités AGU via les liaisons α (1-4), libérant de l'ADP et créant l'amylose. L'enzyme de branchement de l'amidon crée des liaisons α (1-6) entre ces chaînes, créant la molécule d'amylopectine. Plusieurs formes de ces enzymes existent, ce qui rend la biosynthèse de l'amidon extrêmement complexe.
Structure supramoléculaire
Le grain d'amidon se présente sous forme de granules semi-cristallins : l'amylopectine est organisée en feuillets et forme ainsi la zone cristalline, tandis que l'amylose forme une zone amorphe entre les différents feuillets.
Propriétés chimiques
L'amidon est insoluble dans les solvants aqueux dans des conditions normales de température et de pression. Des traitements acides, basiques ou la sonification permettent toutefois de pallier cela mais sont en réalité destructifs pour les molécules de l'amidon. Dans le cas des solvants organiques, l'amidon est soluble dans le diméthylsulfoxide dans des conditions douces; l'ajout de sel (bromure de lithium ou chlorure de lithium)permet d'empêcher la rétrogradation de l'amylose, phénomène durant lequel les molécules d'amylose tendent à se rassembler dans des zones amorphes en suspension.
En suspension dans l'eau, on obtient du lait d'amidon, suspension instable mais qui, chauffée à 70 °C, devient visqueuse et translucide.
Au contact d'une solution iodo-iodurée, l'amidon prend une teinte violette (réaction entre l'amylose et l'iode).
L'amidon ne peut pas oxyder la liqueur de Fehling, car sa fonction alcool (–OH) réductrice est « perdue » dans la taille de la molécule.
La molécule seule d'amylose s'organise en une hélice droite à six glucoses par tour.
Digestion de l'amidon
Lors de la digestion, les molécules d'amidon se dissocient en chaînes glucanes linéaires, elles-mêmes dissociées en glucoses simples et assimilables par le système digestif. Les amylases, présentes dans la salive ainsi que dans le suc pancréatique, permettent l'hydrolyse de l'amidon en dextrines (dont l'isomaltose), maltose (un diholoside) et glucose (un ose). Par la suite dans l'intestin, deux enzymes, la maltase et l'isomaltase, finissent l'hydrolyse des dextrines et du maltose en glucose.
La digestion est d'autant rapide que la proportion d'amylopectine est importante et celle d'amylose faible dans l'amidon digéré. En effet, la formation hélicoïdale de l'amylose ne favorise pas l'accessibilité des enzymes. L'utilisation dans l'industrie agroalimentaire d'amidons à fort taux d'amylose permet ainsi de produire des aliments à faible index glycémique, qui ne favorisent pas le diabète.
Une molécule de réserve d'énergie
Pour le végétal, l'amidon est une réserve d'énergie et de nutriment, nécessaire pour survivre à la mauvaise saison (sèche ou froide). Il permet de stocker des nutriments glucidiques dans les cellules, sans les dissoudre dans l'eau. En effet, la présence de glucides simples augmente le potentiel osmotique interne des cellules ce qui nécessite une grande quantité d'eau. L'amidon est une forme de réserve de glucides qui permet d'économiser l'eau. Dans les cellules, il se présente sous forme de grains visibles au microscope: les amyloplastes.
L'amidon est également une des ressources caloriques principales pour l'espèce humaine, car il est le constituant principal des céréales (riz, maïs, blé, sorgho, etc.) et de la pomme de terre. Au contraire des glucides simples qui sont faciles à digérer, l'amidon, du fait de sa structure complexe, rend le travail enzymatique plus difficile lors de la digestion: on distingue ainsi les sucres rapides des sucres lents.
A noter que chez les plantes de la famille des Astéracées (anciennement Composées) et chez les animaux, la molécule de réserve n'est pas l'amidon, mais respectivement l'inuline et le glycogène.
Utilisations industrielles
Les débouchés industriels sont essentiellement l'agroalimentaire à travers l'industrie des boissons, confiseries, boulangeries, l'industrie chimique qui l'utilise dans les procédés de fermentation pour la production de bioéthanol, les traitements de surface, la formulation de colles, l'encapsulation de produits pharmaceutiques, les cosmétiques, la papeterie et les matières plastiques biodégradables. L'empois d'amidon était aussi utilisé autrefois, pour l'empesage des vêtements.
L'amidon, principalement extrait de la pomme de terre, est souvent modifié à des fins industrielles et peut subir différentes modifications :
- Les modifications physiques : précuisson sur cylindre, en extrusion ou en tour d'atomisation.
- Les modifications physico-chimiques : dextrination à haute température et à pH extrêmes.
- Les modifications chimiques : réticulation et substitution.
- Les modifications biologiques : hydrolyse contrôlée par des systèmes enzymatiques.
Par ailleurs, la société BASF a récemment développé une pomme de terre modifiée génétiquement, l'Amflora, riche en amylopectine, pour faciliter l'exploitation industrielle de l'amidon.
La liste des amidons modifiés
Les amidons dits « modifiés » sont repris par The International Numbering System for Food Additives ((en) INS, (fr) SIN)[4] :
1401 Acid-treated starch
1402 Alkaline treated starch
1403 Bleached starch
1404 Oxidized starch
1405 Starches, enzyme-treated
1410 Monostarch phosphate
1411 Distarch glycerol
1412 Distarch phosphate esterified with sodium trimetaphosphate
1413 Phosphated distarch phosphate
1414 Acetylated distarch phosphate
1420 Starch acetate esterified with acetic anhydride
1421 Starch acetate esterified with vinyl acetate
1422 Acetylated distarch adipate
1423 Acetylated distarch glycerol
1440 Hydroxypropyl starch
1442 Hydroxypropyl distarch phosphate
1443 Hydroxypropyl distarch glycerol
1450 Starch sodium octenyl succinate
Annexes
Notes et références
- ↑ a , b , c , d et e Entrée de « Starch » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 mai 2009 (JavaScript nécessaire)
- ↑ Fiche internationale de sécurité chimique, consultée le 10 juillet 2009
- ↑ (en) « Starch » sur ChemIDplus, consulté le 27 mai 2009
- ↑ Codex alimentarius (1989) Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p1-35.
Articles connexes
- Portail de la biochimie
Catégories : Botanique | Matière première végétale | Glucane | Additif alimentaire
Wikimedia Foundation. 2010.