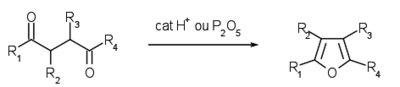- 110-00-9
-
Furane
Furane 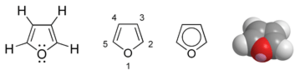
Général Synonymes Furfuranne No CAS No EINECS PubChem SMILES InChI Apparence liquide incolore limpide tournant au brun avec le temps, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C4H4O [Isomères] Masse molaire 68,074 g∙mol-1
C 70,57 %, H 5,92 %, O 23,5 %,Moment dipolaire 0,71 Debye Propriétés physiques T° fusion -85,6 °C[2] T° ébullition 31,5 °C[2] Solubilité 10 g/L (eau, 20 °C) Masse volumique 0,9378 g⋅cm−3 T° d’auto-inflammation 390 °C Point d’éclair -35 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 2.3-14.3[1] Pression de vapeur saturante 0,658 bar à 20 °C
1,0 bar à 30 °C
1,907 bar à 50 °C
3,105 bar à 65 °CPrécautions Directive 67/548/EEC 
T
F+Phrases R : 12, 19, 20/22, 38, 45, 48/22, 52/53, 68, Phrases S : 45, 51, 53, [3] Transport 33 2389 NFPA 704 SIMDUT[5] 

SGH[6] 

DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[4] Écotoxicologie DL50 7 mg⋅kg-1 (Souris, i.p.)[2]
5,2 mg⋅kg-1 (Rats, i.p.)[2]CL50 Rat : 20 ppm pour 4 heures LogP 1.34[1] Unités du SI & CNTP, sauf indication contraire. Le furane, de formule brute C4H4O, est un composé hétérocyclique simple et fondamental, constitué d'un cycle aromatique de 5 atomes dont un atome d'oxygène. Il existe sous la forme d'un liquide incolore très volatile. Le furane est un composé aromatique qui possède une réactivité différente du benzène. Il est utilisé en tant que réactif ou précurseur en chimie organique.
Sommaire
Synthèse
Le furane a été synthétisé pour la première fois en 1870 par Heinrich Limpricht et fut alors appelé tétraphénol.[7]
Synthèse industrielle
Une des sources principales du furane est le furfural obtenu par distillation de dérivés végétaux (notamment des céréales). Le furfural est ensuite décarboxylé par catalyse pour produire le furane. 2 voies de synthèse sont connues[8]:
- 1) La méthode originelle transforme le furfural en furane, hydrogène, et dioxyde de carbone en présence de vapeur et d'un catalyseur de zinc-fer ou zinc-manganèse. Le mélange vapeur-furfural avec un ratio 1:5-1:10 est chauffée à 400 °C et le rendement en furane est supérieur à 90 %.
- 2) En 1959, DuPont met au point un voie de synthèse utilisant un catalyseur en platine, ce qui permet d'éviter l'utilisation de vapeur. Le furfural est directement décomposé en furane et monoxyde de carbone sous pression et à une température de 200 °C.
Une autre possibilité est l'oxydation partielle du 1,3-butadiène. Cette technique a été développée par DuPont en 1957. La réaction utilise un oxyde de molybdène (MoO3) comme catalyseur à une température de 500 °C. Divers catalyseurs permettent également cette réaction: oxyde de phosphore et de vanadium ou oxyde d'antimoine dopé à l'étain, au cuivre ou encore au tungstène. Toutefois les rendements sont inférieurs à 15%[8].
DuPont a continué le développement sur cette voie et, en 1987, un procédé à basse température (90 à 120 °C) a été mis au point. Le réactif 1,3-butadiène est vaporisé puis oxydé par du dichlorure de cuivre dans une solution aqueuse de mono- et dichlorure de cuivre avec présence de chlorure de sodium, de iodure de potassium et d'acide chlorhydrique. Une sélectivité de plus de 90 % est reportée pour une conversion du 1,3-butadiène de 20% [8].
Synthèse de laboratoire
Le furane et ses dérivés substitués peuvent être obtenus à partir de systèmes ouverts, ce qui permet l'accès direct à des dérivés fortement fonctionnalisés, notamment la déshydratation de pentan-2,4-diones substituées permet d'accéder aux furanes 3,4-substitués, assez complexes à obtenir par d'autres voies. La synthèse de Paal Knorr est une des synthèses les plus simples et permet à partir de 1,4 dicétone et de pentoxyde de phosphore d'obtenir du furane.
La synthèse de Feist-Benary fait réagir le carbanion d'un β-cétoester avec le carbonyle d'une cétone α-halogénée puis une substitution nucléophile intramoléculaire a lieu pour former un cycle qui donne par déshydratation un furane.
 Synthèse de Feist-Benary
Synthèse de Feist-Benary
D'autres synthèses du furane sont possibles à partir de cycloadditions ou de réaction de Diels-Alder.Propriétés physico-chimique
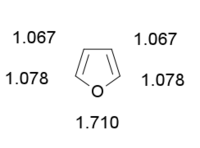
Le furane est un liquide incolore aux condition normale de pression et de température. Le furane est très volatile et possède une faible température d'ébulition. En RMN du proton, le furane présente deux massifs de pics dans le chloroforme deutéré[9] : 7,4 ppm pour les hydrogènes en α de l’oxygène, 6,3 ppm pour les hydrogènes en β. En RMN du carbone, le furane présente deux pics : à 142 ppm pour les carbones 1 et 5, 109 ppm pour les carbones 2 et 4[9]. Le furane est très soluble dans l'acétone, soluble dans le méthanol et dans l'éther diéthylique et très peu soluble dans l'eau.[10] L'indice de réfraction est de 1.421[11].
Aromaticité
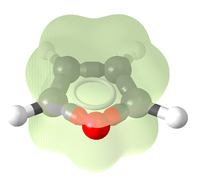
Le furane est un composé aromatique qui respecte la règle de Hückel. Le furane comporte six électrons délocalisés : quatre apportés par les doubles liaisons et deux pour l'atome d'oxygène (un des deux doublets non liants). Chaque carbone apporte un de ses électrons pi dans la délocalisation et l’oxygène apporte deux électrons. Les carbones sont hybridés sp². Le furane possède une énergie de résonance entre 62,3 et 96,2 kJ par mole. Cette énergie est inférieure à celle du benzène, du thiophène et du pyrrole[12]. Le furane est un composé moins aromatique que le benzène, le pyrrole et le thiophène. Cette faible aromaticité explique que le furane agit comme un diène cyclique dans certaines réactions de Diels-Alder.
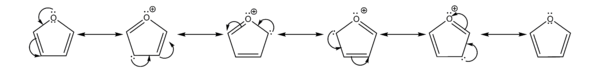
L'atome d'oxygène a un effet mésomère donneur et un effet inductif attracteur dans le furane. La délocalisation du doublet libre constitue l'effet mésomère de l'oxygène tandis que l'attraction des électrons des liaisons C-O vers l'atome d'oxygène correspond à l'effet inductif. Le caractère inductif attracteur influence la répartition des électrons dans le cycle mais ne parvient pas à contrebalancer l'effet mésomère. L’oxygène apporte donc globalement une densité électronique supplémentaire dans le cycle. Cette contribution électronique de l'oxygène se traduit par des valeurs de densité électronique supérieures à 1 pour les carbones du cycle. L'effet mésomère donneur engendre une charge positive sur l'oxygène dans les quatre formes mésomères du furane et une charge négative délocalisée sur les carbones du cycle.
L'atome d'oxygène possède un autre doublet qui n'est pas délocalisé . Le furane est un composé plan. De même que ses homologues thiophène ou pyrrole, il est un cycle électro-excédentaire. Il a en effet 6 électrons pi répartis sur 5 atomes ; la densité électronique est donc nettement plus importante que sur les analogues benzéniques. D'autre part, contrairement aux cycles aromatiques simples à six chainons, seule une de ses formes de résonance est neutre, les autres existant sous forme zwittérionique. Ces formes chargées étant minoritaires, la chimie du furane tiendra en partie de celle des aromatiques et en partie de celle des diènes.
Réactivité du furane
Les différents types de réactivité
en tant qu'aromatique
Le furane étant électro-excédentaire, les réactions de substitution électrophile aromatique sont nettement plus rapides que sur les analogues benzéniques. Ainsi, il est possible de réaliser les réactions d'halogénation, de sulfonation, de métalation, ... notons par exemple que le furane est tellement réactif qu'il peut subir des acylations de Friedel et Crafts sans même la présence de catalyseur.
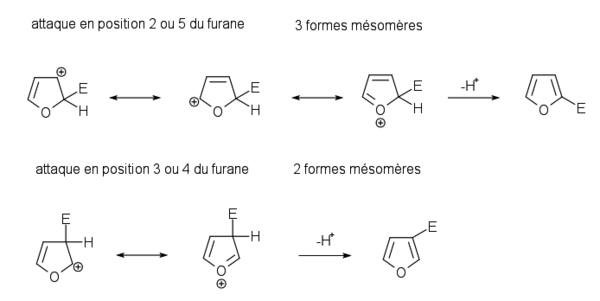
Les positions les plus favorables pour les réactions de substitution sont les position 2 et 5 (en alpha de l'oxygène). Lorsque les deux sont disponibles, il est assez difficile de s'arrêter à la monosubstitution. Lorsque les positions 2 et 5 sont occupées, les réactions ont lieu sur les positions restantes.
en tant que diène
Le furane et ses dérivés peuvent réagir en tant que diènes ou bien en tant que composés aromatiques selon les substituants sur le cycle[8]. Le furane non substitué réagit particulièrement bien en tant que diène dans les réactions de cyclisation de type Diels-Alders à cause de sa faible aromaticité. De même les alkyles-furanes, les alkoxy-furanes et les ester et éther furfurylique ont une bonne réactivité dans les réactions de Diels-Alder[8]. Cependant les acide furoique, les nitrofuranes et le furfural possèdent des groupements électroattracteurs et ne réagissent pas même avec des diénophiles forts. [8] Il peut réagir avec l'anhydride maléique, le maléate et le fumarate sous haute pression, l'acrylate avec un catalyseur (l'iodure de zinc).
L'hydrogénation totale du furane donne le tétrahydrofurane (THF), solvant fortement utilisé en chimie organique et pharmaceutique.
en tant qu'éther
Le furane est un éther cyclique. Il est particulièrement sensible aux ouvertures en milieu aqueux acide. C'est notamment la source de réactions secondaires, notamment sur les dérivés halogénés, particulièrement instables.
Régiosélectivité des substitutions
La position où va s’effectuer une substitution dépend de la stabilité de l’intermédiaire de la réaction. L’écriture des formes mésomères des intermédiaires d’une substitution électrophile sur le furane montre qu’une substitution s’effectue préférentiellement en position 2 ou 5 car l'intermédiaire formé possède 3 forme mésomères. Lorsque la substitution s'effectue en position 3 ou 4, l'intermédiaire formé possède seulement deux formes mésomères et a une stabilité moins grande.
L'écriture des formes mésomères permet de situer les charges partielles négatives du furane dans les position 2,3,4,5. Parmi les formes mésomères, la forme non chargée est plus représentative car plus stable. Parmi les formes mésomères avec des charges, celles où les charges sont les plus éloignées sont plus représentatives que les formes où les charges sont proches. Le furane possède une seule forme mésomère non chargée contrairement au benzène qui possède deux formes mésomères non chargées.
Réaction avec les acides
Les acides minéraux en solution diluée aqueuse, à froid, n'affectent pas le furane ou les alkylfuranes[12].. mais à chaud, ils protonnent le furane en position 2, produisant une ouverture du furane et la formation de composé dicarbonylés. De plus, les acides forts concentrés (l'acide sulfurique, l'acide nitrique fumant) ou les acides de Lewis provoquent une polymérisation du furane et de ses dérivés alkyles.
Les substituants du furane influencent la réactivité vis à vis des acides. Les furanes substitués par des groupements électroattracteurs sont relativement stables en milieu acide[12] car le cycle y est moins chargé en électrons et donc moins réactif. Par contre, les furanes substitués par des groupements électrodonneurs sont facilement ouverts ou polymérisés en milieu acide[12]. En effet, les substituants électrodonneurs facilitent l'attaque d'un proton en position 2 du furane.
Substitution nucléophile aromatique
Le furane ne réagit pas avec les réactifs nucléophiles[12]. Cependant certains furanes avec des groupements électroattracteurs peuvent subir une substitution nucléophile de ces groupements.
Substitution électrophile aromatique
Le furane est plus réactif que le thiophène et le benzène vis à vis des réactifs électrophiles mais moins réactif que le pyrolle.[13]
La nitration du furane est effectuée avec de l'anhydride acétique et de l'acide nitrique à basse température. Le 2-nitrofurane est formé, puis si la réaction continue, du 2,5-dinitrofurane se forme. La nitration forme un composé non-aromatique, isolable qui peut perdre un molécule d'acide acétique par l'action d'une base comme la pyridine ou par solvolyse[12].
La sulfonation est réalisée à température ambiante par l'action du complexe pyridine-trioxyde de soufre pour conduire à un composé mono sufonate.
L'alkylation dans les conditions de Friedel Craft n'est pas possible et conduit à un mélange de produits et à des polymères. Cependant, le furane est acylé en présence d'un acide de Lewis par des chlorures d'acide ou des anhydrides. La substitution se fait en position 2. La réaction de Vilsmeier-Haack permet d'ajouter un groupement formyle en position 2 du furane. La réaction ne Mannich ne fonctionne pas avec le furane mais s'appique aux alkyles furane qui possède une position 2 ou 5 libre.
Utilisation
Le furane est principalement utilisé comme précurseur en chimie fine. Par hydrogénation du furane, on peut obtenir le tétrahydrofurane utilisé en premier lieu comme solvant. L'oxydation en présence de brome dans le méthanol donne le 2,5-dimethoxy-2,5-dihydrofurane utilisé en photographie. C'est également un précurseur pour des produits phytosanitaires tel l'endothall. Le furane est également utilisé comme bloc pour la formation de polymères qui sont utilisés comme additifs pour des produits de nettoyage et des lessives. L'avantage de tels additifs est qu'ils ne contiennent pas d'azote ou de phosphore[14].
Bibliographie
- (fr) R.Milcent, F.Chau Chimie Organique Hétérocyclique, EDP Sciences.
Voir aussi
Composés structurellement ou chimiquement apparentés :
- Tétrahydrofurane, furane saturé, très utilisé comme solvant
- Furanes substitués
-
- Furanose, furane substitué par des groupements hydroxyles
- Furfural, furane substitué par un groupement aldéhyde
- Acide furoïque, furane substitué par un groupement carboxylique
- Alcool furfurylique
- Furanes liés à des cycles
- Benzofurane, furane lié à un benzène
- Dibenzofurane, furane lié à deux benzènes
- Polychlorodibenzo-furane
- Analogues du furane
Références
- ↑ a , b , c et d FURANNE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c et d (en) ChemIDplus, « Furan - RN: 110-00-9 » sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine. Consulté le 17/12/2008
- ↑ « furanne » sur ESIS, consulté le 17 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Furanne » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ H.Limpricht, « Ueber das Tetraphenol C4H4O », dans Berichte der deutschen chemischen Gesellschaft, vol. 3, no 1, 1870, p. 90-91 [lien DOI]
- ↑ a , b , c , d , e et f (en) H. E. Hoydonckx, W. M. Van Rhijn, W. Van Rhijn, D. E. De Vos, P. A. Jacobs "Furfural and Derivatives" in "Ullmann's Encyclopedia of Industrial Chemistry" 2007; John Wiley & Sons: New York
- ↑ a et b (en) Agency of Industrial Science and Technology, « Research Information Database RIO-DB Home Page » sur http://riodb01.ibase.aist.go.jp, Tsukuba Advanced Computing Center. Consulté le 14 juillet 2008.
- ↑ site de chimie http://www.sciencelab.com/xMSDS-Furan-9927174
- ↑ Sigma,http://www.sigmaaldrich.com/catalog/ProductDetail.do?N4=185922|ALDRICH&N5=SEARCH_CONCAT_PNO|BRAND_KEY&F=SPEC
- ↑ a , b , c , d , e et f Chimie organique hétérocyclique structures fondamentales, René Milcent, François Chau
- ↑ Site d'hétérochimie http://www.cem.msu.edu/~reusch/VirtualText/heterocy.htm
- ↑ (en) R. H. Kottke "Furan Derivatives" in "Kirk-Othmer Encyclopedia of Chemical Technology" 1998; John Wiley & Sons: New York
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique extrêmement inflammable | Cancérogène chimique | Produit chimique dangereux pour l'environnement | Noyau aromatique simple | Furane
Wikimedia Foundation. 2010.