- Température d'ébulition
-
Ébullition
L’ébullition est la formation de bulles lors d’un changement violent d’un corps de l’état liquide vers l’état vapeur. Ce phénomène est une vaporisation.
Il se produit lorsque la pression de vapeur est égale à la pression atmosphérique : les bulles de vapeur formées au fond du récipient deviennent stables et peuvent donc remonter à la surface.
Sommaire
Processus d'ébullition
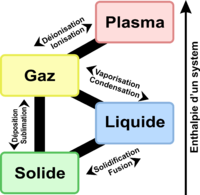
En-dessous (respectivement au-delà) du point d'ébullition, tout apport de chaleur au liquide (resp. au gaz) ne conduit qu'à une élévation de la température. L'énergie introduite est ainsi convertie en énergie cinétique pour les particules. Au contraire, lors de la transition de phase, la température reste constante, de même que la pression. La totalité de l'énergie thermique apportée fait progresser le changement d'état.
Au point d'ébullition, tout apport d'énergie supplémentaire conduit à l'amoindrissement des interactions physico-chimiques entre les particules : celles-ci passent à l'état gazeux. L'énergie nécessaire à une mole d'une espèce pour passer à l'état gazeux est appelée enthalpie de vaporisation, également appelée dans le cas d'un corps pur énergie de vaporisation. C'est seulement lorsque la totalité des particules est à l'état gazeux que la température du système se remet à augmenter.
L'eau, le peroxyde d'hydrogène, ou encore des solutions alcalines (comme une solution de soude) sans particules de poussières ni bulles de gaz sont capables d'être élevées à des températures dépassant la température d'ébullition dans des récipients parfaitement lisses sans entrer en ébullition. La plus petite perturbation, comme la vibration engendrée par l'action de mélanger, est capable d'engendrer une séparation explosive des phases liquide et vapeur, désignée sous le terme de surchauffe.
C'est pour cette raison qu'en pratique, on ajoute aux liquides susceptibles d'entrer en surchauffe de la pierre ponce dont la présence permet à l'ébullition de démarrer et d'éviter l'explosion.
Voir aussi
Articles connexes
Liens externes
- Portail de la physique
- Portail de la chimie
Catégories : Thermodynamique | Transition de phase
Wikimedia Foundation. 2010.