- Dioxyde de soufre
-
Dioxyde de soufre 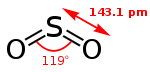
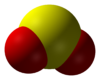
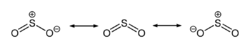
Structure du dioxyde de soufre.Général Nom IUPAC dioxyde de soufre. Synonymes Oxyde sulfureux,
Anhydride sulfureux,
Oxyde de soufre.No CAS No EINECS No RTECS PubChem ChEBI No E E220 FEMA SMILES InChI Apparence gaz incolore ou gaz comprimé liquéfié, d'odeur âcre[1]. Propriétés chimiques Formule brute SO2 Masse molaire[4] 64,064 ± 0,006 g·mol-1
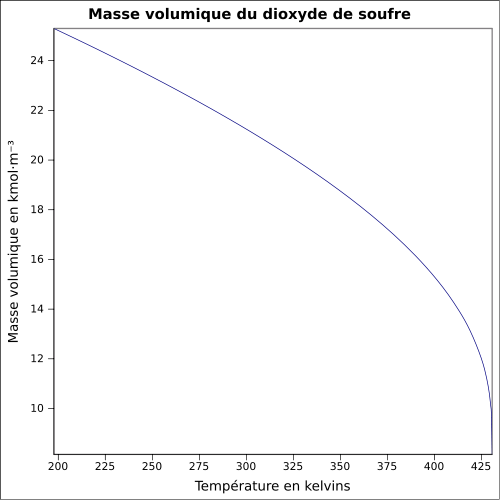
O 49,95 %, S 50,05 %,Moment dipolaire 1,63305 D [2] Diamètre moléculaire 0,382 nm [3] Propriétés physiques T° fusion -75,5 °C[1] T° ébullition -10 °C[1] Solubilité dans l'eau à 25 °C : 85 ml·l-1[1] Masse volumique 1,354 g·cm-3 à -30 °C
1,434 g·cm-3 à 0 °C
1,25 g·ml-1 à 25 °C
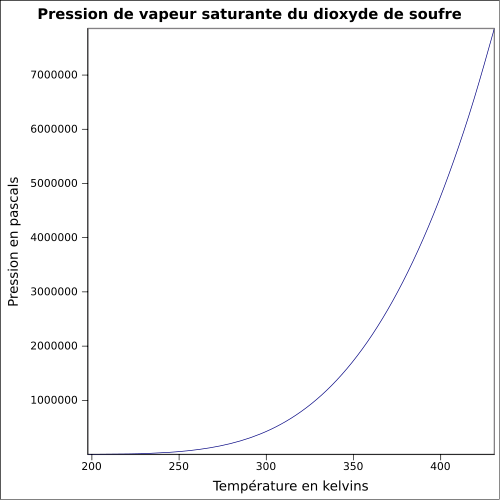
2.26 à 21 °C par rapport à l'airT° d'auto-inflammation ininflammable Point d’éclair ininflammable Limites d’explosivité dans l’air non-explosif Pression de vapeur saturante -10 °C : 1,013 bar
20 °C : 3,3 bar
40 °C : 4,4 barPoint critique 78,9 bar, 157,45 °C [6] Vitesse du son 213 m·s-1 (0 °C,1 atm)[7] Thermochimie S0gaz, 1 bar 248,21 J/mol·K ΔfH0gaz -296,84 kJ·mol-1 [8] ΔvapH° 24,94 kJ·mol-1 (1 atm, -10,05 °C);
22,92 kJ·mol-1 (1 atm, 25 °C)[9]Cp Propriétés électroniques 1re énergie d'ionisation 12,349 ± 0,001 eV (gaz)[10] Propriétés optiques Indice de réfraction  1,357 [3]
1,357 [3]Précautions Directive 67/548/EEC 
TPhrases R : 23, 34, Phrases S : 1/2, 9, 26, 36/37/39, 45, [11] Transport 268 1079 NFPA 704 SIMDUT[13] 


SGH[14] 


DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[12] Inhalation Très toxique, mort, produit de l'acide sulfureux dans les poumons. Peau Dangereux, corrosif, formation d'acide au contact de surfaces humides. Yeux Dangereux, corrosif, formation d'acide au contact de surfaces humides. Ingestion Toxicité relativement faible, effets à long terme inconnus. Écotoxicologie CL50 3 000 ppm pendant 30 minutes (souris, inhalation) Seuil de l’odorat bas : 0,33 ppm
haut : 5 ppm[15]Unités du SI & CNTP, sauf indication contraire. Le dioxyde de soufre, jadis également appelé anhydride sulfureux, est un composé chimique de formule SO2. Il s'agit d'un gaz incolore, dense et toxique, dont l'inhalation est fortement irritante. Il est libéré dans l'atmosphère terrestre par les volcans et par de nombreux procédés industriels, ainsi que par la combustion de certains charbons, pétroles et gaz naturels non désulfurés. L'oxydation du dioxyde de soufre, le plus souvent en présence de catalyseurs tels que le dioxyde d'azote NO2, conduit au trioxyde de soufre SO3 et à l'acide sulfurique H2SO4, d'où la formation de pluies acides[16].
Le dioxyde de soufre est utilisé comme désinfectant, antiseptique, antibactérien, gaz réfrigérant, agent de blanchiment et comme conservateur de produits alimentaires, notamment pour les fruits secs, dans la production de boissons alcoolisées et notamment dans la fabrication du vin.
Sommaire
Structure de la molécule
SO2 est une molécule coudée dans laquelle l'atome de soufre est à l'état d'oxydation +4. L'atome de soufre est entouré par cinq doublets d'électrons, ce qui fait de SO2 une molécule hypervalente. Du point de vue de la théorie des orbitales moléculaires, la plupart des électrons de valence sont engagés dans une liaison S=O.
La longueur des liaisons S=O du SO2 est de 143,1 pm, inférieure à celle de cette liaison dans le monoxyde de soufre SO (148,1 pm).
Par analogie, les liaisons O-O dans l'ozone O3 (127,8 pm) sont plus longues que dans le dioxygène O2 (120,7 pm).
De même, l'énergie de liaison moyenne est plus élevée dans SO2 (548 kJ⋅mol-1) que dans SO (524 kJ⋅mol-1), alors qu'elle est plus faible dans O3 (297 kJ⋅mol-1) que dans O2 (490 kJ⋅mol-1).
Ces considérations ont conduit les chimistes à conclure que les liaisons S=O du dioxyde de soufre ont un ordre de liaison au moins égal à 2, contrairement aux liaisons O-O de l'ozone, qui sont d'ordre 1,5[17].
Production
Le dioxyde de soufre peut être préparé :
- par combustion du soufre élémentaire :
- par combustion de sulfure d'hydrogène ou de composés organosulfurés :
- par grillage des minéraux sulfurés comme la pyrite, la sphalérite ou le cinabre :
- 4 ciment : CaSiO3 et CaSO4 sont chauffés avec du coke et du sable :
- 2 CaSO4 (s) + 2 SiO2 (s) + C(s) → 2 CaSiO3 (s) + 2 SO2 (g) + CO2 (g),
- par acide sulfurique chaud sur de la limaille de cuivre
- Cu(s) + 2 H2SO4 (aq) → CuSO4 (aq) + SO2 (g) + 2 H2O(l).
Le dioxyde de soufre dissous dans l'eau est un acide bifonctionnel, et se divise en trois fractions en fonction des équilibres suivants :
- H2O + SO2
 H+ + HSO3-
H+ + HSO3-  2 H+ + SO32–.
2 H+ + SO32–.
Ces fractions dépendent de constantes thermodynamiques et du pH du vin.
On obtient également un dégagement de SO2 en mélangeant du métabisulfite de sodium Na2S2O5 avec de l'acide tartrique dans de l'eau, expérience proposée par certains coffrets d'initiation aux expériences de chimie.
Propriétés physiques
Pression de vapeur saturante[18] :
Température -103,15 °C -98,15 °C -93,15 °C -88,15 °C -83,15 °C -78,15 °C -73,15 °C -68,15 °C -63,15 °C Pression 0,1 kPa 0,2 kPa 0,3 kPa 0,5 kPa 0,8 kPa 1,3 kPa 2,0 kPa 3,0 kPa 4,4 kPa Température -58,15 °C -53,15 °C -48,15 °C -43,15 °C -38,15 °C -33,15 °C -28,15 °C -23,15 °C -18,15 °C Pression 6,3 kPa 9,0 kPa 12,6 kPa 17,3 kPa 23,3 kPa 31,1 kPa 40,9 kPa 53,2 kPa 68,3 kPa Température -13,15 °C -8,15 °C -3,15 °C 1,85 °C 6,85 °C 11,85 °C 16,85 °C 21,85 °C 26,85 °C Pression 86,7 kPa 109 kPa 136 kPa 168 kPa 205 kPa 249 kPa 300 kPa 359 kPa 426 kPa Dans l'industrie
Dans l'industrie, le dioxyde de soufre sert surtout pour la production d'acide sulfurique. L'acide sulfurique possède d'innombrables applications et est le produit chimique le plus utilisé. Le dioxyde de soufre est obtenu par combustion de soufre ou de pyrites, puis transformé en trioxyde de soufre (SO3) très pur par oxydation avec de l'air, catalysée par le platine ou du pentoxyde de vanadium. Le SO3 ainsi obtenu permet la fabrication directe d'acide sulfurique très concentré par simple hydratation.
La pollution atmosphérique en dioxyde de soufre issue de l'industrie provient principalement de la consommation de combustibles fossiles. En effet, du soufre est naturellement contenu dans ces combustibles, et leur combustion génère du SO2. Il peut aussi provenir de l'industrie métallurgique, des procédés de fabrication d'acide sulfurique, de la conversion de la pulpe de bois en papier, de l'incinération des ordures et de la production de soufre élémentaire.
La combustion du charbon est la source synthétique la plus importante et représente environ 50 % des émissions globales annuelles. Celle du pétrole représente encore 25 à 30 %.
Les rejets industriels de dioxyde de soufre peuvent être réduits grâce à la mise en place de procédés de désulfuration.
Dans l'environnement
Le SO2 est produit par les volcans et divers procédés industriels. La houille de mauvaise qualité et le pétrole contiennent des composés de soufre et génèrent du dioxyde de soufre lors de leur combustion. Le dioxyde de soufre peut jouer un rôle refroidissant pour la planète, car il sert de noyau de nucléation à des aérosols dont l'albédo est assez élevé, c’est-à-dire réfléchissant les rayons du soleil sans les absorber. Pour certains scientifiques, une solution pour enrayer le réchauffement climatique global serait de « climatiser » la planète avec du dioxyde de soufre. Mais cela pourrait aussi avoir des conséquences dramatiques, car lorsqu'il se combine avec l'eau et l'oxygène atmosphérique, le dioxyde de soufre et avec le dioxyde d'azote est l'une des principales causes des pluies acides, perturbant, voire détruisant des écosystèmes fragiles. De plus, le SO2 entraine l'acidification des océans, ce qui met ainsi l'existence des planctons, animaux à coquille calcaires et récifs coralliens en péril. Les planctons produisent la moitié de l'oxygène terrestre, en tuant ces producteurs d'oxygène, on réduit considérablement la quantité d'oxygène sur Terre, un fait alarmant. La Chine est devenue le premier émetteur de dioxyde de soufre dans le monde[19].
En œnologie
Article détaillé : Dioxyde de soufre en œnologie.Dans le vin, le dioxyde de soufre est présent sous forme libre hydratée : H2SO3 ou acide sulfureux, qui se combine au 2/3 des constituants du vin. On a ainsi SO2 total= SO2 libre+ SO2 combiné
Une partie de la portion libre assure le rôle de protecteur du vin vis-à-vis des microorganismes d'altération. Cette portion est appelée SO2 actif ou encore SO2 moléculaire. Le SO2 peut être sous forme combinée avec les aldéhydes (éthanal), les cétones (acide alpha-cétoglutarique) et certains sucres pour donner un composé stable. Le corps formé par combinaison entre l’anhydride sulfureux et l’éthanal est l’acide aldéhyde-sulfureux ou acide éthanolsulfonique, qui est un acide fort, selon la réaction suivante :
- CH3CHO + NaH SO3 → CH3CHOH-O-SO2Na
Selon la dose, le dioxyde de soufre inhibe ou arrête le développement des levures et bactéries, ce qui peut être mis à profit pour le mutage des vins moelleux ou liquoreux, ou simplement pour assurer la conservation du vin. Lors de la vinification, l'introduction de dioxyde de soufre permet de sélectionner les levures du genre saccharomyces cerevisae qui sont plus résistantes au dioxyde de soufre que les autres levures (pichia, hansenula...). Diverses méthodes analytiques existent pour doser le SO2 dans les vins.
Santé et réglementation
Le dioxyde de soufre ou E220 provoquerait un danger pour la santé dans les cas suivant[20] :
- lors de son inhalation ;
- lors de son ingestion ;
- lors du contact avec la peau et les muqueuses.
Il est largement utilisé dans l'agroalimentaire et l'agro-industrie et est principalement présent dans :
- les vins (presque tous les vins en contiennent)
- les vinaigres
- les fruits secs
- les viandes, les gelées utilisées en charcuterie, les bières et autres boissons fermentées.
- confiserie, confitures, fruits confits, gelées, marmelades...
Au cours de son ingestion, les organes présentant des activités sulfites oxydases les plus élevées sont plus susceptibles de le détoxiquer par voie urinaire. La persistance des dérivés du SO2 peut être envisagée par un apport excessif. Pour l’utilisateur, les sulfites sont des nucléophiles très puissants qui ne donnent aucune toxicité aiguë mais peuvent provoquer de fortes ou sévères allergies. Il détruit la vitamine B1 (ou thiamine) vers pH = 6 , peut provoquer des irritations gastriques, à éviter chez les malades des reins[21]. Ainsi, la DJA établie par l'OMS est de 0,7 mg⋅kg-1 de poids par jour.
Dans la plupart des observations, les symptômes apparaissent quelques minutes après l’ingestion d’aliments contenant des sulfites. La pollution atmosphérique par le SO2 jouerait aussi un rôle dans l’apparition de ces réactions d’intolérance. De plus, les sujets asthmatiques sont beaucoup plus sensibles que la moyenne des gens.
Il est mutagène quand il est associé avec les E200, E201, E202, E203, à très forte concentration in vitro ce qui est le cas pour certaines marques d'abricots secs par exemple mais par contre, aucun effet tératogène ou cancérigène n’est associé à son ingestion. La réglementation européenne oblige maintenant les producteurs à indiquer la mention « Contiennent des sulfites » s’il est à concentration de plus de 10 mg⋅l-1. Au Canada, La SAQ limite la concentration à 50 ppm l’anhydride sulfureux à l’état libre et à 300 ppm l’anhydride sulfureux à l’état combiné[22].
Dans le contexte actuel où le respect de l’environnement et les aliments à caractère biologiques sont de plus en plus prônés, les viticulteurs et même les consommateurs tendent à se tourner maintenant vers les vins biologiques dont les teneurs en SO2 sont moindres mais pour lesquels l'utilisation du SO2 reste autorisée[23]. Il n’existe pas à proprement parler de vins biologiques mais la seule différence réside dans le respect de la terre, des cultures et l’utilisation du minimum d’intrants en œnologie. Notons que, comparativement aux autres pays du monde (le Canada, la Suisse ou les États-Unis), les règles d’incorporation du SO2 au cours de la vinification sont beaucoup plus restrictives, voire même plus sévères en Europe.
Le tableau suivant montre les différences notables des concentrations de SO2 total dans ces différents pays:
Tableau 1 : Comparatif du dioxyde de soufre Total des vins Biologiques au Canada, aux États-Unis et en Suisse[24] SO2 en mg/l NOP (É.-U.)
« Made with organic grapes »
SO2 totalBio Canada Bourgeon Suisse Demeter SO2 total (5 ans) Rouge sec
(sucre < 5 g⋅l-1)100 100 120 70 blanc/rosé sec
(sucre < 5 g⋅l-1)100 100 120 90 blanc/rosé sec
(sucre < 5 g⋅l-1)100 150 170 70 Blanc/rosé
(sucre > 5 g⋅l-1)100 150 170 130 Vin de liqueur
(sucre > 5 g⋅l-1)100 250 170 80 Incidents majeurs
Mercredi 22 juin 2011, à 7h45 du matin, un problème technique lors de la fermeture d'une vanne à la raffinerie de Feyzin (appartenant au groupe Total) laissa échapper un grand nuage de dioxyde de soufre poussé par un vent du sud au dessus de l'agglomération lyonnaise. Plusieurs personnes furent hospitalisées et des entreprises évacuées[25].
La préfecture qui cherchait à rassurer la population, recommanda « d’aérer les habitations et les bureaux », donnant ainsi des consignes opposées à celles des pompiers qui conseillaient aux personnes de « rester chez elles et de fermer les fenêtres »[26].
Notes et références
- DIOXYDE DE SOUFRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- (en) Irvin Glassman, Richard A. Yetter, Combustion, Elsevier, 2008, 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « dioxyde de soufre » sur ESIS, consulté le 13 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « Dioxyde de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Sulfur dioxide sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- (en) A. F. Holleman, E. Wiberg, « Inorganic Chemistry », Academic Press, San Diego, 2001. ISBN 0-12-352651-5.
- (en) Norman N. Greenwood, A. Earnshaw, « Chemistry of the Elements », Butterworth-Heinemann 2e édition, p. 700, Oxford, 1997. ISBN 0-08-037941-9.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0), p. 6-105
- Michel Temman, « Victime de ses rejets, Tokyo aide Pékin à se mettre au vert », dans Libération du 16/04/2007, [lire en ligne]
- Centre canadien d'hygiène et de sécurité au travail.
- http://sm.coppier.free.fr/additifs/konserv1.php3
- http://vinquebec.com/node/2251
- règles de vinification bio en France et à l'étranger
- http://www.bio-aude.com
- http://www.lyoncapitale.fr/lyoncapitale/journal/univers/Actualite/Environnement/Nuage-de-gaz-sur-l-agglomeration-lyonnaise
- http://www.20minutes.fr/article/745777/rhone-fuite-dioxyde-soufre-raffinerie-total-feyzin
Annexes
Articles connexes
Liens externes
- Institut français de l'environnement
- Atmosphere, Climate & Environment Information Programme du gouvernement du Royaume-Uni
Catégories :- Produit chimique toxique
- Produit chimique corrosif
- Composé du soufre
- Agent conservateur
- Oxyde
- Réfrigérant
Wikimedia Foundation. 2010.