- Dioxyde De Chlore
-
Dioxyde de chlore
Dioxyde de chlore 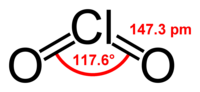
Général Nom IUPAC Dioxyde de chlore Synonymes Oxyde de chlore
Peroxyde de chlore
Oxyde de chlore(IV)No CAS No EINECS Apparence gaz rouge-jaune, d'odeur acre.[1] Propriétés chimiques Formule brute ClO2 [Isomères] Masse molaire 67,452 g∙mol-1
Cl 52,56 %, O 47,44 %,Propriétés physiques T° fusion -59 °C[1] T° ébullition 11 °C[1] Solubilité dans l'eau à 20 °C : 0.8 g/100 ml[1] Masse volumique 1,642 à 0°C (liqide)[2]
1,77 à -55 °C
Densité de vapeur : 2,3Limites d’explosivité dans l’air en volume % dans l'air : >10[1] Pression de vapeur saturante à 20 °C : 101 kPa[1] Précautions Directive 67/548/EEC dioxyde de chlore
Phrases R : 6, 8, 26, 34, 50,
T+
O
N
Phrases S : (1/2), 23, 26, 28, 36/37/39, 38, 45, 61,
dioxyde de chlore . . . %
Phrases R : 25, 34, 50,
T
N
Phrases S : (1/2), 23, 26, 28, 36/37/39, 45, 61,SIMDUT[3] 



SGH[4],[5] 




Danger



DangerInhalation Très toxique Peau provoque des brûlures Yeux provoque des brûlures Ingestion Très toxique Écotoxicologie DL50 292mg/kg (rat, oral)[6] Unités du SI & CNTP, sauf indication contraire. Le dioxyde de chlore (ou bioxyde de chlore) est un gaz jaune rougeâtre, de formule ClO2, qui est l'un des divers oxydes connus du chlore. Le dioxyde de chlore est relativement stable dans ses états gazeux et liquide, mais prompt à exploser. En pratique, on ne l'utilise jamais à l'état pur.
Sommaire
Utilisations
- Désinfectant
- Blanchiment du papier, tissus, etc...
Préparation
Le dioxyde de chlore peut être produit avec du chlorate de sodium en solution dans un acide fort par un réducteur par exemple du peroxyde d'hydrogène, du dioxyde de soufre , ou l'acide chlorhydrique,:
Ex:
- 2ClO3- + 2Cl- + 4H+ → 2ClO2 + Cl2 + 2H2O
Autres exemples:
- 2NaClO3 + 4HCl → 2ClO2 + Cl2 + 2NaCl + 2H2O
Cette réaction a le défaut de produire du chlore, on peut la combiner avec la réaction suivante:- 2 NaClO2 + Cl2 → 2 NaCl + 2 ClO2
Mais comme le chlorite de sodium NaClO2 est plus couteux à produire que le chlorate de sodium NaClO3, on préfère la réaction suivante:- 5NaClO3 + 6HCl → 6ClO2 + 5NaCl + 3H2O
Afin d'éviter la manipulation du chlorure d'hydrogène HCl, volatil et corrosif, une autre réaction utilise l'acide sulfurique H2SO4 moins cher et peu volatil.5NaClO3 + 3H2SO4 + NaCl → 6ClO2 + 3Na2SO4 + 3H2O
ou encore avec un réducteur plus puissant le sulfite de sodium Na2SO3 qui donne du dioxyde de soufre SO2 comme intermédaire.
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2
puis:
2NaClO3 + SO2 → 2ClO2 + Na2SO4
au total:2NaClO3 + H2SO4 + Na2SO3 → 2ClO2 + 2Na2SO4 + H2O
Pour diluer le bioxyde de chlore on peut utiliser un réducteur encore plus puissant l'oxolate de sodium Na2C2O4
2NaClO3 + 2H2SO4 + Na2C2O4 → 2ClO2 + 2Na2SO4 + 2CO2 + 2H2O
Le dioxyde de carbone CO2 produit dilue le dioxyde de chlore ce qui diminue le risque.En effet dioxyde de chlore est explosif si sa concentration dans l’air dépasse 10%. Il ne peut donc pas être stocké et acheminé dans une station, il doit donc être préparé in situ.
Références
- National Library of Medicine (US)
- WebElements
- NIST Standard Reference Database
- European Chemicals Bureau
- Fiche de l'Inrs
- ↑ a , b , c , d , e et f DIOXYDE DE CHLORE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « CHLORINE DIOXIDE » sur http://toxnet.nlm.nih.gov, Hazardous Substances Data Bank. Consulté le 23 août 2009
- ↑ « Dioxyde de chlore » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ (en) « Chlorine dioxide » sur ChemIDplus, consulté le 23 août 2009
Liens externes
- Portail de la chimie
Catégories : Produit chimique très toxique | Produit chimique comburant | Produit chimique dangereux pour l'environnement | Produit chimique corrosif | Produit chimique toxique | Oxyde | Composé du chlore
Wikimedia Foundation. 2010.
