- Monoxyde de soufre
-
Monoxyde de soufre 
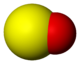

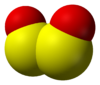
Structure du monoxyde de soufre.
(en bas : « dimère » peroxyde S2O2)Général No CAS PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute SO Masse molaire[1] 48,064 ± 0,005 g·mol-1
O 33,29 %, S 66,72 %,Unités du SI & CNTP, sauf indication contraire. Le monoxyde de soufre est un composé chimique de formule SO. Cette molécule est instable du point de vue thermodynamique et n'existe telle quelle qu'à l'état gazeux dilué ; elle dimérise en S2O2 à l'état condensé, parfois appelé peroxyde de soufre. C'est la raison pour laquelle le monoxyde de soufre a été détecté dans l'espace mais n'existe pas naturellement sur Terre.
La molécule SO est caractérisée par un état fondamental triplet[2], comme la molécule O2, c'est-à-dire que chaque molécule possède deux électrons non appariés de spin parallèle, chacun sur une orbitale atomique propre. La liaison S-O a une longueur de 148,1 pm, supérieure à celle des molécules S2O (146 pm), SO2 (143,1 pm) et SO3 (142 pm)[2].
La molécule peut être excitée dans un état singulet par absorption d'un photon infrarouge. Cet état singulet est supposé plus réactif que l'état triplet, comme ce qui est observé pour la molécule O2.
Du monoxyde de soufre peut être produit en laboratoire par décharge luminescente à travers des vapeurs de soufre mêlées de dioxyde de soufre SO2[2] et a pu être détecté par sonoluminescence dans une solution d'acide sulfurique concentré contenant des gaz nobles[3]. Un détecteur de monoxyde de soufre à chimiluminescence a également été publié[4], reposant sur les réactions :
Le monoxyde de soufre existe naturellement dans l'environnement du satellite Io de la planète Jupiter, aussi bien dans son atmosphère[5] que dans son exosphère[6], et a été détecté dans l'atmosphère de Vénus[7], la comète Hale-Bopp[8] et le milieu interstellaire[9].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Norman N. Greenwood, A. Earnshaw, « Chemistry of the Elements », Butterworth-Heinemann, 2e édition, Oxford, 1997. ISBN 0080379419.
- (en) « The temperatures of single-bubble sonoluminescence » K. S. Suslick et D. J. Flannigan, dans The Journal of the Acoustical Society of America, (2004) 116, 4, 2540.
- (en) Richard L. Benner, Donald H. Stedman, « Chemical Mechanism and Efficiency of the Sulfur Chemiluminescence Detector », dans Applied Spectroscopy, vol. 48, no 7, juillet 1994, p. 14A-21A et 775-903 [texte intégral (page consultée le 27 novembre 2010)]
DOI:10.1366/0003702944029901 - (en) Emmanuel Lellouch, « Urey Prize Lecture. Io's Atmosphere: Not Yet Understood », dans Icarus, vol. 124, no 1, novembre 1996, p. 1-21 [texte intégral (page consultée le 27 novembre 2010)]
DOI:10.1006/icar.1996.0186 - (en) C. T. Russell et M. G. Kivelson, « Detection of SO in Io's Exosphere », dans Science, vol. 287, no 5460, 17 mars 2000, p. 1998-1999 (ISSN 0036-8075) [texte intégral (page consultée le 27 novembre 2010)]
DOI:10.1126/science.287.5460.1998 - (en) Chan Y. Na, Larry W. Esposito, Thomas E. Skinner, « International Ultraviolet Explorer Observation of Venus SO2 and SO », dans Journal of Geophysical Research – Atmospheres, vol. 95, no D6, 1990, p. 7485-7491 [texte intégral (page consultée le 27 novembre 2010)]
DOI:10.1029/JD095iD06p07485 - (en) D. C. Lis, D. M. Mehringer, D. Benford, M. Gardner, T. G. Phillips, D. Bockelée-Morvan, N. Biver, P. Colom, J. Crovisier et D. Despois, et al., « New Molecular Species in Comet C/1995 O1 (Hale-Bopp) Observed with the Caltech Ssubmillimeter Observatory », dans Earth, Moon and Planets, vol. 78, no 1-3, 1998, p. 13-20 [texte intégral (page consultée le 27 novembre 2010)]
DOI:10.1023/A:1006281802554 - (en) C. A. Gottlieb, E. W. Gottlieb, M. M. Litvak, J. A. Ball et H. Penfield, « Observations of interstellar sulfur monoxide », dans Astrophysical Journal, Part 1, vol. 219, 1er janvier 1978, p. 77-94
DOI:10.1086/155757
Catégories :- Oxyde
- Composé du soufre
Wikimedia Foundation. 2010.
