- Cystéine
-
Cystéine 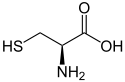
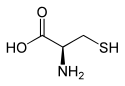
L ou R(+)-cystéine et D ou S(-)-cystéineGénéral Nom IUPAC acide (R)-2-amino- 3-mercapto-propanoïque Synonymes C, Cys No CAS (racémique)
L ou R(+)
D ou S(–)No EINECS L
DNo E E920 L FEMA L Propriétés chimiques Formule brute C3H7NO2S [Isomères] Masse molaire[1] 121,158 ± 0,009 g·mol-1
C 29,74 %, H 5,82 %, N 11,56 %, O 26,41 %, S 26,47 %,pKa 1,91
8,14
10,28Propriétés physiques T° fusion 240 °C Solubilité 280 g·l-1 dans l'eau (25 °C) Propriétés biochimiques Codons UGU, UGC pH isoélectrique 5,07 Acide aminé essentiel Non Occurrence dans les protéines humaines 1,9 % Précautions Directive 67/548/EEC 
XnPhrases R : 22, SIMDUT[2] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. La cystéine est un acide-α-aminé naturel qui possède un groupement sulfhydryle ou thiol et qui est présent dans la plupart des protéines, bien que seulement en petites quantités. Sa présence dans les protéines est très importante, notamment parce qu'elle permet la formation des ponts disulfures. Le groupement thiol est très fragile : il s'oxyde très facilement. Son oxydation conduit à la cystine, qui consiste en deux molécules de cystéine unies par un pont disulfure. Une molécule d'eau (H2O) est le produit secondaire de la création de chaque molécule de cystine. Un oxydant plus énergique [précision nécessaire] peut oxyder la cystéine sur son soufre en donnant l'acide cystéique, à l'origine de la taurine (produit de décarboxylation, présent dans la bile sous forme de taurocholate).
Différentes réactions sont utilisées pour « protéger » les thiols des cystéines, ou pour réduire les ponts disulfures, en particulier :
- Déplacement par un large excès de thiols libres
- par des monothiols de type R-SH. Le plus couramment utilisé est le 2-mercaptoéthanol : HO − CH2 − CH2 − SH
- par des dithiols cyclisables, par exemple le dithiothréitol : HS − CH2 − CHOH − CHOH − CH2 − SH
- Alkylation des thiols libres
Le blocage par alkylation est couramment utilisé lors de l'étude des protéines. Il utilise en particulier l'iodoacétamide conduisant à une carboxyamidométhylation.

La cystéine peut être prise comme complément alimentaire sous forme de N-acétylcystéine (NAC).
Sommaire
Application
Les moutons ont besoin de cystéine pour produire de la laine, c'est un acide aminé essentiel qu'ils ne peuvent pas synthétiser. Ils doivent donc le trouver dans leur alimentation. Cela signifie que durant une période de sécheresse, les moutons arrêtent de produire de la laine.
Le génie génétique a réussi à créer des moutons capables de produire leur propre cystéine.
La cystéine est autorisée comme additif alimentaire et porte le numéro E920.
Production
L'acide L-cystéique peut être produite à partir de plumes dissoutes dans de l’acide chlorhydrique.
Aliments sources de Cystéine
- levure de bière
- germe de blé
- ail
- oignon
- chou de Bruxelles
- brocoli
- produits laitiers
- noix
- graines
- Fonio
- Fruits de mer
- poisson
- oeufs
- viande
Action dans le corps humain
La cystéine intervient dans la synthèse de la mélanine, le pigment naturel de la peau et des cheveux.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Cystéine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Voir aussi
Articles connexes
Liens externes
- (en) http://www.chemie.fu-berlin.de/chemistry/bio/aminoacid/cystein_en.html
- (en) nature hydrophobe de la cystéine.
- (fr) Étude pilote sur la tolérabilité de l'ingestion d'un isolat de protéine riche en cystéine (Immunocal) chez les autistes
- Déplacement par un large excès de thiols libres
Wikimedia Foundation. 2010.
