- 71-00-1
-
Histidine
Histidine 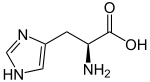
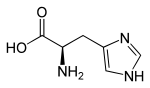
L-Histidine (haut) et D-Histidine (bas) Général Nom IUPAC acide (S)-2-amino-3-(1H-imidazol-4-yl)propanoïque Synonymes H, His No CAS (L)
(D)No EINECS
(D)FEMA Propriétés chimiques Formule brute C6H9N3O2 [Isomères] Masse molaire 155,1546 g∙mol-1
C 46,45 %, H 5,85 %, N 27,08 %, O 20,62 %,pKa 1,70
6,04
9,09Propriétés physiques T° fusion 287 °C Propriétés biochimiques Codons CAU, CAC, pH isoélectrique 7,59 Acide aminé essentiel oui, sauf pour les adultes Précautions SIMDUT[1] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. L'histidine (His) est un des 20 acides aminés codés génétiquement dans l'ADN. D'un point de vue nutritionnel, l'histidine est considérée chez l'Homme comme un acide aminé essentiel (pour les nourrissons). Sa chaîne latérale a un caractère basique et comporte un cycle imidazole.
Sommaire
Fonction dans les protéines
L'histidine est un acide aminé qui remplit des fonctions importante dans la structure et la fonction des protéines. Le noyau imidazole de l'histidine dispose d'un atome d'azote pouvant capter un proton, avec un pKa proche de la neutralité (pKa~6.8) et donc des conditions physiologiques. Cette propriété est cruciale pour la fonction de certaines protéines:
- Elle permet à certains résidus d'histidine présents dans les sites actifs d'enzymes d'intervernir dans des réactions de transfert de proton, dans les conditions physiologiques du cytoplasme (pH~7).
- Dans l'hémoglobine, les histidines présentes dans la protéine participent au maintien du pH sanguin, en agissant comme molécule tampon.
L'azote du cycle imidazole des histdines peut également former des liaisons de coordination avec des ions métalliques comme Zn2+, Co2+, Fe2+ ou Ni2+. Ces liaisons sont importantes pour la fixation de ces ions dans des métalloprotéines, où la complexation du métal est requise pour l'activité de la protéine. On trouve par exemple une histidine comme ligand axial du fer dans la myoglobine et l'hémoglobine et deux histidines dans la complexation du Zinc présent dans la collagénase, une protéase qui dégrade le collagène.
Autres rôles
Purification par chromatographie d'affinité métallique
La propriété de fixation des ions métalliques par l'histidine est à la base d'une technologie de purification de protéines recombinantes appelée chromatographie d'affinité pour ions métalliques immobilisés ((en) IMAC, pour immobilized metal affinity chromatography).
Le principe de cette méthode est le suivant: par génie génétique, on ajoute à la protéine une séquence contenant au moins six histidines consécutives (étiquette poly-histidine). Cette étiquette est capable d'intéragir fortement avec des ions métalliques. On utilise cette propriété pour fixer la protéine ainsi étiquetée sur une résine chromatographique sur laquelle est chélatée un ion métallique. Après lavage des protéines non retenues, la protéine est ensuite éluée par une solution d'imidazole qui déplace la protéine de l'ion métallique par compétition.
Dérivés de l'histidine
Par méthylation de l'histidine en 1, ou en 3, on obtient des acides aminés méthylés présents dans l'urine de l'homme. Cet acide aminé également est un précurseur de la biosynthèse de l'histamine (vasodilatateur) et de la carnosine.
Liens externes
- (en) Histidine biosynthesis (early stages)
- (en) Histidine biosynthesis (later stages)
- (en) Histidine catabolism
- (en) Computational Chemistry Wiki
- (en) http://www.chemie.fu-berlin.de/chemistry/bio/aminoacid/histidin_en.html
Références
- ↑ « Histidine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Ala | Arg | Asn | Asp | Cys | Glu | Gln | Gly | His | Ile | Leu | Lys | Met | Phe | Pro | Ser | Thr | Trp | Tyr | Val Acide aminé essentiel | Protéine | Peptide | Code génétique - Portail de la biochimie
- Portail de la chimie
Catégories : Acide aminé essentiel | Imidazole
Wikimedia Foundation. 2010.