- C4H8Cl2S
-
Gaz moutarde
Gaz moutarde 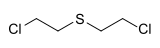
Formule du gaz moutarde (sulfure de 2,2'-dichlorodiéthyle) Général No CAS PubChem SMILES InChI Propriétés chimiques Formule brute C4H8Cl2S [Isomères] Masse molaire 159,077 g∙mol-1
C 30,2 %, H 5,07 %, Cl 44,57 %, S 20,16 %,Propriétés physiques T° fusion 13,5 °C[1] T° ébullition 216 °C[1] Solubilité 684 mg/L dans l'eau à 25 °C[1] Pression de vapeur saturante 0.11 mmHg à 25 °C[1] Précautions Directive 67/548/EEC 
TTransport - 2927 Classification du CIRC Groupe 1 : Cancérogène pour l'homme[2] Unités du SI & CNTP, sauf indication contraire. Le gaz moutarde est un composé chimique cytotoxique, vésicants avec la capacité de former de grandes vésicules sur la peau exposée.
Il a été particulièrement utilisé comme arme chimique pendant la Première Guerre mondiale.
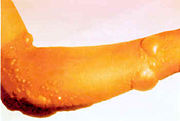
Sous sa forme pure et à température ambiante, c'est un liquide visqueux incolore et sans odeur qui provoque des cloques sur la peau. Il attaque également les yeux et les poumons.
Son nom vient d'une forme impure du gaz moutarde dont l'odeur ressemblait à celle de la moutarde, de l'ail ou du raifort. Il est aussi nommé parfois ypérite (dérivé du nom de la ville d'Ypres (Ieper) en Belgique où il fut pour la première fois utilisé au combat le 11 juillet 1917[3]), moutarde au soufre, Kampfstoff LOST, ou gaz LOST. Il peut être létal mais sa première fonction est d'être très fortement incapacitant.Sommaire
Origine
Sa première synthèse connue remonte à 1860 et fut réalisée par Frederick Guthrie, mais il est possible que ses premiers développements remontent à César Despretz aux alentours de 1822.
V. Meyer publia un article en 1886 expliquant une synthèse produisant un bon rendement.
L'abréviation allemande LOST provient de la combinaison des noms de LOmmel et STeinkopf qui développèrent un procédé de production en masse pour l'utilisation militaire alors qu'ils travaillaient pour l'entreprise allemande Bayer AG.
En urgence, les alliés découvrirent que le chlorure de soufre, se fixant sous pression sur l’éthylène, permettait une fabrication trente fois plus rapide que celle du procédé allemand. Ce fut un facteur essentiel pour gagner la seconde bataille de la Marne[réf. nécessaire].
Protestations et pollution
Comme en témoigne l'appel de la Croix rouge lancé aux belligérants contre l'emploi de gaz vénéneux[4] du 6 février 1918, alors que les usines de munitions commencent à augmenter la fabrication d’armes chimiques pour atteindre environ 1/3 de la fabrication à la fin de l'automne 1918, l'usage des gaz "vénéneux" suscitera l'indignation de nombreux groupes et personnalités dans tous les camps, néanmoins dans la course aux armements se traduira par une production continue et massive d'armes chimiques jusqu'à la fin de la guerre froide. Ce n'est que 70 ans plus tard que des décisions importantes visant l'interdiction et la destruction de ces armes seront prises. Entre temps, des centaines de milliers de tonnes de munitions ont été immergées en mer, incluant des obus à l'ypérite devenus source durable de risque pour l'homme et les écosystèmes.
Essais
Chien portant masque à gaz. En 1914-18, des chiens étaient utilisés comme mascotte, comme animal de trait, pour transporter des plis, ou par les services sanitaires pour signaler les blessés. On a tenté de les protéger comme les chevaux par des masques, quand ils ne servaient pas de cobayes (cf. témoignage ci-contre).
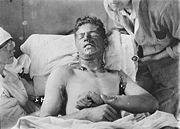
L'ypérite attaque prioritairement les muqueuses humides (poumons, lèvres), la peau moite et les yeux, rendant les victimes aveugles, ce qui complique encore leur prise en charge et les soins.
« A 4h. corvée de chiens. C'est ainsi que l'on nomme la corvée qui consiste à mener au champ de tir des chiens pour les asphixier à obus asphixiants. Donc à 4h. nous 17 types allons au chenil chercher 34 chiens (2 chiens chacun). Il y en avait 3 de très chics surtout un épagneul. Nous les conduisons en voiture au champ de tir.
Là nous les attachons dans deux tranchées distantes de 20 m. après le repérage et le réglage par quelques coups. Les chiens prêts, une dizaine de camions automobiles et des autos arrivent chargés d'officiers depuis les généraux jusqu'au sous-lieutenant. Lorsque tout le monde s'est en allé à 50 et 20 m. en hauteur, les tirs commencent. Alors les 75 commencent des coups secs. On en tire environ 100.
Tous les chiens ne sont pas morts en partie. Encore une vingtaine d'aboiements. C'est alors que les 155 se mettent à tirer. Un long sifflement puis un fort éclatement. Après 55 obus tirés, les tirs sont finis et n'étant pas très loin j'arrive un des premiers. Ils y avaient 5 survivants et 2 qui avaient réussis à se sauver pendant le tir.[...] Ce qui était épatant c'est que les généraux jusqu'au sous-lieutenant nous adressaient la parole comme je te parle. Les gaz ont une forte odeur de Kirsch. »
Alerte au gaz
Sur le front occidental, Joffre se fait fort d'user les troupes allemandes déployées face à lui et de percer leurs lignes en lançant de puissantes offensives. En 1915, six grandes offensives sont donc lancées par les alliés : deux en Champagne, trois en Artois et une sur la Woëvre. celles-ci ne doivent pas occulter les nombreuses opérations dites "secondaires" conduites de part et d'autre du front comme en Flandres, sur le Chemin des Dames, en Argonne, dans les Vosges afin de procéder "à des rectifications du front" où simplement venant appui. ces combats qui ont lieu, bien souvent, dans la pluie, la boue et le froid, consistent à prendre une hauteur, reconquérir une position perdue. Au-delà de ces actions d'usure dans laquelle la guerre des mines joue un rôle important, sans peser réellement sur le cours des événements, Joffre cherchera, en vain à renouer avec guerre de mouvement. Les Allemands solidement retranchés, résistent, coûteusement parfois, mais toujours avec succès, aux desseins français, utilisant si nécessaire l'emploi de nouvelles armes comme le gaz. En effet, le 22 avril 1915, prés d'Ypres, ils lâchent dans l'asmosphère 150 tonnes de chlore. Poussé par le vent, le nuage dérive vers les lignes alliés. Chez les Français, essentiellement les Bretons et Normands du 10e CA, c'est la débandade, les corps de centaines de soldats asphyxiés se mêlent aux milliers d'agonisants.
Cette première attaque aux gaz intoxique 5 200 soldats qui mourront dans les heures qui suivent : les 73e, 74e, 76e, 79e et 80e R.I.T, le 1er régiment de tirailleurs Algériens, le 2e régiment de Zouaves, les Belges et les Canadiens.
Utilisation dans d'autres conflits
- 1918, par les Allemands à Verdun et dans la Marne
- 1919, par les Britanniques en Afghanistan[réf. nécessaire]
- 1925, par la Grande-Bretagne, sur la population, au Kurdistan (dans la région de Mossoul), par ordre de Winston Churchill [réf. nécessaire]
- 1925, par l'Espagne et la France pendant la guerre du Rif
- 1934-35, par l'Italie durant son occupation de l'Éthiopie [réf. nécessaire]
- 1934-44, par le Japon contre la Chine [réf. nécessaire]
- 1963-67, l'Égypte l'utilise au Yémen [réf. nécessaire]
- 1983-1988, le régime de Saddam Hussein l'utilise contre les populations kurdes au nord de l'Irak. Le gaz a également été déployé durant la guerre opposant l'Irak à l'Iran.
Après la guerre du Golfe, plusieurs centaines de tonnes de gaz moutarde sont éliminées en Irak par l'UNSCOM.
Chimie
Chimiquement, le gaz moutarde appartient à la famille des thioéthers et a pour formule : C4H8Cl2S. Sa dénomination chimique est sulfure de 2,2'-dichlorodiéthyle. Certains additifs permettent de le rendre gazeux.
Plusieurs variantes ont vu le jour :
- H, HS ou moutarde de Levinstein : fabriquée grâce à la réaction sous contrôle entre de l'éthylène et du monochlorure de soufre. Sans distillation, le résultat contient 20 à 30 % d'impuretés ce qui fait qu'elle ne se conditionne pas aussi bien que la version HD.
- HD, nommée Pyro par les Britanniques. Gaz moutarde distillé et pur à environ 96 %. Le terme de gaz moutarde se réfère généralement à cette variante.
- HT, nommé Runcol par les Britanniques. Cette variante était obtenue par la réaction entre du thiodiglycol et du chlorure de soufre.
- HL, un mélange entre la variante HD et la lewisite (L), le gaz fut testé dans les années 1920.
- HQ, un mélange entre la variante HD et la sesquimoutarde (Q). Cette dernière formule est due à Gates et Moore en 1946.
Effets
L’ypérite est un puissant vésicant. Sous forme de vapeurs, il attaque les voies respiratoires. Les yeux sont atteints avec une cécité temporaire et la peau en contact avec le produit devient inflammée. Les zones moites de la peau sont plus touchées, ainsi que les muqueuses sensibles. La réaction cutanée évolue en cloques remplies de liquides au bout de 4 à 8 heures si aucun traitement n’est administré. Dispersé sous forme de particules, le gaz s’introduit dans le système respiratoire et détruit les muqueuses avec une détresse respiratoire. Les poumons sont atteints avec des emphysèmes et des œdèmes consécutifs à la présence de fluides qui peuvent entraîner une mort similaire à la noyade si la dose est très forte.
À terme, le patient présente une anémie, une baisse de la résistance immunitaire et développe une prédisposition aux cancers. L’ypérite est en effet un agent mutagène et ceci même à de faibles concentrations. En effet, il peut entraîner une lésion grave : rupture simultanée de deux liaisons phosphodiester homologues, entraînant une cassure de la double hélice d'ADN.[5]Les lésions des tissus mettent beaucoup de temps à guérir et s'apparentent à de sévères brûlures. En cas d'ingestion d’aliments contaminés, on assiste à une perte de poids importante et des troubles digestifs. Sous forme liquide, l'ypérite peut contaminer des zones de manière durable ce qui augmente le risque de contamination par ingestion ou contact avec des objets souillés. Elle reste durablement active à l'abri de l'air, et dans l'air en dessous de 6°C.
Témoignage d'un kurde, concernant une attaque de l'armée irakienne, dans les années 1980 : « Une odeur d'ail et de fruits pourris m'a d'abord mis en alerte, puis les gens que je croisais se plaignaient de ne plus pouvoir respirer, ils avaient de violentes quintes de toux et des brûlures aux yeux. »
Utilisations non militaires
Les moutardes azotées sont utilisées dans le traitement des cancers, en entrant dans la composition de certaines chimiothérapies dites cytotoxiques. Leurs propriétés médicales ont été découvertes peu après la fin de la Première Guerre mondiale.
Notes et références
- ↑ a , b , c et d ChemIDplus
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ Daniel Riche, La Guerre Chimique et Biologique, Belfond, Paris, 1982, ISBN 2-7144-1518-0, p. 104
- ↑ Appel aux belligérants contre l'emploi de gaz vénéneux
- ↑ Encyclopaedia Universalis Thesaurus, article "Radiobiologie" par Ethel Moustacchi et Raymond Devoret, p 462 à 465
Liens internes
Liens externes
- (fr) Guerre des gaz
- (fr) Armes chimiques
- (fr) Ypérite
- (fr) Thèse très complète sur l'Ypérite, ses effets et les études consacrées au gaz
- Portail de la chimie
- Portail de l’histoire militaire
- Portail de la Première Guerre mondiale
Catégories : Produit chimique toxique | Arme chimique | Cancérogène chimique | Gaz toxique
Wikimedia Foundation. 2010.