- Benfluorex
-
Benfluorex 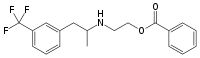
Général Nom IUPAC benzoate de (RS)-2-({1-[3-(trifluorométhyl)phényl]propan- 2-yl}amino)éthyle Synonymes benfluramate
S780
SE780
N-(2-benzoyloxyéthyl)norfenfluramineNo CAS No EINECS Code ATC BX06 PubChem SMILES InChI Propriétés chimiques Formule brute C19H20F3NO2 [Isomères] Masse molaire[1] 351,3628 ± 0,0174 g·mol-1
C 64,95 %, H 5,74 %, F 16,22 %, N 3,99 %, O 9,11 %,Écotoxicologie DL50 2 300 mg·kg-1 (souris, oral)[2]
108 mg·kg-1 (souris, i.p.)[3]LogP 4,670[4] Données pharmacocinétiques Biodisponibilité 0 % Métabolisme 1. norfenfluramine-éthanoate
(ou S1475)[5]
2. norfenfluramine
3. N-(2-hydroxyéthyl)norfenfluramine (ou S422)Excrétion principalement rénale des métabolites Considérations thérapeutiques Voie d’administration Orale Unités du SI & CNTP, sauf indication contraire. Le benfluorex est le principe actif du Mediator[6] ; “benfluorex” est la dénomination commune internationale attribuée par l'OMS en 1971 au composé SE780 des laboratoires Servier[7]. Il dérive de la norfenfluramine, une molécule très proche de l'amphétamine[5], et qui est aussi un métabolite du benfluorex[5]. Il fait partie de la famille des fenfluramines. La toxicité du benfluorex a conduit à l'arrêt de sa commercialisation, en dernier lieu en 2009 en France. Les autres fenfluramines, également toxiques[5], n'étaient plus commercialisées depuis 1997[8].
Il a été commercialisé de 1976 à 2009 en France par le groupe Servier, notamment comme médicament traitant le diabète de type II, dit « gras » (car associé à la surcharge pondérale), puis prescrit aux patients désireux de perdre du poids[9].
Avant 2009, plus de 300 000 patients en ont reçu chaque année. Au moins deux millions de personnes ont consommé ce médicament depuis 1976. Sept millions de boîtes ont été vendues chaque année pour un chiffre d’affaires de 300 millions d’euros. Suite aux travaux d'Irène Frachon, médecin, le médicament a été interdit de commercialisation fin 2009.
L'Agence française de sécurité sanitaire des produits de santé (Afssaps) a estimé en novembre 2010 que ce médicament avait causé au moins 500 morts en France[10]. Toutefois des chiffres plus alarmants circulent : en décembre 2010, une étude menée par des épidémiologistes mandatés par l'Afssaps a estimé qu'en tenant compte des décès encore à venir, le nombre de victimes du Mediator se situerait plutôt entre 1 000 et 2 000 morts[11]. À propos de ces chiffres, Jacques Servier, président-fondateur du laboratoire, a estimé que « 500 [était] un très beau chiffre marketing, mais il ne s'agit que de trois morts », entraînant ainsi la stupéfaction de Xavier Bertrand, ministre de la santé[12] (Deux médecins travaillant pour le laboratoire fabricant le Mediator étaient aussi conseillers auprès du ministre de la santé quand il a prorogé le remboursement du médicament en 2006[13]).
Sommaire
Historique
- 1960 : Albert Weissman et al. (1960) publient au congrès de la Société américaine de pharmacologie et de thérapeutique sur la norfenfluramine. Sa pharmacologie se caractérise par un effet anorexigène sans stimulation notable du système nerveux central. La conclusion des auteurs est la suivante : “It is concluded that P-1727 (code de la norfenfluramine dans cette publication) retains much of the anorectic potency of amphetamine in rats without concomitant behavioral stimulation, as measured by operant conditioning techniques”. C’est à partir de cette publication princeps d’A. Weissman que le développement de composés trifluorés de la phényléthylamine s’est effectué, donnant naissance au groupe des fenfluramines et notamment la fenfluramine, la D-fenfluramine et le benfluorex. Goudie et al. en 1974 (Psychopharmacologia) confirmeront chez le rat ces propriétés anorexigènes de la norfenfluramine ; ils concluent qu’une partie au moins des effets de la fenfluramine est due à celle de son métabolite principal la norfenfluramine : « The data reported in this paper provide evidence which implicates norfenfluramine as a mediator of the actions of fenfluramine »[14].
- 1967 : Laszlo Beregi et al. (groupe Servier) déposent une demande de brevet aux États-Unis couvrant le benfluorex (notamment pour ses propriétés anorexigènes)[15]. Un brevet sera également délivré dans différents pays européens dont la France[16].
- 1970 : Jacques Duhault et C. Malen, deux chercheurs du laboratoire Servier, présentent le benfluorex, un nouveau dérivé des fenfluramines[17].
- 1971 :
- L'OMS attribue le nom de benfluorex au composé SE780 du groupe Servier[18], le suffixe « -orex » étant le segment-clé attribué par la nomenclature de l'OMS aux agents anorexigènes[19].
- Publication d'une étude sur "l'épidémie" d'HTAP survenue en Suisse suite à l'utilisation de l'aminorex comme coupe-faim[20].
- 1973 : Servier envoie une requête à l'OMS pour que le benfluorex ne soit plus reconnu comme un dérivé amphétaminique anorexigène et soit rebaptisé « benzaflumine » ou « benflurate », mais sa demande est refusée[21].
- 1974 : Le ministère de la santé accorde l'autorisation de mise sur le marché au benfluorex, non pour son action anorexigène, mais comme « adjuvant » au régime dans deux indications : hypertriglycéridémies et diabète chez les patients en surcharge pondérale[5]. En août 2011, deux anciens chercheurs du laboratoire Servier, Jean Charpentier et Jacques Duhault, déclareront aux juges que les caractéristiques anorexigènes du Mediator (du fait de sa nature amphétaminique) ont été cachées pour en faire un antidiabétique, afin de faciliter l'obtention de cette autorisation de mise sur le marché (AMM)[22].
- 1976 : Mise sur le marché du benfluorex sous le nom commercial de Mediator pour les deux indications mentionnées en 1974 : hypertriglycéridémies en complément d'un régime, et chez les diabétiques en surpoids[17].
- 1976 : Un article de décembre 1976 de la revue Pratiques souligne que le Mediator est un dérivé de l’amphétamine et que cette caractéristique, peu mise en évidence par Servier, doit être connue des prescripteurs, afin de surveiller les réactions des malades. L'article conclut : « Dans quelques années, quand on commencera à savoir un petit bout de la vérité, ça en fera déjà des millions de boîtes de Mediator vendues ! »[23]. La revue Pratiques ou les cahiers de la médecine utopique, du Syndicat de la médecine générale, publie de nouveau un article critique de trois pages, en février 1977[24].
- 1977 : Servier dépose une demande d'autorisation de mise sur le marché belge pour le benfluorex. Après évaluation du dossier, la Commission des médicaments belge émet un «avis défavorable» du fait de l'insuffisance de données relatives aux effets à long terme du médicament. Servier fait appel de cette décision[25].
- 1977 : Henri Pradal, médecin et co-auteur du Dictionnaire critique des médicaments, édition 1977-1978, souligne la proximité des formules du Mediator et du Pondéral, et son absence d'efficacité attendue. (ref : rapport IGAS)
- 1978 : La Commission des médicaments belge confirme son «avis défavorable». L'Inspection générale de la pharmacie belge écrit que «les nouvelles données cliniques fournies (…) ne permettent pas de considérer que le produit exerce une activité hypolipidémiante ou hypoglycémiante». La commission évoque également «l'effet anorexigène de la molécule»[25].
1981-1991
- Octobre 1981 : Publication de deux cas ("strong evidence") d'hypertension artérielle pulmonaire sous fenfluramine[26].
- 1988 - 1991 : la littérature scientifique fait état de ce que certains des effets principaux et secondaires de la fenfluramine (Pondéral) sont dus à son métabolite N-déalkylé, la norfenfluramine[27],[28],[29]. Le fabricant, Servier, a connaissance de ce que le Mediator donne chez l'humain ce même métabolite, la norfenfluramine, à des concentrations voisines de celles mesurées après Pondéral[30].
1993-1999
- 1993 : Publication par François Brenot et al. d'une étude rétrospective établissant le risque d'hypertension artérielle pulmonaire (HTAP) sous fenfluramine[31].
- 1995 : À l'occasion d'une enquête sur les anorexigènes (coupe-faim), le comité de pharmacovigilance interdit le benfluorex dans les préparations magistrales[32].
- 1996 : Publication des résultats de l'enquête IPPHS (International Primary Pulmonary Hypertension Study) demandée par les laboratoires Servier au professeur Lucien Abenhaïm, laquelle montre le risque des anorexigènes type fenfluramine, sans mentionner le benfluorex[33]. Malgré cette étude, l'Isoméride est autorisé par la FDA aux États-Unis, en raison de l'importance du problème de l'obésité. Lucien Abenhaïm dit ne pas avoir été au courant à l'époque de la proximité entre le Mediator et la fenfluramine.
- 1997 : Les fenfluramines, en particulier l'Isoméride, sont rendues responsables aux États-Unis de valvulopathies cardiaques ainsi que d'hypertension artérielle pulmonaire (HTAP) et sont interdites dans leur ensemble aux États-Unis, ainsi que dans la plupart de l'Europe[17]. Aux États-Unis, près de 4 milliards de dollars d'indemnisation seront obtenus lors de « class actions ». La France suspend l'AMM de l'Isoméride[32].
- 1997 : Une enquête de pharmacovigilance sur le benfluorex est lancée en France. En effet, le médicament est détourné comme anorexigène, et son métabolisme donne le même composé toxique que l'Isoméride : la norfenfluramine.
- 1997: En Suisse, le benfluorex (vendu sous le nom de "Mediaxal") est retiré du marché par l'Institut helvétique d'homologation et de contrôle des médicaments, Swissmedic[34], en raison de "doutes" sur son innocuité.
- 1998 : L'Union régionale des caisses d'assurance-maladie (URCAM) de Bourgogne montre que plus d'un tiers des prescriptions se situent hors autorisation de mise sur le marché (AMM), le Mediator ayant pris le relais de l'Isoméride comme coupe-faim[32]. Elle souligne l'association du Mediator à des traitements à visée amaigrissante : « Au-delà des aspects de santé publique liés à des prescriptions inutiles, voire dangereuses pour la santé, le constat d'une utilisation en dehors du champ des indications reconnues et valides pose également une question d'ordre économique ». Un tiers des prescriptions du Mediator (35 %) sont ainsi faites hors AMM[35].
- 1998 : La commission d'autorisation de mise sur le marché note « l'absence d'efficacité du benfluorex sur l'hypertriglycéridémie »[17].
- 1998: L'assurance-maladie met en garde par courrier l'Agence du médicament sur "l'utilisation non contrôlée d'un produit de structure amphétaminique, dans un but anorexigène", le Mediator (benfluorex)[35].
- 1998 : L'utilisation du benfluorex dans les préparations magistrales est interdite en France[36].
- Septembre 1998 : À la demande des autorités sanitaires italiennes, le Mediator fait l'objet d'une enquête au niveau européen, dont la France et l'Italie sont les rapporteurs. Les interrogations portent sur la similitude chimique entre l'Isoméride (interdit à la vente) et le Mediator (benfluorex). Aucune suite n'est donné à l'enquête[37].
- 21 septembre 1998 : Dans une lettre au directeur général de l'Agence du médicament, Jean-René Brunetière, trois médecins-conseils, le Pr Hubert Allemand, médecin-conseil de la Caisse nationale de l'Assurance Maladie (CNAM), le Pr Claudine Blum-Boisgard (CANAM), le Pr Patrick Choutet (Mutuelle Sociale Agricole) écrivent : « Il nous apparaîtrait opportun de procéder à une réévaluation de l'utilité du Mediator dans la stratégie thérapeutique de la maladie diabétique et dans celle des hyperlipidémies. » « Il nous semble utile d'alerter l'Agence du médicament sur l'utilisation non contrôlée d'un produit de structure amphétaminique, dans un but anorexigène. Il est en effet assez paradoxal de constater que la prescription de Mediator est tout à fait libre, tandis que celle des médicaments du groupe des amphétaminiques est strictement encadrée depuis mai 1995 »[37],[38].
- Février 1999 : Georges Chiche, cardiologue, déclare un cas d’insuffisance aortique chez un patient ayant reçu du Mediator à Marseille (Centre PHV), sans suite donnée[39]'[32], cette insuffisance aortique étant, par erreur, considérée comme la conséquence d'un infarctus.
- Juin 1999 : Une patiente de l'hôpital Saint Joseph consulte à l'hôpital Antoine Béclère pour son HTAP. Le professeur Simonneau est alerté par la prise par la patiente de Mediator et découvre la similitude de la molécule avec l'Isoméride, qu'il a déjà contribué à faire interdire. Il alerte la pharmacovigilance.
- 1999 : La Commission de la transparence estime l'intérêt du Mediator « insuffisant dans ses deux indications » et propose - en vain - son déremboursement[32]. Il reste remboursé à 65 %, mais en principe réservé aux diabétiques en surpoids. Du fait de leur toxicité, tous les amphétaminiques sont retirés du marché, sauf le Mediator[17].
- 1er octobre 1999 : Selon un compte-rendu de la Commission nationale de pharmacovigilance, «Le benfluorex (dénomination commune du Mediator) a fait l'objet d'une enquête «officieuse» dès 1995 en raison de sa parenté structurale avec les anorexigènes amphétaminiques. Cette enquête est devenue officielle en mai 1998.»[37]
- Octobre 1999 : Un rapport réalisé par des experts italiens (Dr Giuseppe Pimpinella et Dr Renato Bertini Malgarini) à la demande de l'Agence européenne du médicament souligne la similitude entre l'Isoméride et le benfluorex : Il existe des suspicions que les patients traités au benfluorex sont exposés à un niveau potentiellement toxique de norfenfluramine. Trois comprimés de Mediator conduisent à produire autant de norfenfluramine que deux comprimés d'Isoméride (posologies quotidiennes pour chacun de ces médicaments). Enfin, ils relèvent que l'activité thérapeutique du Mediator pour les obèses ayant un diabète de type 2 (non insulino-dépendant) est inférieure à celle de la metformine, un antidiabétique de référence[40].
2000-2005
- 2000: L. Fitzgerald et al.[41]évoquent le rôle d'un métabolite dans l'induction des valvulopathies associées à la dexfenfluramine (tout comme à la fenfluramine) : la norfenfluramine (qui est aussi l'un des deux métabolites principaux du benfluorex).
- 2000: Sur sa base de données en ligne, le Conseil national de l'Ordre des médecins (CNOM) publie près de 80 dossiers de sanctions de médecins libéraux pour mauvaise prescription du Mediator : "Prescription de Mediator hors autorisation de mise sur le marché et absence d'indication sur l'ordonnance de son caractère non remboursable" ; "A prescrit du Mediator en l'absence d'hypertriglycéridémie ou de diabète avec surcharge pondérale", "A prescrit des médicaments à effet diurétique (...) en association avec du Mediator pour des personnes désireuses de maigrir (...) (associé au) caractère dangereux de ces thérapeutiques"[35].
- décembre 2000 : Publication d'un article mettant en évidence le rôle des récepteurs 5-HT2B dans les HTAP et les atteintes valvulaires, et suggérant que tous les médicaments à activité sérotoninergique soient étudiés et suspendus en cas d'action sur ces récepteurs[42].
- 2002 : L'Afssaps interdit une publicité du laboratoire Servier. L'étude sur laquelle elle était fondée n'était pas conforme aux dispositions de l'AMM et ne démontrait pas la valeur ajoutée du médicament[17].
- 28 mars 2003 : Un premier cas d'insuffisance valvulaire cardiaque est décrit en Espagne[43].
La molécule est retirée par le laboratoire, suite aux questions qui lui sont posées sur sa pharmacodynamie, et avant la date prévue de son renouvellement d'AMM. Selon les autorités espagnoles, « le benfluorex a été retiré en 2003 à la demande du fabricant en raison de sa possible implication dans les valvulopathies cardiaques »[36].
- Octobre 2003 : La revue Prescrire appelle à rester vigilant vis-à-vis des dérivés amphétaminiques.
- 2004 : Le Mediator est retiré du marché en Italie[36].
- 2005 : L'Espagne interdit les préparations médicinales à base de benfluorex, en rappelant les risques de valvulopathies[36].
- 2005 :
- Le centre de pharmacovigilance de Besançon pointe dans un rapport des cas de HTAP chez des patients ayant pris du Mediator[44].
- La Commisioon nationale de pharmacovigilance considère que les cas d'HTAP signalés sont peu nombreux, et peuvent correspondre à l'incidence des HTAP idiopathiques. Elle ne mentionne pas le problème des valvulopathies. Elle propose "d'étudier la possibilité d'interroger les registres HTAP existants des 17 centres, afin de rechercher, dans une étude rétrospective cas-témoins, le rôle éventuel du benfluorex"[45].
- Prescrire est la première publication à demander le retrait du Mediator[46],[47]
2006
- 2006 : Le Mediator n’est plus commercialisé qu’au Portugal, à Chypre et en France.
- 2006 : Un cas de valvulopathie sous Mediator chez une patiente de 48 ans sans antécédent est publié par le Pr Montastruc, médecin au CHU de Toulouse et membre de la Commission nationale de pharmacovigilance[17]. Survenant après sept notifications spontanées, cette nouvelle déclaration ne conduit pas à l'interdiction. La commission d'AMM renouvelle l'autorisation quinquennale du Mediator, se contentant de supprimer l'une de ses indications mineures[32].
- Juin 2006 : La revue Prescrire rapporte trente-cinq cas français de troubles psychiatriques et de dix-sept cas d'hypertension artérielle pulmonaire (HTAP) associés au Mediator[17]. La revue médicale Prescrire s’étonne, une nouvelle fois, du maintien sur le marché du benfluorex (Mediator) par le laboratoire Servier[44].
2007
- 2007 : Servier ne demande pas le renouvellement de l'AMM du Mediator en Italie[32].
- 2007 : L'autorisation de mise sur le marché (AMM) est renouvelée en France (88 % des ventes mondiales de Mediator) pour le diabète, et supprimée pour l'hypertriglycéridémie. De nouvelles études sont demandées. Le dictionnaire des médicaments Dorosz mentionne le risque de valvulopathie sous Mediator.
2008
- 7 avril 2008 : Dans un courriel au centre de pharmacovigilance de Brest, un des directeurs du groupe Servier déclare que le Mediator « se distingue radicalement des fenfluramines »[17].
2009
- Février 2009 : Onze cas de valvulopathies sous Mediator sont signalés à l'Afssaps par le CHU de Brest.
- 3 juin 2009 : Irène Frachon, médecin au CHU de Brest se rend à l'Afssaps à Saint-Denis, à un groupe de travail intitulé «Plan de gestion des risques et pharmaco-épidémiologie» et fait part de ses inquiétudes concernant le lien entre valvulopathies et prise de Mediator.
- 10 juin 2009 : Après la réunion du 3 juin 2009 à l'Afssaps, l'épidémiologiste Catherine Hill envoie un mail à tous les experts de l'Afssaps. Elle évoque un « signal particulièrement clair » entre la prise du médicament et valvulopathies. Elle juge « très peu prudent d'attendre pour agir » et note que « si nous étions aux États-Unis, le risque de procès serait très élevé ». Elle rappelle que le médicament a été retiré du marché en Espagne « pour les mêmes raisons » depuis plusieurs années[48].
- 7 juillet 2009 : Irène Frachon se rend à la Commission nationale de pharmacovigilance. Il est demandé aux Laboratoires Servier de faire une étude de type cas-témoins, qui peut prendre des années et nécessiter d'étudier des milliers de cas[48].
- Juillet 2009 : Selon une étude d'Irène Frachon, du CHU de Brest, « 70 % des malades souffrant d’atteintes inexpliquées de leur valvule mitrale ont été exposés à une prise de Mediator, contre 6 % chez les malades ayant une cause connue de valvulopathie »[44].
- 4 septembre 2009 : Nouvelle réunion à l'Afssaps avec l'équipe du CHU de Brest. Il existerait un lien très fort entre valvulopathies et prise de Mediator[48].
- 29 septembre 2009 : La Commission nationale de pharmacovigilance de l'Afssaps conclut qu'il n'est pas possible de laisser les patients face à un tel risque.
- 7 octobre 2009 : Malgré les alertes, une autorisation de mise sur le marché (AMM) est délivrée pour deux génériques du Mediator aux laboratoires Mylan et Qualimed[48].
- Octobre 2009 : Une étude par la Caisse nationale d'assurance maladie dans sa base de données d'une cohorte d'un million de diabétiques montre que le risque de chirurgie valvulaire est multiplié par près de 4 pour les patients exposés au Mediator.
- 23 octobre 2009 : La Commission nationale de pharmacovigilance de l'Afssaps note «un signal relatif aux anomalies des valvules cardiaques soupçonné depuis plusieurs mois par les données de pharmacovigilance». À la fin de la réunion, la commission ne rend pas d'avis[48].
- 12 novembre 2009 : L'autorisation de mise sur le marché (AMM) du benfluorex (Mediator et ses génériques) est suspendue[48].
- 25 novembre 2009 : L’Afssaps décide de suspendre le Mediator[49], ainsi que les deux génériques du Mediator qui venaient d'obtenir une AMM le 7 octobre. Selon l'Agence, un seul cas confirmé de valvulopathie cardiaque associée au Mediator a été déclaré jusqu’à la fin 2008.
- 30 novembre 2009 : Le benfluorex (Mediator et ses génériques) est retiré des pharmacies[48].
2010
- avril 2010 : Irène Frachon publie son étude sur l'association entre valvulopathie et prise de benfluorex[50].
- 2 juin 2010 : Le groupe Servier publie dans le Quotidien du médecin et le Quotidien du pharmacien un communiqué déclarant : « Face aux nombreuses inexactitudes parues dans la presse grand public, à ce jour, aucun lien de causalité direct n'a été démontré entre la prise du médicament et les valvulopathies »[32].
- 7 juin 2010 : Irène Frachon publie le livre Mediator 150 mg, combien de morts ? (editions-dialogues.fr, 150 p.) qui raconte son histoire. L'éditeur est attaqué en justice par le laboratoire Servier[51]. Le sous-titre « Combien de morts? » est censuré [5].
- 14 juin 2010 : La décision définitive d'interdiction par l'Agence européenne est prise, avec cet avis : « Le lien entre benfluorex et valvulopathie est établi[32] ».
- 25 juin 2010 : Une thèse soutenue par Flore Michelet, docteur en pharmacie de l'Université de Rennes I, intitulée Utilisation de nouveaux outils en pharmacovigilance : à propos du retrait du Mediator (benfluorex), relève que 300 000 personnes ont été chaque année exposées au Mediator[32]. Selon cet auteur, « il semblerait qu'il y ait eu ces dernières années entre 150 et 250 hospitalisations chaque année en France liées directement à une toxicité du Mediator, ayant entraîné une trentaine de décès. Si nous multiplions par 30 ans de commercialisation, le nombre de morts pourrait être entre 500 et 1 000 »[52]
- 14 octobre 2010 : Publication dans la revue Pharmacoepidemiology and Drug Safety de l'étude de la CNAM montrant que le Mediator multipliait par 3 le risque de valvulopathie et par 4 le risque de chirurgie valvulaire[53].
- 16 novembre 2010 : Selon une réunion de la Commission nationale de pharmacovigilance, une analyse de données de la CNAM-TS faite par l’épidémiologiste Catherine Hill (qui dirige le service d'épidémiologie des cancers de l'Institut Gustave-Roussy à Villejuif) confirme les premiers travaux qu’avait révélés Le Figaro en octobre 2010[54]. Selon ces études, le benfluorex (Mediator) serait bien responsable de 500 à 1 000 morts en France[52]. Le laboratoire Servier estime de son côté que ces chiffres sont des « hypothèses fondées sur des extrapolations ».
- 16 novembre 2010 : L’Afssaps estime à 500 le nombre de morts imputés au Mediator. 3 500 personnes ont été hospitalisées. 80 % des complications se produisent dans les deux années qui suivent l'arrêt du traitement. Elle annonce une série de mesures, en particulier une campagne d’information pour rechercher tous les patients qui ont pu prendre ce produit. Elle recommande aux personnes qui ont pris du Mediator pendant plus de trois mois de consulter leur médecin traitant[55].
- 21 novembre 2010 : Selon Jacques Servier, l'affaire du Mediator est une « fabrication »[56].
- 3 décembre 2010 : Dans une lettre adressée aux médecins français, le Denys Schutz, médecin, directeur général de Servier-Biopharma écrit : «Les principes actifs de Mediator et d'Isoméride sont différents, tant en termes de structures chimiques que d'effets biologiques (...) ou en termes de métabolisme»[40].
- Décembre 2010 : Martine Aubry, Bernard Kouchner et Martin Hirsch affirment n'avoir jamais été alertés[57],[58]. Xavier Bertrand affirme avoir pris connaissance de la dangerosité du Mediator en novembre 2010[59].
2011
- Suite à un rapport[5] accablant de l'IGAS sur le Mediator[60], Xavier Bertrand lance une réforme du système français de pharmacovigilance[61].
- Parution en avril d'un article[62] estimant au minimum à 500 la mortalité attribuable au benfluorex (Mediator). L'article résume les données démontrant la toxicité cardiaque du médicament et explique la méthode utilisée pour l'estimation.
- août 2011: Deux anciens chercheurs des Laboratoires Servier, Jean Charpentier et Jacques Duhault, déclarent aux juges que les caractéristiques anorexigènes du Mediator (du fait de sa nature amphétaminique) ont été cachées pour en faire un antidiabétique, afin de faciliter l'obtention de son autorisation de mise sur le marché (AMM)[22].
Données cliniques
Indications thérapeutiques
Contre-indications
Propriétés pharmacologiques
Selon l'IGAS, le laboratoire a trompé les autorités sanitaires. Le benfluorex n'a aucune activité pharmacologique propre ; il est le précurseur d'une molécule active (et toxique), la norfenfluramine, proche de l'amphétamine. Selon le rapport de l'IGAS, « Cet « aveu » de ce que le benfluorex ne serait qu’un précurseur, c’est-à-dire une molécule n’ayant en elle-même aucune activité pharmacologique, les laboratoires Servier ont cherché, après l’avoir reconnu, à le faire oublier, en retirant une phrase évoquant cette caractéristique d’un document communiqué à l’Afssaps en 1999 »[5](en gras dans le texte).
Propriétés pharmacodynamiques
Le benfluorex (Mediator) et l'Isoméride agissent tous deux par l'intermédiaire d'un métabolite identique, la norfenfluramine[63] ; ils ont donc des caractéristiques pharmacologiques très proches[64] :
- Hypolipidémiant,
- Hypocholestérolémiant,
- Hypoglycémiant,
- Anorexigène[65]
Les deux produits ont une efficacité hypoglycémiante prouvée en double insu contre placebo, mais cette efficacité est moindre que celle des antidiabétiques de référence comme la metformine.
Le métabolite toxique pour les valves cardiaques produit par ces deux médicaments est la norfenfluramine. La norfenfluramine n'est pas présente dans les comprimés d'Isoméride ou de Mediator : elle est produite par la modification de ces médicaments - ou métabolisme - dans l'organisme.
Le niveau d'exposition à la norfenfluramine est similaire, que l'on prenne du Mediator ou de l'Isoméride[37], mais variable d'une personne à l'autre. On ne connaît pas les facteurs associés à cette variabilité.Propriétés pharmacocinétiques et métabolisation
Le benfluorex est complètement métabolisé. Il ne circule dans le plasma sanguin qu’à des taux indétectables, car « immédiatement transformé en son métabolite S422, puis en métabolite S1475 et en norfenfluramine (S585) », qui est un puissant anorexigène[5].
Pharmacovigilance
Interdiction
Le Mediator a échappé à l'interdiction de 1997. Lors de son retrait à la fin novembre 2009[66], environ 200 000 patients étaient encore traités par le benfluorex.
Une partie des données montrant le lien entre le benfluorex et une atteinte des valves cardiaques se trouve dans deux articles parus récemment[67],[68].
Procédures judiciaires
Initialement, quatre plaintes ont été déposées contre Servier après le retrait du Mediator[69]. La famille d’un patient décédé et un autre patient souffrant de valvulopathie cardiaque ont déposé plainte contre X au TGI de Nanterre pour « tromperie aggravée sur la nature, la qualité substantielle et la composition du produit », « mise en danger de la vie d’autrui », « administration de substance nuisible » et « homicide involontaire »[70]. La plainte a été déposée auprès du Parquet de Nanterre, car le siège social des laboratoires Servier se trouve dans les Hauts-de-Seine. Elle sera instruite par le Pôle de santé publique du TGI de Paris.
- Mi février 2010, deux informations judiciaires contre X avaient été confiées à des juges d'instruction du pôle de santé publique du tribunal de grande instance de Paris. Le 18 février, le Procureur de la République annonçait l'ouverture de deux informations judiciaires :
- La première vise les chefs de «tromperie aggravée par la mise en danger de l'homme, ainsi que ceux d'ingérence et de prise illégale d'intérêt pour la période du 23 novembre 1973 (date de la demande d'AMM) et jusqu'au 20 juillet 2010 (date du retrait définitif du marché)».
- La seconde information concerne des faits présumés «d'homicides involontaires par violation manifestement délibérée d'une obligation de sécurité ou de prudence imposée par la loi ou le règlement et de blessures involontaires aggravées ayant entraîné une incapacité»[71].
- 21 septembre 2011 : Jacques Servier a été mis en examen pour tromperie et escroquerie : la commercialisation d'un médicament présenté comme un antidiabétique, alors que c'est essentiellement un anorexigène, pour bénéficier de la prise en charge par l'Assurance maladie et les mutuelles est susceptible de constituer une escroquerie.
- 27 octobre 2011 : la Cour de cassation a suspendu deux instances, dans l'attente que soit réglée une demande de Servier de regroupement à Paris : la citation directe déposée à Nanterre et l'instruction menée par les juges d'instruction du Pôle de santé publique du TGI de Paris. Si la demande devait aboutir, le premier procès pénal du Mediator, prévu à Nanterre dans six mois, serait annulé, dans l'attente d'un procès à Paris d'ici plusieurs années[72].
Jacques Servier
Dans un livre intitulé "Le médicament : inventer ou mourir", publié aux éditions de La table ronde en 1982, Jacques Servier présentait son point de vue sur l'industrie du médicament, plaidant pour une plus grande liberté pour les industriels de la pharmacie et regrettant les contrôles trop couteux, « étouffants » pour la créativité, ainsi qu'une tendance à l' « alourdissement des contrôles ». Il y estimait que « le plus désastreux chez nous est la multiplicité des initiatives des pouvoirs publics. Tant d'instances accumulent les réglementations qu'elles réussissent à créer une atmosphère de harcèlement administratif incompatible avec la vie » et en considérant que « c'est le bon sens des dirigeants de l'industrie pharmaceutique, coloré d'une véritable obsession d'éviter toute possibilité d'accident. Jamais les médicaments n'en sortent (des laboratoires) avant que des animaux en aient absorbé des échantillons »[73].
Dans les années 1990, les laboratoires Servier dominaient le marché des coupe-faim, médicaments augmentant la sensation de satiété, en particulier à l'égard des sucres, et sans les effets excitants et toxicomanogènes des produits plus anciens, avec deux produits : l’Isoméride puis le Mediator. L'Isoméride, soupçonné de favoriser l’hypertension artérielle pulmonaire (HTAP), sera retiré du marché en 1997.
Dans les années 1990, le directeur scientifique de Servier fut le trésorier de la Société française de pharmacovigilance et de thérapeutique[39]. Début 2011, Pierre Schiavi, directeur de la division scientifique « Pharmacologie et gériatrie » chez Servier, était aussi trésorier de la Société française de pharmacologie et de thérapeutique[74].
Jacques Servier, président et fondateur du Laboratoire Servier, a été fait grand-croix de la Légion d'honneur par le président de la République française, Nicolas Sarkozy, le 31 décembre 2008. Ce dernier a précédemment été un des avocats du groupe Servier[75].Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- "International Symposium on Amphetamines and Related Compounds, Proceedings, Mario Negri Institute for Pharmacological Research, Milan, 1969," Costa, E., and S. Garattini, eds., New York, Raven Press, 1970Vol. -, Pg. 21, 1970
- "International Symposium on Amphetamines and Related Compounds, Proceedings, Mario Negri Institute for Pharmacological Research, Milan, 1969," Costa, E., and S. Garattini, eds., New York, Raven Press, 1970Vol. -, Pg. 21, 1970.
- (en) « 23602-78-0 » sur ChemIDplus, consulté le 16/11/2010
- Rapport et annexes sur le Médiator, par l'IGAS, commandé par le Ministre du Travail de l’emploi et de la santé et la Secrétaire d'État chargée de la Santé, pour mettre en lumière la succession des évènements et des choix portant sur ce médicament afin de comprendre les mécanismes de prises de décision
- et des génériques “Benfluorex 150mg Mylan" et "Benfluorex 150mg Qualimed"
- Chronique OMS volume 25, n° 3 de mars 1971.
- L'article Fenfluramine#cite note-Chrolonogie-retrait-3 donne des indications sur la chronologie du retrait des fenfluramines dans plusieurs pays vers la fin de l'année 1997.
- Le Mediator serait responsable de 500 à 1 000 morts en France, Le Monde, 13 octobre 2010
- Mediator: Bertrand recommande à tous les patients de consulter, dépêche Agence France-Presse
- http://www.lefigaro.fr/sante/2010/12/17/01004-20101217ARTFIG00513-mediator-une-etude-evoque-1000-a-2000-deces.php
- Mediator : Bertrand «stupéfait» par les propos de Servier, Le Parisien, 06 janvier 2011
- Canard Enchaîné 12janvier2011
- http://www.afssaps.fr/content/download/29421/387796/version/4/file/Benfluorex_Donnees-pharmacologiques.pdf Philippe Lechat (2010) Propriétés pharmacologiques du benfluorex
- US 3,607,909
- brevet français FR 6564M
- Pourquoi l'affaire du Mediator a-t-elle mis si longtemps à éclater ?, Le Monde, 23 novembre 2010
- Chronique OMS volume 25, n° 3 de mars 1971
- OMS, The use of common stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances, Geneve, 2002, pp. 89-90
- J M Kay et coll, Aminorex and the pulmonary circulation, Thorax, mai 1971.
- Mediator : l'enfant "caché" de l'amphétamine, Science et Avenir, 18 janvier 2011
- Le laboratoire Servier mis en cause pour un autre médicament, le Protelos, Le Monde, 7 septembre 2011
- Article du site Marianne, « Mediator : critiqué en 1976, dès sa mise sur le marché ».
- http://tempsreel.nouvelobs.com/actualite/societe/20110909.OBS0048/exclusif-mediator-la-preuve-des-mensonges-de-servier.html
- Dès 1977, les Belges refusent de commercialiser le Mediator, Le Figaro, 31 janvier 2011
- J.G Douglas et coll, Pulmonary hypertension and fenfluramine, British Medical Journal, octobre 1981
- http://www.ncbi.nlm.nih.gov/pubmed/2458444?dopt=Abstract
- http://www.sciencedirect.com/science/article/pii/0091305790901333
- http://www.sciencedirect.com/science/article/pii/037843479180584Y
- B.H. Gordon (1993) The pharmacokinetics of the metabolites of benfluorex in chronic administration [...in human volunteers Servier Report No. 93-5792-001]
- [1] F. Brenot et coll, Primary pulmonary hypertension and fenfluramine use, British Heart Journal, décembre 1993
- Mediator : Combien de morts ?, Le Monde, 24 août 2010
- L. Abenhaïm et coll, Appetite-suppressant drugs and the risk of primary pulmonary hypertension, New England Journal of Medecine, 29 août 1996
- Le Mediator interdit en Suisse dès 1997, Le Monde, 21 janvier 2011
- Mediator : le conseil de l'ordre sanctionnait les surprescriptions, Le Monde, 18 décembre 2010
- En 2003, l'Espagne retire le Mediator du marché, Le Figaro, 23 novembre 2010
- Mediator: l'Assurance maladie mettait en garde dès 1998, Le Figaro, 17 décembre 2010
- "Précisions de l'ancien directeur général de l'Agence du médicament" Le Figaro, 11 janvier 2011
- Mediator, coupe-faim dangereux et longtemps toléré, Libération, 16 novembre 2010
- Des experts avaient alerté des dangers du Mediator dès 1999, Le Figaro, 22 décembre 2010
- [PDF] Possible Role of Valvular Serotonin 5-HT2B Receptors in the Cardiopathy Associated with Fenfluraminehttp://molpharm.aspetjournals.org/content/57/1/75.full.pdf
- Rothman et coll : Evidence for possible involvement of 5-HT2B receptors in cardiac valvulopathy associated with fenfluramine and other serotonergic medications. Circulation, décembre 2000
- Rafel Ribera J, Casañas Muñoz R, Anguera Ferrando N, Batalla Sahún N, Castro Cels A, Pujadas Capmany R, « Valvular heart disease associated with benfluorex », dans Rev Esp Cardiol, vol. 56, no 2, février 2003, p. 215–216 [texte intégral, lien PMID]
- Mediator, la fin du coupe-faim, Libération, 1er juin 2010
- CNPV du 29 novembre 2005, afssaps.fr
- Il faudrait un Prescrire pour le grand public ! sur arretsurimages.net. Mis en ligne le 21 janvier 2011, consulté le 23 janvier 2011
- "En Espagne, la survenue sous benfluorex de troubles cardiaques graves, semblables à ceux observés avec la fenfluramine et la dexfenfluramine, est à l'origine du retrait du marché des spécialités pharmaceutiques contenant du benfluorex, en mars 2003. La revue Prescrire estime que les autorités françaises seraient bien avisées de suivre l'exemple de l'Espagne. ©Prescrire 1er septembre 2005."
- Octobre 2009: Quand l'Afssaps autorisait les génériques du Mediator…, Le Figaro, 20 décembre 2010
- Décision de l'AFSSAPS
- [http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0010128 Irène Frachon et coll., Benfluorex and unexplained valvular heart disease : a case-control study, PLoS ONE, avril 2010
- Le livre Mediator, combien de morts ? attaqué en justice. Décision le 7 juin, Le Télégramme de Brest, 1er juin 2010
- Comment s'est construite l'estimation de 500 morts dues à la prise du Mediator, Le Monde, 30 novembre 2010
- Mediator : une deuxième étude confirme le risque, Le Figaro, 15 octobre 2010
- Le Mediator serait responsable de 500 à 1 000 décès en France, Le Figaro, 13 octobre 2010
- Le Mediator aurait fait 500 morts en 30 ans, selon l'Afssaps, Le Monde, 16 novembre 2010
- L'affaire du Mediator®, une « fabrication » selon Servier, Le Figaro, 21 novembre 20100
- http://www.lejdd.fr/Societe/Sante/Actualite/Mediator-Kouchner-ancien-secretaire-d-État-charge-de-la-Sante-n-etait-pas-au-courant-245237/
- http://www.lexpress.fr/actualite/politique/scandale-du-mediator-ces-ministres-qui-ne-savaient-pas_946677.html
- http://www.lefigaro.fr/sante/2010/12/19/01004-20101219ARTFIG00200-mediator-bertrand-denonce-de-graves-defaillances.php
- Médicament : des mesures urgentes pour restaurer la confiance (IMPACT MEDECINE n° 347 p. 4-5 - 20/1/2011) notice 1856
- la pharmacovigilance va faire peau neuve : du passé, table rase - Le Quotidien du Médecin, n° 8885, p. 4, 14/1/2011
- Hill C., Mortalité attribuable au benfluorex (Mediator), La Presse Médicale, 2011, vol. 40, pp. 462-469. DOI:10.1016/j.lpm.2011.03.001, article.
- ou son énantiomère S, pour l'Isoméride
- MEDIATOR-BIAM
- ISOMERIDE-BIAM
- Diabète : 3 médicaments retirés, Le Figaro, 26 novembre 2009
- Irène Frachon, Yves Etienne, Yannick Jobic, Grégoire Le Gal, Marc Humbert, Christophe Leroyer, Benfluorex and Unexplained Valvular Heart Disease: A Case-Control Study., PLoS ONE: Research Article, published 12 Apr 2010. DOI:10.1371/journal.pone.0010128.
- Alain Weill, Michel Païta, Philippe Tuppin, Jean-Paul Fagot, Anke Neumann, Dominique Simon, Philippe Ricordeau, Jean-Louis Montastruc and Hubert Allemand, Benfluorex and valvular heart disease: a cohort study of a million people with diabetes mellitus., Parmacoepidemiology and drug safety (2010)
- Le laboratoire Servier dans la tourmente judiciaire, Le Figaro, 4 juin 2010
- Mediator: première plainte au pénal, Libération, 24/11/2010
- [2] Le Figaro aout 2011
- [3] Le Monde du 27 octobre 2011
- Mediator : un médecin guînois exhume un vieux livre de Jacques Servier ; lundi 18.04.2011
- [4] Sénat - Mission commune d'information sur le Mediator
- Mediator, la fin du coupe-faim, Libération, 1er juin 2010
Voir aussi
Liens internes
Liens externes
Catégories :- Affaire ou scandale sanitaire
- Anorexigène
- Médicament retiré du marché français
- Amphétamine
- Benzoate
- Composé trifluorométhylé
- Antidiabétique
Wikimedia Foundation. 2010.
