- Éthane
-
Éthane 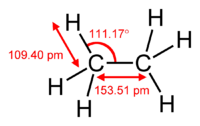
Molécule d'éthaneGénéral Nom IUPAC éthane Synonymes diméthyle
méthylméthane
biméthyleNo CAS No EINECS PubChem SMILES InChI Apparence gaz comprimé liquefié, incolore, inodore à l'etat pur[1]. Propriétés chimiques Formule brute C2H6 [Isomères] Masse molaire[2] 30,069 ± 0,002 g·mol-1
C 79,89 %, H 20,11 %,Propriétés physiques T° fusion -183,3 °C[3] T° ébullition -88,6 °C[3] Solubilité 60,2 mg·l-1 (eau,25 °C)
460 ml·l-1 (éthanol,4 °C)
Sol dans l'éther [4]
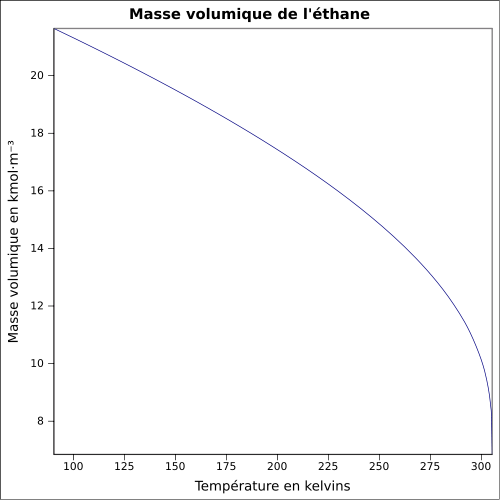
Très sol dans le benzèneMasse volumique 1,3551 kg·m-3 (0 °C, 1 013 mbar, gaz)
0,5441 kg·l-1 (-88,6 °C, 1 013 mbar, liquide)[3]T° d'auto-inflammation 515 °C[3] Point d’éclair -135 °C[3] Limites d’explosivité dans l’air 2,4–14,3 %vol
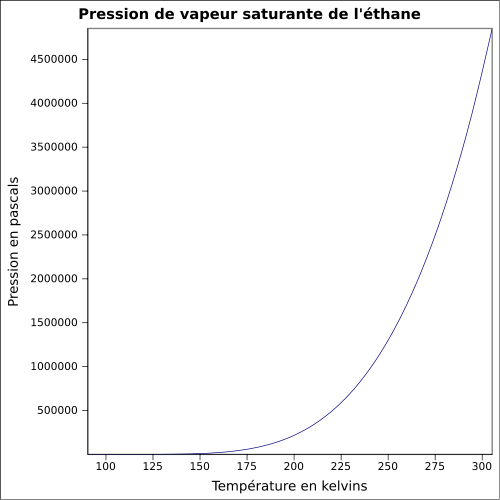
31–182 g·m-3[3]Pression de vapeur saturante 37,8 bar à 20 °C
46,9 bar à 30 °C[3]Viscosité dynamique 63,4 mPo à -78,5 °C[4] Point critique 32,15 °C
49 bar
0,147 l·mol-1 [6]Point triple -182,15 °C
0,011 bar [6]Vitesse du son 1 326 m·s-1 (liquide,-88,6 °C)
312 m·s-1 (gaz,27 °C,1 atm)[7]Thermochimie S0liquide, 1 bar 126,7 J·mol-1·K-1[6] ΔfH0gaz -84,0 kJ·mol-1[6] ΔfusH° 0,583 kJ·mol-1 à -182,81 °C[6] ΔvapH° 9,76 kJ·mol-1 à 25 °C
14,703 kJ·mol-1 à -89,05 °C[6]Cp 52,49 J·mol-1·K-1 (25 °C, gaz)
68,68 J·mol-1·K-1 (-173,15 °C, liquide)[6]PCI -1 560,7 kJ·mol-1[6] Propriétés électroniques 1re énergie d'ionisation 11,56 ± 0,02 eV (gaz)[9] Cristallographie Classe cristalline ou groupe d’espace P21/n [10] Paramètres de maille a = 4,226 Å
b = 5,623 Å
Z = 2 [10]
c = 8,000 Å
α = 90,00 °
β = 90,41 °
γ = 90,00 °Volume 190,10 Å3 [10] Densité théorique 0,525 [10] Précautions Directive 67/548/EEC[11] 
F+Phrases R : 12, Phrases S : 2, 9, 16, 33, Transport[3] 23 1035
223 1961 NFPA 704 SIMDUT[12] 

SGH[13] 

DangerÉcotoxicologie LogP 1,81[1] Unités du SI & CNTP, sauf indication contraire. L'éthane est un hydrocarbure de la famille des alcanes de formule brute C2H6. C'est un gaz combustible, incolore et inodore que l'on peut trouver dans le gaz naturel et aussi dans les gaz du pétrole.
Sommaire
Utilisation
L'éthane est le réactif de base pour la synthèse de l'éthylène via le vapocraquage, de monochloro-, du 1,1-dichloro-, et du 1,1,1-trichloroéthane par chloration. En combinant la chloration avec l'oxychloration, le chlorure de vinyle peut être synthétisé et la réaction de l'éthane avec l'acide nitrique en phase gazeuse permet la formation du nitrométhane et du nitroéthane[14].
L'éthane est un constituant du gaz de pétrole liquéfié qui est un combustible utilisé comme remplaçant du gaz naturel pour des applications particulières.
Propriétés physico-chimiques
L'éthane se décompose à partir d'une température de 500 °C. Sa solubilité dans l'eau et dans l'alcool est meilleure que celle du méthane puisque, à 20 °C, celle-ci est de 4,7 cm-3 pour 100 cm-3 d'eau et de 150 cm-3 pour 100 cm-3 d'alcool.
Production et synthèse
L'éthane est principalement issu de la purification du gaz naturel ou extrait du gaz de pétrole liquéfié, une fraction du pétrole[14].
Écologie
Sur Terre, on mesure des dégagements de l'ordre de quinze mégatonnes de ce gaz dans l'atmosphère par an :
- deux à quatre mégatonnes sont libérées par les volcans de boue, sources géothermales, bassins pétroliers et microfuites de gaz au fond des océans ;
- une dizaine de mégatonnes proviennent des feux de forêt, de l’activitié biologique des océans, de la faune et des êtres humains[15].
Notes et références
- ETHANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Ethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 avril 2009 (JavaScript nécessaire)
- ETHANE sur Hazardous Substances Data Bank. Consulté le 29 novembre 2009
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Ethane » sur NIST/WebBook, consulté le 11 février 2010
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 1er juillet 2010, 91e éd., 2610 p. (ISBN 9781439820773) [présentation en ligne], p. 14-40
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Ethane sur www.reciprocalnet.org. Consulté le 12 décembre 2009
- « éthane » sur ESIS, consulté le 15 février 2009
- « Éthane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, 2000
- Sciences & Vie, On sait ce que la Terre dégaze d’hydrocarbures, nº 1098, mars 2009, p. 34.
Voir aussi
Catégories :- Produit chimique extrêmement inflammable
- Alcane linéaire
- Gaz organique
- Réfrigérant
Wikimedia Foundation. 2010.