- R744
-
Dioxyde de carbone
Dioxyde de carbone représentation 3D du dioxyde de carbone Général Nom IUPAC Dioxyde de carbone Synonymes gaz carbonique
Anhydride carboniqueNo CAS No EINECS No E E290 SMILES InChI Apparence gaz comprimé liquéfié, incolore, inodore.[1] Propriétés chimiques Formule brute CO2 [Isomères] Masse molaire 44,0095 g∙mol-1
C 27,29 %, O 72,71 %,Propriétés physiques T° ébullition -57 °C sous pression Solubilité dans l'eau à 20 °C : 88 mL/100 mL[1] Masse volumique 1,87 kg.m-3 (gaz à 25 °C 1,013 bar)
plus dense que l'airPression de vapeur saturante à 20 °C : 5720 kPa[1] Viscosité dynamique 0,07 mPa.s à -78 °C Point critique 31,1 °C à 7,4 MPa Point triple -56,6 °C à 519 kPa Thermochimie ΔfH0gaz -393,5 kJ.mol-1 Précautions Directive 67/548/EEC Phrases S : 9, 23, 36, [2] Transport 20 1013
22 2187
- 1845 [2]SIMDUT[3] 
Unités du SI & CNTP, sauf indication contraire. Le dioxyde de carbone, communément appelé gaz carbonique ou anhydride carbonique, est un composé chimique composé d'un atome de carbone et de deux atomes d'oxygène et dont la formule brute est : CO2.
Cette molécule linéaire a pour formule développée : O=C=O.
Dans les conditions normales de température et de pression, le dioxyde de carbone est un gaz incolore, inodore et à la saveur piquante.
Il est présent dans l'atmosphère dans une proportion approximativement égale à 0,0375 % en volume, dans cette décennie (années 2000), soit 375 ppmv (parties par million en volume). En 2009, cette proportion atteint 386 ppm[4].
Il est produit notamment lors de la fermentation aérobie ou de la combustion de composés organiques, et lors de la respiration des êtres vivants et des végétaux. Pour ces derniers, la photosynthèse piège beaucoup plus de CO2 que leur respiration n’en produit.Sommaire
Caractéristiques physico-chimiques
À pression atmosphérique, il se sublime à -78,5 °C[2] (passage de l'état solide à l'état gazeux), mais ne fond pas (passage de l'état solide à l'état liquide).
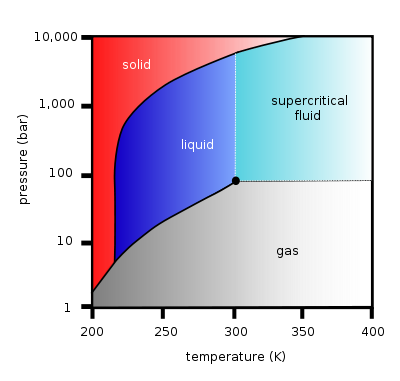
Diagramme de phase pression-température du dioxyde de carbone, montrant le point triple et le point critique. La phase liquide ne peut exister qu'à une pression minimale de 5,19 bar, et dans un intervalle de température allant de -56,6 °C (point triple) à 31,1 °C au maximum à 74 bar (point critique).
Chaleur latente de vaporisation (0 °C) 234,5 kJ.kg−1 Chaleur latente de vaporisation (-16,7 °C) 276,8 kJ.kg−1 Chaleur latente de vaporisation (-28,9 °C) 301,7 kJ.kg−1 Chaleur latente de fusion (à -56,6 °C) 199 kJ.kg−1 Solubilité aqueuse
Le CO2 dissous dans l’eau forme avec elle de l’acide carbonique (H2CO3). Il est aussi liposoluble.
L’acide carbonique n’est que modérément stable et il se décompose facilement en H2O et CO2. En revanche, lorsque le dioxyde de carbone se dissout dans une solution aqueuse basique (soude, potasse...), la base déprotone l’acide carbonique pour former un ion hydrogénocarbonate (HCO3–), aussi appelé ion bicarbonate, puis un ion carbonate (CO32–). C'est ainsi que la solubilité du CO2 est considérablement augmentée.
Par exemple, une solution aqueuse saturée de carbonate de potassium (K2CO3) a une concentration de 112 % (en masse) en carbonate à 120 °C.C'est ainsi que le calcaire se dissout dans l'eau, dans la plage de pH dans laquelle l'hydrogénocarbonate acide est stable, il dissout le calcaire en produisant une solution d'hydrogénocarbonate(s) (de calcium et de magnésium...). Il est donc susceptible de précipiter lorsque le CO2 dissous est dégazé, comme dans la formation des stalagmites et des stalactites.
Ainsi, en présence de CO2, le calcaire a une solubilité suivant celle des gaz (qui diminue avec la température) et non de celle des solides (qui augmente avec la température).Histoire
Le dioxyde de carbone est l'un des premiers gaz à avoir été décrit comme étant une substance distincte de l'air. Au XVIIe siècle, le chimiste et médecin flamand Jean-Baptiste Van Helmont observa qu'en brûlant du charbon de bois en vase clos, la masse des cendres résultantes est inférieure à celle du charbon. Son interprétation était que la masse manquante s'était transmutée en une substance invisible qu'il nomme « gas » ou spiritus sylvestre (« esprit sauvage »)[5].
Les propriétés du dioxyde de carbone furent étudiées plus en détail dans les années 1750 par le chimiste et physicien écossais Joseph Black. Il découvrit qu'en chauffant ou en versant un acide sur du calcaire (roche composée de carbonate de calcium), il en résultait l'émission d'un gaz, qu'il nomma « air fixe », mettant à mal la théorie du phlogiston encore enseignée à cette époque. Il observa que celui-ci est plus dense que l'air et qu'il ne peut ni entretenir une flamme, ni la vie d'un animal. Black découvrit également que lorsque le dioxyde de carbone est introduit dans une solution calcaire (hydroxyde de calcium), il en résulte un précipité de carbonate de calcium. Il utilisa ce phénomène pour illustrer le fait que le dioxyde de carbone est produit par la respiration animale et la fermentation microbienne[6].
En 1772, le chimiste anglais Joseph Priestley publia un ouvrage intitulé Impregnating Water with Fixed Air dans lequel il décrivit un processus consistant à verser de l'acide sulfurique (ou « huile de vitriol » comme on la nommait à cette époque) sur de la craie afin de produire du dioxyde de carbone, puis forçant le gaz à se dissoudre dans un bol d'eau. Il vint en fait d'« inventer » l'eau gazeuse[7]. Le procédé est ensuite repris par Johann Jacob Schweppe qui fonda, en 1790, à Londres une usine de production de soda connue sous le nom de Schweppes.
En 1781, le chimiste français Antoine Lavoisier mit en évidence le fait que ce gaz est le produit de la combustion du carbone avec le dioxygène.
Le dioxyde de carbone fut liquéfié pour la première fois en 1823 par Humphry Davy et Michael Faraday[8]. La première description du dioxyde de carbone en phase solide fut écrite par Charles Thilorier, qui en 1834 ouvrit un container pressurisé de gaz carbonique liquéfié et découvrit que le refroidissement produit par la rapide évaporation du liquide générait de la « neige » de CO2[9],[10].
Utilisations
Sous forme gazeuse
Le CO2 a beaucoup d’utilisations, dont :
- l’extinction des feux : beaucoup de datacenters (salles de serveurs d’ordinateurs) ou de salles des archives sont équipées d’un système qui, en cas d’incendie, remplit la salle de CO2 ce qui a pour effet d’éteindre le feu ;
- composant pétillant dans les boissons gazeuses ;
- en aquariophilie et culture sous serre pour une meilleure croissance des plantes ;
- en emballages à atmosphère contrôlée comme élément neutralisant ;
- en distribution d’eau potable, associé au carbonate, pour relever la dureté de l'eau (TH) des eaux trop agressives ;
- solubilisation du calcaire dans les eaux dures (TH > 25 °F) ;
- les pompes à bière : en étant en contact avec la surface de la bière, il évite son oxydation et prolonge sa conservation, contrairement à un compresseur utilisant de l'air (ambiant) ;
- on se sert aussi parfois du CO2 dans les grands abattoirs de porcs afin de les insensibiliser avant de les saigner.
Sous forme liquide
Sous forme liquide, il est utilisé comme :
- réfrigérant pour congeler certains aliments ;
- réfrigérant dans l’industrie électronique ;
- agent d’extinction dans les extincteurs dits « au dioxyde de carbone », on parle parfois de neige carbonique parce que le CO2 liquide se solidifie immédiatement à la sortie de l’extincteur en produisant une poudre blanche ;
- agent propulseur (et parfois également carbonatant) pour les boissons servies à la pression.
Quand il est utilisé comme fluide frigorigène, le CO2 porte la dénomination R744.
À pression atmosphérique, le dioxyde de carbone n’est jamais sous forme liquide. Il passe directement de la forme solide à la forme gazeuse (sublimation).
Sous forme solide
 Granulats de « glace sèche » se sublimant à l'air.
Granulats de « glace sèche » se sublimant à l'air.
Le dioxyde de carbone sous forme solide a de nombreuses appellations : « glace carbonique », « neige carbonique », « carboglace », « glace sèche ». Il est issu de la solidification du CO2 liquide. On obtient de la neige carbonique qui est ensuite comprimée pour obtenir de la glace carbonique.
Cette glace carbonique se sublime en ne laissant aucun résidu et consomme une grande quantité de chaleur (150 cal/kg, soit 628 J/kg, à -78,5 °C)[réf. nécessaire]. On lui a donc rapidement trouvé de multiples utilisations en tant que réfrigérant.
Il est commercialisé sous différentes présentations selon son usage :
- en pellets (de la taille d'un grain de riz de 3 mm de diamètre) : essentiellement pour le nettoyage et le décapage cryogénique ;
- en sticks (bâtonnet de 16 mm) : pour la conservation, le transport des produits sous température dirigée (produits pharmaceutiques, transport de surgelés, transport d'échantillons, etc.) ;
- pour la recherche fondamentale ou appliquée ;
- pour la vinification : il ralentit la fermentation et évite l'oxydation ;
- en plaquette ou en blocs :
- pour le ravitaillement aérien (catering), les traiteurs, les pompes funèbres, etc.
- en pains :
- pour faire de la fumée épaisse (effets spéciaux, cinéma, vidéo).
Le dioxyde de carbone sous forme solide est également présent en abondance aux pôles de la planète Mars, où il forme de véritables calottes glaciaires.
En phase supercritique
Au-delà de son point critique, le dioxyde de carbone entre dans une phase appelée supercritique. La courbe d'équilibre liquide-gaz est interrompue au niveau du point critique, assurant à la phase supercritique un continuum des propriétés physico-chimiques sans changement de phase. C'est une phase aussi dense qu'un liquide mais assurant des propriétés de transport (viscosité, diffusion) proches de celles d'un gaz. Le dioxyde de carbone supercritique est utilisé comme solvant vert, les extraits étant exempts de trace de solvant.
Sous cette forme, il sert :- à la décaféination du café ;
- à l'élimination de la 2,4,6-trichloroanisole (TCA) des bouchons de liège traités au chlore (ou à l'hypochlorite) pour éviter de donner un goût bouchonné au vin après sa mise en bouteille ;
- à la mise en forme de principes actifs micronisés et sous forme nanométrique ;
- à l'extraction de composés chimiques ou biologiques ;
- à la purification de composés chimiques (phase mobile en chromatographie, notamment en SFC) ;
- pour le transport et le stockage lors de la séquestration géologique du dioxyde de carbone (dans de rares applications industrielles).
Réactivité
L'électronégativité des atomes d'oxygène rend le carbone central très électrophile. De très nombreux nucléophiles peuvent donc réagir avec le dioxyde de carbone mais le produit de la réaction n'est pas forcément stable. En général, on place de la carboglace dans un récipient fermé muni d'un tuyau ; la carboglace se sublime et on fait buller le dioxyde de carbone gazeux dans le milieu réactionnel.
Quelques exemples de réaction :
- avec une amine : on appelle cette réaction une carbonatation. Le produit est un hydrogénocarbonate d'ammonium (R3N + CO2 + H2O → R3NH+HCO3–).
- avec un carbanion : on forme un acide carboxylique après hydrolyse.
- avec l'eau.
Toxicité
L'air contient aujourd'hui environ 0,04 % de CO2. À partir d'une certaine concentration dans l'air, ce gaz s'avère dangereux voire mortel. La valeur limite d'exposition est de 3 % sur une durée de 15 minutes. Cette valeur ne doit jamais être dépassée. Au-delà, les effets sur la santé sont d'autant plus graves que la teneur en CO2 augmente. Ainsi, à 2 % de CO2 dans l’air, l'amplitude respiratoire augmente. À 4 %, la fréquence respiratoire s'accélère. À 10 %, peuvent apparaître des troubles visuels, des tremblements et des sueurs. À 15 %, c'est la perte de connaissance brutale. À 25 %, un arrêt respiratoire entraîne le décès.
Recherche
Le comportement et les impacts de ce gaz dans l'air font l'objet d'une recherche active. 500 scientifiques sont conviés à Iéna (Allemagne) du 13 au 19 septembre 2009 pour faire le point sur la connaissance, lors de la 8ème « Conférence internationale de recherche sur le dioxyde de carbone » (la première date de 1981) [11].
Notes et références
- ↑ a , b et c DIOXYDE DE CARBONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b et c Entrée du numéro CAS « 124-38-9 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 décembre 2008 (JavaScript nécessaire)
- ↑ « Dioxyde de carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Données du NOAA et du Mauna Loa Observatory (MLO).
- ↑ (en) « Carbon Dioxide : Spiritus Sylvestre »Ebbe Almqvist, History of industrial gases, Springer, 2003 (ISBN 9780306472770), p.
- ↑ Sigaud de La Fond, Essai sur différentes espèces d'air-fixe ou de gaz …, Chez P. Fr. Gueffier, Paris, 1785
- ↑ Joseph Priestley, « Observations on Different Kinds of Air », dans Philosophical Transactions, vol. 62, 1772, p. 147–264 (ISSN 0260-7085) [texte intégral lien DOI]
- ↑ Humphry Davy, « On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents », dans Philosophical Transactions, vol. 113, 1823, p. 199–205 (ISSN 0261-0523) [[pdf] texte intégral lien DOI]
- ↑ Charles Thilorier, « Solidification de l'Acide carbonique », dans Comptes rendus hebdomadaires des séances de l'Académie des sciences, vol. 1, 1835, p. 194 [texte intégral]
- ↑ H.D. Roller Duane, « Thilorier and the First Solidification of a "Permanent" Gas (1835) », dans Isis, vol. 43, no 2, 1952, p. 109–113 (ISSN 0021-1753) [lien DOI]
- ↑ A propos de la « 8ème Conférence internationale de recherche sur le dioxyde de carbone » (sur le site de l'Institut Max Planck de biogéochimie, qui en est l'organisateur)
Voir aussi
Articles connexes
- Émissions de CO2
- Gaz à effet de serre
- Cycle du carbone
- Liste des pays par émissions de dioxyde de carbone
- Puits de carbone
Liens externes
- Portail de la chimie
Catégories : Oxyde | Carbonate | Composé du carbone | Gaz inorganique | Produit chimique domestique | Réfrigérant | Gaz à effet de serre | Pollution de l'air
Wikimedia Foundation. 2010.