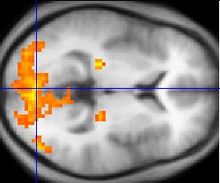
- Imagerie par résonance magnétique
-
L'imagerie par résonance magnétique (IRM) est une technique d'imagerie médicale permettant d'obtenir des vues 2D ou 3D de l'intérieur du corps de façon non-invasive avec une résolution relativement élevée. L'IRM repose sur le principe de la résonance magnétique nucléaire (RMN) qui utilise les propriétés quantiques des noyaux atomiques pour la spectroscopie en analyse chimique[note 1]. L'IRM nécessite un champ magnétique puissant et stable produit par un aimant supraconducteur qui crée une magnétisation des tissus par alignement des moments magnétiques de spin. Des champs magnétiques oscillants plus faibles, dits radiofréquence, sont alors appliqués de façon à légèrement modifier cet alignement et produire un phénomène de précession qui donne lieu à un signal électromagnétique mesurable. La spécificité de l'IRM consiste à localiser précisément dans l'espace l'origine de ce signal RMN en appliquant des champs magnétiques non-uniformes, des « gradients », qui vont induire des fréquences de précession légèrement différentes en fonction de la position des atomes dans ces gradients. Sur ce principe qui a valu à ses inventeurs, Paul Lauterbur et Peter Mansfield le Prix Nobel de physiologie ou médecine en 2003, il est alors possible de reconstruire une image en 2 dimensions puis en 3 dimensions de la composition chimique et donc de la nature des tissus biologiques explorés.
En imagerie médicale, l'IRM est principalement dédiée à l'imagerie du système nerveux central (cerveau et moelle épinière), des muscles, du cœur et des tumeurs. Grâce aux différentes séquences, on peut observer les tissus mous avec des contrastes plus élevés qu'avec la tomodensitométrie ; en revanche, l'IRM ne permet pas l'étude des corticales osseuses (tissus « durs ») trop pauvres en hydrogène, ni donc la recherche fine de fractures où seul l'œdème péri-lésionnel pourra être observé.
L'appareil IRM est parfois désigné sous le nom de scanner, ce qui en français prête à confusion avec le tomodensitomètre. Contrairement à ce dernier (et à d'autres techniques d'imagerie comme la TEP), l'examen IRM n'est pas invasif et n'irradie pas le sujet. Cela en fait donc un outil de prédilection pour la recherche biomédicale, et notamment en neurosciences cognitives. À partir des années 1990, la technique d'IRM fonctionnelle, qui permet de mesurer l'activité des différentes zones du cerveau, a en effet permis des progrès importants dans l'étude des fondements neurobiologiques de la pensée.
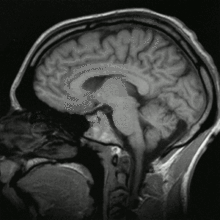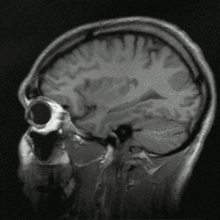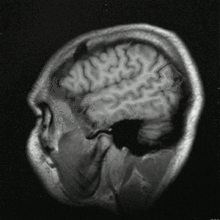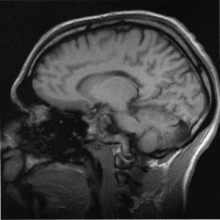 Image IRM d'une tête humaine en pondération T1, en coupe sagittale. La tête est vue de profil, regardant vers la gauche. On y voit le cerveau en gris clair entouré de liquide céphalo-rachidien (en noir), la boîte crânienne et le cuir chevelu ; sur d'autres coupes, on peut voir les globes oculaires et, au niveau du plan médian, différentes structures du névraxe (face interne d'un hémisphère cérébral, corps calleux, cervelet) ainsi que d'autres parties de l'anatomie (langue, fosses nasales, etc.)
Image IRM d'une tête humaine en pondération T1, en coupe sagittale. La tête est vue de profil, regardant vers la gauche. On y voit le cerveau en gris clair entouré de liquide céphalo-rachidien (en noir), la boîte crânienne et le cuir chevelu ; sur d'autres coupes, on peut voir les globes oculaires et, au niveau du plan médian, différentes structures du névraxe (face interne d'un hémisphère cérébral, corps calleux, cervelet) ainsi que d'autres parties de l'anatomie (langue, fosses nasales, etc.)
Histoire
Le principe de l'IRM repose sur le phénomène de résonance magnétique nucléaire (RMN), c'est-à-dire portant sur le couplage entre le moment magnétique du noyau des atomes et le champ magnétique externe, décrit par Felix Bloch et Edward Mills Purcell en 1946. Au début des années 1970, les nombreux développements qu'a connus la RMN, notamment en spectroscopie, laissent entrevoir de nouvelles applications de cette technique. Ainsi, Raymond Vahan Damadian propose dès 1969 d'utiliser la RMN dans un but médical et appuie sa proposition avec la démonstration que la spectroscopie RMN permet la détection de tumeurs[1].
En 1973, un progrès important est accompli : s'inspirant des méthodes de reconstruction d'images utilisées en tomodensitométrie, Paul Lauterbur réalise pour la première fois une « imagerie » (qu'il baptise zeugmatographie) basée sur la RMN en utilisant le principe des gradients qui permettent de capturer l'image d'une « coupe virtuelle » d'un objet en deux dimensions[2]. Simultanément mais de façon indépendante, Peter Mansfield propose une méthode similaire et introduit en 1977 la technique d'imagerie écho-planaire permettant la capture de nombreuses images en un temps relativement court. Le premier objet connu du grand public à avoir été étudié par IRM est un poivron, après un essai sur deux tubes capillaires.
Dans les années qui suivent, la technique évolue rapidement notamment grâce aux progrès réalisés en informatique et en électronique qui permettent de mettre en œuvre des méthodes numériques coûteuses en temps de calcul. Ainsi en 1975, Richard R. Ernst propose d'utiliser la transformée de Fourier pour analyser le codage en fréquence et en phase du signal IRM.
Les premières images de tissus humains seront produites en 1975 par Mansfield ; en 1977 sera réalisée la première image d'un corps humain vivant par Damadian qui dirigera ensuite la fabrication des premiers appareils commerciaux.
La principale innovation dans le domaine de l'IRM viendra avec la reprise par Seiji Ogawa des travaux de Linus Pauling et Charles Coryell sur le magnétisme de l'hémoglobine. En effet, le signal IRM émis par le sang oxygéné diffère du signal du sang désoxygéné. Cette propriété permit donc à Ogawa, John Belliveau et Pierre Bandettini de réaliser en 1992 les premières images du cerveau en fonctionnement : en réponse à des stimulations visuelles, ils purent mesurer une augmentation du débit sanguin cérébral dans les aires visuelles du lobe occipital. La mesure de cette réponse hémodynamique est à la base du fonctionnement de l'imagerie par résonance magnétique fonctionnelle, un outil central des neurosciences cognitives contemporaines.
Après plusieurs années d'évolution, l'IRM est donc devenue une technique puissante du domaine de l'imagerie médicale, lequel est sans cesse en développement. En reconnaissance de « leurs découvertes concernant l'imagerie par résonance magnétique », Peter Mansfield et à Paul Lauterbur furent récompensés par le Prix Nobel de physiologie ou médecine en 2003.
En France, il y a 592 appareils en 2010. Le délai d'attente moyen est de 32 jours[3].
Le centre européen NeuroSpin est en passe de devenir le plus grand centre au monde d'imagerie par résonance magnétique. L'un de ses objectifs est d'élucider le « code neural[4] », autrement dit, connaître comment l’information est codée dans le cerveau.
Technologie
Tunnel de l'aimant
Machine IRM en géométrie fermée 3 Tesla fabriquée par Philips, une antenne de tête est installée en bout de table. On remarque également une sorte de conduit semblable à celui d'une cheminée au-dessus de l'anneau : il s'agit du panneau de pénétration de la salle par lequel passent les différents câbles électriques, le système de refroidissement ainsi que le conduit d'évacuation de l'hélium gazeux en cas de quench.
Il ne concerne que les imageurs fermés, c'est le tunnel dans lequel est introduit le patient. Il a des fonctions de confort (comme l'éclairage et la ventilation) et des moyens de communication entre le personnel soignant et le patient (microphone et haut-parleurs). Son diamètre varie très légèrement en fonction des constructeurs et des modèles mais est approximativement de 60 cm.
Aimant
L'aimant est au cœur du fonctionnement de l'appareil IRM. Son rôle est de produire le champ magnétique principal appelé B0 qui est constant et permanent. L'unité de mesure de la puissance du champ magnétique est le Tesla abrégé par la lettre T. Cette valeur fait référence à l'intensité de ce champ principal.
En 2007, dans le domaine de l'imagerie médicale de routine, les intensités de champs magnétiques utilisées sont comprises entre 0,1 et 7 Tesla, avec des intensités supérieures à 17 Tesla[5] pour l'étude de spécimens murins et petits animaux, et jusqu’à 11,7 Tesla pour les études pré-cliniques et cliniques sur l'Homme.
- Remarque : 1,5 T équivaut à 30 000 fois le champ magnétique terrestre.
- Bas Champ : < à 0,5 T
- Moyen Champ : entre 0,5 T et 1 T
- Haut Champ : > à 1 T
Le champ magnétique statique doit être uniforme dans la section du tunnel. La valeur de champ magnétique statique est mesurée et uniformisée par calibration (transducteur à effet Hall) à l'isocentre de l'aimant et doit couvrir toute la longueur de l'antenne de réception. Les tolérances sont extrêmement critiques particulièrement à haut champ et en spectrométrie Le champ magnétique diminue à mesure que l'on s'éloigne de cet isocentre : on parle alors de champ magnétique résiduel. La répartition des lignes de champ dépend de la puissance du champ magnétique mais également de la présence d'un blindage autour de l'aimant (voir chapitre sur le blindage de champ magnétique).
Les principales qualités pour un aimant sont :
- un champ magnétique d'intensité élevée afin d'améliorer le rapport signal sur bruit ;
- une bonne stabilité temporelle (le champ magnétique doit être le plus permanent possible) ;
- une bonne homogénéité du champ (par exemple : 0,2 parties par million ppm dans une sphère de 36 cm de diamètre ce qui correspond au diamètre moyen d'une antenne émission/réception crânienne : c'est la fenêtre minimum d'homogénéité de champ que doit obtenir le constructeur pour vendre son IRM dans la plupart des pays du monde).
Ces qualités sont recherchées parmi les trois types d'aimants disponibles sur le marché : l'aimant permanent, l'aimant résistif et l'aimant supraconducteur. Aujourd'hui c'est l'aimant supraconducteur qui est le plus répandu.
L'augmentation des champs magnétiques permet une amélioration importante de la qualité des images obtenues par IRM mais certaines personnes s'interrogent sur l'influence de champ magnétique de grande intensité sur le corps humain. Toutefois rien, en 2007, ne mettait en évidence un quelconque effet néfaste sur l'organisme si ce n'est quelques « vertiges » dus à l'induction de faibles courants électriques dans certaines structures nerveuses par les impulsions de radiofréquence. Dans tous les cas, même à champ faible, la présence d'objets ferromagnétiques constituent une contre-indication à l'IRM.
Aimant permanent
Il est constitué d'une structure ferromagnétique qui produit un champ magnétique permanent sans consommation d'énergie. Ces aimants, autrefois très lourds (jusqu'à 90 tonnes avec les ferrites), se sont allégés avec l'arrivée des alliages à base de terre rares (Bore-néodyme-fer). Un aimant de 0,3 T corps entier ne pèse que 10 tonnes. Un 0,4 T pèse 13 tonnes. Bien que l'on puisse faire des aimants permanents de 1 T, il est économiquement difficile d'aller beaucoup plus haut que 0,4 Tesla. Leurs avantages principaux sont l'absence de courant de Foucault, une fiabilité exceptionnelle, une architecture ouverte et un champ vertical perpendiculaire au grand axe du patient, ce qui améliore les performances des antennes. Les systèmes IRM réalisés autour d'aimants permanents ont longtemps fait l'objet de développements limités. Ce n'est plus le cas. Depuis quelques années, ces systèmes se sont hissés à de très bons niveaux de performances. Plus de 8000 systèmes ont été installés dans le monde entier en majorité aux États-Unis et au Japon, de plus en plus en Europe et plus lentement en France. Ils sont devenus moins coûteux, très fiables et efficaces, et la Haute Autorité de santé en France en a reconnu l'intérêt dans un rapport de juin 2008[6] et en préconise l'utilisation en France. Ils constituent également le meilleur choix pour les pays ne possédant pas l'infrastructure technique et logistique permettant de faire fonctionner un système supraconducteur dans de bonnes conditions.
L’utilisation d'un aimant permanent n'est pas sans danger ou problème car ce qui en fait la qualité (la grande stabilité et uniformité de son très puissant champ magnétique) en fait aussi le défaut puisqu'il sera impossible de suspendre le champ magnétique en cas d'urgence (on ne pourra pas appliquer la procédure de quench évoquée ci-dessous dans la section sur les aimants supraconducteurs). L'utilisation de l'appareil se fait donc avec des précautions préalable strictes (y compris par un examen radiographique classique préalable pour détecter des corps métalliques implantés dans des corps mous tels que les vaisseaux sanguins, ou résiduels de certains accidents). Cela nécessite également une surveillance du local d'examen contre la présence ou l'introduction de matériels ferromagnétiques susceptibles d'être projetés contre l'appareil, ou de causer des blessures graves. De plus, avec le temps, des poussières ferromagnétiques peuvent s'accumuler sur l'aimant et y persister, ce qui va progressivement en altérer l'uniformité du champ créé. L'environnement de l'appareil doit donc être tenu très propre, y compris l'air ambiant qui doit être filtré contre la présence de fumées polluantes, puisque le nettoyage de l'aimant sera très difficile ou nécessitera la reconformation du champ magnétique par adjonction d'écrans ou d'aimants complémentaires de correction. L’autre difficulté réside dans le transport et la livraison de l'aimant jusqu'au lieu où il sera déployé, les aimants de cette puissance faisant l'objet de mesures de sécurité spécifiques qui leur interdit par exemple le transport par avion si leur champ ne peut être totalement confiné dans l’emballage ou sa structure de protection et de pose dans l’appareil.
Aimant résistif
Cet aimant est constitué d'un bobinage de cuivre traversé par un courant électrique produisant un champ magnétique en son centre. Ce type d'aimant est assez peu utilisé depuis l'apparition des aimants supraconducteurs.
Il est assez peu coûteux à la fabrication et ne nécessite pas de liquide cryogénique de refroidissement (contrairement aux aimants supraconducteurs). De plus, le champ magnétique peut être annulé en quelques secondes en stoppant le courant (mais il faut attendre la stabilisation du champ lors de la remise sous tension).
Malheureusement, le champ magnétique maximum atteint à peine 0,5 T et reste très sensible aux variations de température. De plus, on constate des problèmes d'homogénéité du champ et une consommation électrique très importante pour alimenter la bobine en courant et pour alimenter les compresseurs du circuit de refroidissement afin de compenser l'effet Joule provoqué par la résistivité de la bobine.
Aimant supraconducteur
En 2008, c'est le type d'aimant le plus répandu. L'aimant supraconducteur utilise le principe de supraconductivité : lorsque certains métaux ou alliages sont soumis à des températures proches du zéro absolu, ils perdent leur résistivité si bien que le passage d'un courant électrique se fait sans perte, donc sans production de chaleur.
L'aimant supraconducteur utilisé en IRM est constitué d'un bobinage de Niobium-Titane (Nb-Ti) baignée constamment dans de l'hélium liquide (près de --269 °C) qui en assure l'état supraconducteur. La résistance électrique nulle ainsi atteinte permet de créer des intensités de champ magnétique très élevées. La bobine est encastrée dans une matrice en cuivre qui sert de puits de chaleur afin de la protéger en cas de perte accidentelle de la supraconductivité (le quench).
Enfin, le système est entouré d'un écran refroidisseur (circuit d'air ou d'eau glacée) qui aide à maintenir l'hélium liquide à très basse température. Le tout est finalement enveloppé d'un espace de vide diminuant les échanges thermiques avec l'extérieur. L'appareil est donc peu sensible aux variations de température ambiante.
Tout cet appareillage rend les appareils à aimant supraconducteur très coûteux à l'achat et, ensuite, à l'utilisation, du fait de leur consommation importante en hélium cryogénique. La supraconductivité permet néanmoins une consommation électrique moyenne ou faible : si elle n'est pas négligeable lors de la mise en courant des bobinages, elle devient ensuite quasi nulle une fois le régime permanent stable établi.
Les bobinages supraconducteurs étant parcourus par des courants beaucoup plus élevés, ils stockent sous forme magnétique une énergie beaucoup plus élevée. Elle devient même considérable pour les bobines de grandes dimensions à 3 T ou plus. Ces équipements sont alors dotés d'équipements sophistiqués et fiables pour la dissiper en toute sécurité en cas de quench.
Géométrie de l'aimant
Il existe deux types d'IRM (en pratique, on appelle IRM la technique comme l'appareil ou imageur):
L'IRM "fermée" est la configuration la plus répandue et la plus connue à l'heure actuelle. Il s'agit d'un tunnel de 60 cm de diamètre pour 2 mètres de long pour les plus anciens et 1,60 mètre de long pour les plus récents. De nouveaux systèmes sont apparus récemment, utilisant des tunnels plus larges jusqu'à 75 cm de diamètre. Ces systèmes parfois très abusivement qualifiés de "systèmes ouverts" restent des systèmes fermés, bien que leur capacité à accueillir des personnes obèses soient améliorée.
L'IRM "ouverte" est apparue après l'IRM fermée. Très peu répandue à ses débuts, la technologie des IRM ouvertes s'améliorant, on leur trouve des avantages dans la médecine humaine notamment pour les individus qui ne pouvaient pas bénéficier de ce type d'imagerie en géométrie fermée pour des raisons pratiques ou pour éviter une anesthésie générale. On compte parmi ces personnes :
- les individus obèses dont le diamètre de l'abdomen ou l'envergure des épaules dépasse le diamètre interne du tunnel ;
- les individus claustrophobes ;
- les enfants ne supportant pas de rester seuls plusieurs longues minutes dans l'IRM sans bouger.
- Les femmes enceintes.
Une application récente des modèles ouverts est l'IRM interventionnelle.
Toutefois, les capacités d'intensité de champ magnétique offertes par ce type d'IRM restent habituellement inférieures (0,3 à 0,4 T pour les aimants permanents[réf. souhaitée]) aux conformations fermées. Cependant, il existe actuellement deux systèmes ouverts[Lesquels ?] utilisant une technologie à supraconducteur, un à 1 T et un autre à 1,2 T en attendant des champs plus élevés. Ces systèmes haut champ ouverts sont plus difficiles à fabriquer et donc plus chers.
Bobines de gradient de champ magnétique
Il s'agit de trois bobines métalliques enfermées dans un cylindre en fibres de verre et placées autour du tunnel de l'aimant. On les nomme respectivement : bobine X, bobine Y et bobine Z
Le passage d'un courant électrique dans ces bobines crée des variations d'intensité du champ magnétique dans le tunnel, de façon linéaire dans le temps et dans l'espace. En fonction de sa géométrie, chaque bobine fait varier le champ magnétique selon un axe spécifique :
- la bobine X selon l'axe droite-gauche ;
- la bobine Y selon l'axe avant-arrière ;
- la bobine Z selon l'axe haut-bas.
Elles permettent notamment de sélectionner une épaisseur et un plan de "tranche" ou coupe (transversal, frontal, sagittal ou oblique) et de déterminer la localisation spatiale des signaux dans ce plan.
En sélectionnant une de ces bobines, on peut faire varier ces paramètres :
- la pente ou intensité : elle est de l'ordre de quelques dizaines de milliTeslas par mètre (mT/m) et varie selon les imageurs ; son rôle est de contrôler l'épaisseur de chaque coupe ;
- le rapport de montée en puissance : elle correspond à la pente maximale atteinte par mètre et par milliseconde ; son rôle est la gestion de la rapidité d'acquisition ;
- Remarque : les commutations rapides de champ magnétique par les bobines de gradients produisent des courants de Foucault, eux-mêmes à l'origine de petits champs magnétiques.
Correcteurs de champ magnétique
Les correcteurs de champ magnétique ou shim sont des dispositifs qui servent à compenser les défauts d'inhomogénéité du champ magnétique principal B0 qui peuvent résulter de facteurs liés à l'environnement ou tout simplement de la présence du patient dans le tunnel.
Les correcteurs de champ sont disposés le long de l'aimant. Il en existe deux types pouvant être présents tous les deux dans une même machine.
Shim passif
Ce sont des plaques ferromagnétiques. Elles permettent un réglage grossier du champ magnétique, dans le cas d'un environnement perturbateur stable.
Shim actif
Ce sont des bobines résistives ou supraconductrices, dans lesquelles passe un courant électrique. Les shims actifs permettent un réglage fin et dynamique, lors de la présence de structures mobiles proches de l'imageur ou du patient dans le tunnel. Ils effectuent une compensation automatique à chaque fois que le champ magnétique devient hétérogène.
- Remarque : L'homogénéité du champ magnétique est vérifiée à chaque maintenance du système. Les bobines de shim sont alors calibrées finement (on parle de shimming) par un technicien ou ingénieur spécialisé.
Antennes
Ce sont des bobinages de cuivre, de formes variables, qui entourent le patient ou la partie du corps à explorer.
Elles sont capables de produire et/ou capter le signal de radiofréquence (R.F.). Elles sont accordées pour correspondre à la fréquence de résonance de précession des protons qui se trouvent dans le champ magnétique :
-
-
- Fp = Fréquence de précession
- γ = Rapport gyromagnétique
- Bo = Intensité du champ magnétique principal
Ce qui donne dans le cas du noyau de l'hydrogène (proton):
- pour un champ de 0,5 T : onde R.F. de 21,3 MHz ;
- pour un champ de 1 T : onde R.F. de 42,6 MHz ;
- pour un champ de 1,5 T : onde R.F. de 63,9 MHz.
Les antennes sont très variables et peuvent être catégorisées de trois manières différentes :
- Selon leur géométrie : volumique et surfacique.
- Selon leur mode de fonctionnement : émettrice-réceptrice ou réceptrice seule (on parle aussi de réceptrice pure).
- Selon l'association ou non de différents éléments d'antennes : linéaire, en quadrature de phase ou en réseau phasé.
Antennes volumiques
Une antenne volumique est une antenne au centre de laquelle est positionné le segment à examiner. Elle est :
Soit émettrice-réceptrice : c'est un cylindre de bobinage métallique qui émet un signal R.F. approprié (sous la forme d'impulsions régulières) vers des protons de la région à explorer. Ceux-ci entrent alors en résonance. Puis l'antenne réceptionne la réponse de ces protons, au moment de la restitution de l'énergie.
Soit réceptrice simple : elle est constituée de plusieurs antennes réceptrices plates montées en réseau phasé autour d'une structure cylindrique. C'est, dans ce cas, une autre antenne (l'antenne dite Corps ou Body intégrée à l'appareil lui-même) qui s'occupe de l'émission du signal R.F. .
- Remarque : L'émission et la réception du signal se font de façon homogène dans tout le volume entouré par l'antenne.
Exemples d'antennes volumiques :
- L'antenne corps : il s'agit d'une antenne émettrice-réceptrice, elle est située autour du tunnel de l'aimant (non visible sur une installation en utilisation mais il est possible de la visualiser au cours des maintenances). Son diamètre est à peu près de 65 cm. Elle permet l'étude de régions anatomiques étendues (allant jusqu’à 50 cm de long).
- L'antenne tête : il s'agit d'une antenne émettrice-réceptrice ou réceptrice simple. Il s'agit d'une antenne modulaire de diamètre de 25 à 30 cm qui est adaptée à l'exploration de l'encéphale mais peut également être utilisée pour l'exploration comparative des extrémités chez l'adulte (main, poignet, pied et cheville) ou de l'abdomen des jeunes enfants.
- L'antenne genou : il s'agit d'une antenne émettrice-réceptrice ou réceptrice simple. Il s'agit d'une antenne modulaire de 22 cm de diamètre (peut varier). Elle est adaptée à l'exploration du genou, mais aussi du pied et de la cheville.
On peut aussi citer : l'antenne poignet, l'antenne épaule, l'antenne jambes...
Antennes surfaciques
Une antenne surfacique est une antenne plane positionnée au contact de la région à explorer. Elle est réceptrice simple et ne peut donc que recevoir le signal restitué par les protons, c'est l'antenne corps qui émet l'impulsion R.F. initiale.
En tant qu'antenne linéaire (utilisée seule), elle ne permet l'examen que de petits champs d'exploration. C'est pour cette raison qu'elle est souvent couplée à d'autres antennes surfaciques (en quadrature de phase ou en réseau phasé).
Elle procure un très bon rapport signal sur bruit dans la région d'intérêt à condition de son bon positionnement (le plus proche possible de la zone d'exploration).
Associations d'antennes
Comme nous l'avons vu précédemment, les antennes peuvent être utilisées seules ou en association afin d'avoir un rendu optimum et permettre le diagnostic :
- L'antenne linéaire : C'est une antenne surfacique utilisée seule et placée parallèlement au champ magnétique B0. Il y a donc réception du signal émis par le patient, uniquement lorsque ce signal passe devant l'antenne.
- L'antenne en quadrature de phase : C'est un ensemble de deux antennes surfaciques disposées autour d'une même région mais dans des plans différents. Chaque antenne reçoit un signal de la même région mais à des moments différents. Les deux signaux se regroupent alors sur un même canal de traitement pour former l'image finale. Ce principe augmente le rapport signal sur bruit et par conséquent la qualité de l'image. On peut aussi utiliser ce gain de signal pour diminuer le temps d'acquisition pour une qualité d'image, cette fois-ci, inchangée. Il est évident que les coûts d'achat de ce type d'antenne est bien plus élevé que pour une antenne linéaire.
- Les antennes en réseau phasé: C'est un ensemble de plusieurs antennes de surface de petit diamètre, disposées côte à côte. Chaque antenne possède son propre canal de réception du signal et produit l'image de la région anatomique en regard de laquelle elle se trouve. Les différentes images sont ensuite combinées par des algorithmes informatiques pour former l'image terminale. Ce principe apporte un très haut signal sur bruit et permet un large champs d'exploration (jusqu’à 48 cm), mais est bien plus onéreux que les deux autres types d'antennes précédemment décrites.
- Remarque: il existe des antennes dites "H.D.E" (Haute Densité d'Éléments) ce sont des antennes qui contiennent plus de deux bobines appelées "éléments d'antenne" qui peuvent être comme des petites antennes élémentaires. Cependant les antennes H.D.E. sont très onéreuses (pour l'exemple une antenne de genou 8 éléments coûte près de 25 000 €)
Blindages
En IRM, on parle de blindages pour certains dispositifs destinés au confinement des champs magnétiques produits par la machine et à l'isolement de celui-ci des champs magnétiques extérieurs qui viendraient perturber l'acquisition.
Il existe deux blindages dans une installation IRM :
Blindage des ondes de radiofréquence
Il est assuré par la cage de Faraday constituée d'un maillage de cuivre qui recouvre presque* toutes les parois de la salle de l'aimant et étanche aux ondes R.F. Cependant cette "cage" n'est visible qu'au niveau de la vitre de contrôle (aspect sombre du verre) et le cadre de la porte (de petites lamelles de cuivre), les plaques de cuivres étant cachées dans les murs, le plafond et le sol :
- Elle empêche les ondes R.F. produites par le système de sortir de la salle de l'aimant.
- Elle empêche les ondes R.F. extérieures (produites par tout appareil électronique et objets métalliques en mouvement) d'entrer dans la salle d'examen.
- (*) Dans toutes les salles IRM il existe ce que l'on appelle un panneau de pénétration, c'est un lieu de passages du circuit de refroidissement et des câbles transportant les informations entre la salle de l'aimant et le local technique, celui-ci fait un trou dans la cage de Faraday. Cependant ce passage est spécialement conçu pour ne laisser passer aucune onde R.F.
En outre, il existe un autre type de cage de Faraday. Miniaturisée, elle n'est utilisée que rarement pour certaines acquisitions notamment l'exploration des membres inférieurs, et ce, afin d'éviter l'artéfact de repliement (Aliasing) du membre controlatéral. Ce dernier est entouré par une petite cage de Faraday et ne peut donc répondre aux impulsions de radio-fréquences. De nouvelles parades technologiques et des solutions d'anti-repliements rendent son utilisation très sporadique.
Blindage de champ magnétique
Il a pour rôle de rapprocher les lignes de champ au plus près de l'aimant et notamment de faire rentrer la ligne de 0,5 mT dans la salle d'examen.
- Remarque: on parle de la « ligne des 0,5 mT » ou « des 5 Gauss ». C'est la limite au-delà de laquelle il y a dysfonctionnement ou dérèglement d'un pacemaker
Il existe deux types de blindages de champ magnétique selon les appareils :
- un blindage passif : c'est un ensemble de poutrelles d'acier ou de fer doux, entourant l'aimant. Ce dispositif est très lourd ;
- un blindage actif : c'est un bobinage métallique inversé placé aux deux extrémités du bobinage de champ principal B0. Au passage du courant électrique dans les spires inversées, il se produit un contre-champ magnétique dont les lignes de champ viennent s'opposer à celles de B0.
Le périmètre du champ magnétique est appelé champ magnétique résiduel. La taille du champ magnétique résiduel dépend de la puissance du champ magnétique et du fait que le système soit blindé ou non. Pour un IRM de 1,5 T non blindé, un champ supérieur à 0,5 mT s'étend jusqu’à près de 12 mètres de l'isocentre et de 9,5 mètres de part et d'autre de l'aimant (Il est à noter que la cage de Faraday n'a aucune action de blindage contre le champ magnétique) ; avec blindage ce champ est réduit à 4 mètres de l'isocentre et 2,5 mètres de part et d'autre de l'aimant.
- Remarque : En raison du contre-champ du blindage actif, le champ magnétique est plus intense à l'entrée du tunnel et sous les capots qu'au centre de l'appareil (les intensités peuvent être presque doublées). Cette propriété peut être cause de vertiges et de sensations de fourmillement à l'entrée du tunnel lors de l'émission des ondes de radiofréquence, dues à de petits courants de Foucault induits dans certaines structures nerveuses. Il est important de respecter les consignes de sécurité et ne pas former de "boucle" avec les membres ce qui augmenterait l'intensité de ces courants et pourrait provoquer des brûlures ou/et de plus grands étourdissements.
Quench
Le Quench se définit par un passage brutal de l'hélium liquide à l'état gazeux volatil qui s'échappe alors de la cuve.
La raison accidentelle principale de ce phénomène est un défaut dans le système d'isolation thermique dû à la présence de micro-pores dans les joints, voire un non contrôle du niveau d'hélium et du bouclier thermique d'azote liquide (c'est la cause accidentelle la plus fréquente du "quench").
Il y a un réchauffement de l'hélium liquide qui passe alors à l'état gazeux, avec un risque de voir l'évaporation s'accélérer avec la diminution du pourcentage d'hélium liquide présent en cuve.
- Remarque : Ce dysfonctionnement peut avoir des origines très diverses : panne dans le circuit d'eau glacée due à un dépôt important de calcaire, défaillance dans les compresseurs provoquant l'arrêt de la tête froide, ou une augmentation de pression dans l'aimant...
Le quench peut être aussi provoqué volontairement par le personnel de santé : en effet la propriété supraconductrice des IRM modernes fait que le champ magnétique principal reste même s'il n'y a plus d'apport de courant dans la bobine. Tous changement de la valeur du champ statique doit être opéré avec une procédure très stricte et toute variation rapide du champ statique engendre des courants de Foucault importants ceux-ci réchauffent les cuves de l'aimant et augmentent considérablement la consommation d'hélium, ceci peut conduire à un phénomène d'emballement qui sublime la masse d'hélium existant et conduit au "quench" et surtout au réchauffement du filament supraconducteur qui peut être détruit et brûlé.
Ainsi pour stopper le champ magnétique, il faut attendre plusieurs heures (voire journées) pour que la très faible résistance de la bobine diminue l'intensité du champ magnétique. En cas de danger immédiat pour toute personne se trouvant dans la salle d'examen, par exemple : un individu coincé entre l'aimant et un gros objet ferromagnétique (brancard, bombonne d'oxygène, cireuse...) il y a un risque de fracture voire d'asphyxie pour celui-ci et la puissante force d'attraction empêche de dégager la personne sans porter atteinte à son intégrité physique. Alors on déclenche le quench :
L'hélium liquide passe à l'état gazeux, la bobine principale se réchauffe avec perte de la supraconductivité et reprise de la résistivité de la bobine. À terme, il y a remise en place de l'effet Joule (production d'énergie calorifique : dégagement de chaleur) et l'intensité du champ magnétique chute progressivement.
L'hélium gazeux produit doit normalement s'échapper vers l'extérieur des locaux grâce à un conduit situé au-dessus de l'aimant. Si cette évacuation ne se fait pas correctement, l'hélium gazeux s'échappe dans la salle d'examen. Il y a alors un risque important d'asphyxie et de brûlure par le froid pour le patient présent dans le tunnel. Ainsi qu'un risque de confinement de la salle : impossibilité d'ouvrir la porte de la salle selon son sens d'ouverture.
- Remarque : L'hélium gazeux n'est pas un gaz toxique pour l'organisme. Son inconvénient, dans ce cas, est sa détente du passage liquide à l'état gazeux pour finalement remplacer le dioxygène de l'air. En effet pour 1 litre d'hélium liquide on obtient plusieurs centaines de litres d'hélium gazeux ; un véritable problème lorsqu'on sait que la cuve d'un IRM contient (lorsqu'elle est pleine) de 1 650 à 1 800 litres d'hélium liquide.
Lorsque qu'un quench se produit, il arrive que la totalité de l'hélium présent en cuve s'échappe. Dans ce cas l'appareil IRM ne peut plus être utilisé dans l'immédiat : Il faut refroidir la cuve avant de la remplir à nouveau, puis relancer le champ magnétique jusqu’à atteindre sa complète stabilité. Il faut ensuite recalibrer le shim actif et procéder à des tests sur fantômes. Ces opérations sont très coûteuses en temps et en argent : dans un ordre d'idée, on peut estimer son coût à plus de 40 000 euros sans compter les pertes potentielles dues à l'impossibilité de pratiquer des examens pendant le temps de remise en service qui dure, environ, deux semaines.
Rappels de RMN
Article détaillé : résonance magnétique nucléaire.La résonance magnétique nucléaire exploite le fait que les noyaux de certains atomes possèdent un moment magnétique de spin. C'est en particulier le cas de l'atome d'hydrogène 1 que l'on retrouve en grande quantité dans les molécules qui composent les tissus biologiques comme l'eau (H2O) et les molécules organiques. Pour comprendre les principes de la RMN et de l'IRM, on peut s'imaginer ces spins comme des toupies tournant sur elles-mêmes autour de leur axe. En RMN (tout comme en IRM), on place les atomes que l'on veut étudier dans un champ magnétique constant et on leur applique une onde électromagnétique à une fréquence bien particulière dite fréquence de résonance ou fréquence de Larmor. En effet, pour que le champ oscillant puisse avoir un effet notable sur les atomes, il faut qu'il entre en résonance avec ceux-ci, c'est-à-dire que sa fréquence soit ajustée au « mouvement de rotation » de ces spins. Le choix de la fréquence de Larmor permet donc de cibler quels atomes on va imager en fonction de l'intensité du champ magnétique (qui est de quelques Teslas pour les appareils d'IRM actuels). En IRM, on utilise principalement les atomes d'hydrogène dont la fréquence de résonance est autour de 42 MHz/T, ce qui correspond à la gamme des ondes radio. En effet, l'atome d'hydrogène qui est constitué d'un seul proton, est très abondants dans les tissus biologiques et en outre, son moment magnétique nucléaire est relativement fort, ce qui fait que la résonance magnétique de l'hydrogène donne lieu à un phénomène de résonance très net et facile à détecter.
Même s'il s'agit en réalité de phénomènes quantiques, on peut se représenter, de façon imagée, que sous l'effet du champ magnétique statique, les moments magnétiques de spin vont progressivement s'aligner dans une direction initialement parallèle à celui-ci et donner lieu à une aimantation globale dans la direction du champ B0, dite direction longitudinale. Par habitude, on note cette direction de la lettre z. et on note l'aimantation longitudinale résultant de l'addition de tous ces moments magnétiques, M. En fait, seule une très faible proportion (environ 0,001%) des moments magnétiques nucléaires s'aligne dans la direction z, la très grande majorité ne possède pas une orientation stable en raison de l'agitation thermique, néanmoins cette petite proportion de spins qui « s'alignent » est suffisante pour être détectée, c'est pourquoi on néglige le reste des moments magnétiques des 99,999% restant qui statistiquement se compensent les uns les autres.
Lorsque l'on applique l'onde magnétique radiofréquence oscillante à la fréquence de Larmor, on va entraîner les moments magnétiques qui vont alors s'écarter progressivement de l'axe z pour aller se placer perpendiculairement à leur axe de départ un peu comme un parapluie qui s'ouvrirait mais en plus les spins continuent leur rotation autour de l'axe z. C'est ce qu'on appelle un mouvement de précession.
L'onde magnétique oscillante, notée B1 va donc avoir comme rôle de faire « basculer » les moments magnétiques de spin pour les placer dans un plan perpendiculaire à la direction du champ statique B0. C'est ce qu'on appelle l'excitation : plus celle-ci dure longtemps et plus la proportion de moments magnétiques qui auront basculé sera importante et donc plus l'aimantation longitudinale (dans la direction z) diminuera.
Lorsqu'on interrompt le champ oscillant, les moments magnétiques qui se sont écartés de leur axe initial vont revenir vers la direction z sans cesser de tourner. On peut alors mesurer ce mouvement de rotation des spins sous la forme d'un signal oscillant qui a la même fréquence que l'onde excitatrice. C'est ce signal, dit de précession, qu'on mesure en RMN et en IRM au moyen d'une antenne réceptrice.
Relaxation longitudinale (T1)
Au fur et à mesure que les moments magnétiques retrouvent la direction du champ statique z, le signal oscillant qu'ils émettent va en diminuant, jusqu'à disparaître quand tous les moments magnétiques sont de nouveau alignés longitudinalement, c'est-à-dire dans la direction z. Le temps que mettent les moments magnétiques nucléaires à retrouver leur alignement longitudinal (i.e., sur la direction z) est baptisé temps de relaxation et est noté T1.
En notant Mz(0) la valeur à l'équilibre de l'aimantation longitudinale (lorsque tous les spins sont alignés), on peut donner la loi d'évolution de la « repousse » de l'aimantation longitudinale après à avoir appliqué une excitation qui aurait fait basculer tous les moments magnétiques au temps t = 0 :

Ce phénomène de relaxation (c'est-à-dire de retour à l'équilibre) suit donc une dynamique exponentielle, il faudrait alors un temps infini pour que tous les spins se retrouvent alignés, c'est pourquoi on définit comme temps T1 le temps mis pour retrouver 63% de l'aimantation longitudinale à l'équilibre.
Ce temps de relaxation T1 dépend de l'agitation moléculaire dans le tissu que l'on observe. Il suit une courbe en U inversé : si l'agitation moléculaire est très faible, les atomes d'hydrogène mettront du temps à revenir à l'équilibre (c'est le cas des tissus durs comme les os). Si l'agitation des molécules d'eau est très forte, comme c'est le cas dans les liquides comme le liquide céphalo-rachidien, la repousse est aussi lente. En revanche, si l'agitation est modérée (c'est-à-dire avec une constante de temps autour de la fréquence de Larmor) comme dans la graisse ou dans la substance blanche, alors le temps T1 est relativement court. Ces différents T1 tournent autour de 1 seconde pour champ B0 de 3 Teslas.
Relaxation transversale (T2)
Par ailleurs, l'agitation moléculaire contribue aussi à un autre phénomène : alors qu'en théorie les moments magnétiques devraient tous tourner de façon cohérente autour de l'axe z, c'est-à-dire avec une différence de phase constante. L'agitation moléculaire va faire que les atomes ne vont pas être dans un environnement physico-chimique constant et donc leur fréquence de Larmor va elle aussi n'être pas parfaitement égale à la fréquence de Larmor théorique. Par conséquent, les différents moments magnétiques vont avoir tendance à se désynchroniser. Cela se traduit par une diminution du signal lié à leur rotation synchrone au cours du temps, dit temps de relaxation T2.
Ce temps T2 mesure la disparition de l'aimantation transversale, c'est-à-dire de l'aimantation résultant du fait que les moments magnétiques sont synchrones dans leur rotation dans le plan transversal, perpendiculaire à B0, où ils ont été amenés par l'onde excitatrice oscillante B1. Là encore, il s'agit d'un phénomène qui suit une loi exponentielle (décroissante cette fois) :

Encodage spatial grâce aux gradients
La localisation spatiale des atomes est obtenue en ajoutant un gradient directionnel sur le champ magnétique de base (B0) grâce aux bobines de gradient de champ magnétique. La relaxation des protons sera alors modifiée par la variation du champ magnétique. Des techniques de traitement du signal utilisant les algorithmes de transformées de Fourier rapides permettent alors de localiser l'origine du signal.
La résolution spatiale est liée à l'intensité du champ magnétique (de nos jours, en 2006, les appareils utilisent un champ de 1 à 3 teslas) et de la durée de l'acquisition (en général une dizaine de minutes). On atteint actuellement une résolution de l'ordre du millimètre.
Pondérations
En modifiant les paramètres d'acquisition IRM, notamment le temps de répétition entre deux excitations et le temps d'écho, temps entre le signal d'excitation et la réception de l'écho, l'utilisateur peut modifier la pondération de l'image, c’est-à-dire faire apparaître les différences de temps T1 et de temps T2 des différents tissus d'un organisme. Les tissus ayant des temps T1 et T2 différents en fonction de leur richesse en atome d'hydrogène et en fonction du milieu dans lequel ces derniers évoluent, peuvent renvoyer des signaux différents si l'on arrive à mettre en évidence ces différences de temps. Pour cela, on teste la réponse des atomes après des excitations particulières.
Des tissus différents ont des T1 différents. Après stimulation de radio-fréquence avec un temps de répétition court, on ne laisse pas le temps aux atomes d'hydrogène de certains tissus de revenir en position d'équilibre alors que, pour d'autres atomes d'hydrogène d'autres tissus, le temps est suffisamment long pour qu'il y ait un retour à l'équilibre. Lorsque l'on mesure l'état d'énergie des atomes des tissus, on note des écarts d'état entre ces différents atomes. Si on laissait un temps trop long, tous les atomes auraient le temps de revenir en position d'équilibre et l'on ne noterait plus de différences entre différents tissus.
Des tissus différents ont des T2 différents. Après stimulation par un temps d'écho long, on retrouve des décroissances d'énergie d'amplitude plus importante entre les tissus. Les différences de T2 étant plus discriminants si le temps d'écho est long.
Pondération T1
Les paramètres de la pondération :
- temps d'écho : TE = 10 à 20 ms (ms = millisecondes)
- temps de répétition : TR = 400 à 600 ms
En utilisant un temps de répétition court et un temps d'écho court (neutralise les différences de temps T2), on obtient un contraste d'image pondérée en T1, pondération dite « anatomique » : en pondération T1 sur le cerveau, la substance blanche apparaît plus claire que la substance grise. Le liquide céphalo-rachidien, situé entre la substance grise et l'os apparaît lui nettement plus foncé.
Ces séquences sont également utilisées après injection de produit de contraste, pour caractériser une anomalie [7]
Pondération T2
Les paramètres de la pondération :
- temps d'écho : TE > 80 ms
- temps de répétition : TR > 2 000 ms
En utilisant un temps de répétition long (neutralise les différences de temps T1) et un temps d'écho long, on obtient un contraste d'image dite pondérée en T2, dite aussi pondération « tissulaire » : L'eau et l'œdème apparaissent en hypersignal.
Densité protonique
Les paramètres de la pondération :
- temps d'écho : TE = 10 à 20 ms
- temps de répétition : TR > 2 000 ms
En utilisant un temps de répétition long (2 000 ms à 3 000 ms) et un temps d'écho court (inférieur à 30 ms), on obtient un contraste d'image de pseudo densité protonique (Tissus > liquide > graisse). Seul les éléments tissulaires à faibe densité protonique, comme les ménisques, seront en hyposignal par rapport aux liquides libres témoins d'une pathologie articulaire sous-jacente . En utilisant un temps de répétition plus long (5 000 ms) et un temps d'écho court (inférieur à 30 ms), on obtient un contraste d'image de vraie densité protonique(Liquide>Tissus>graisse).
Séquences
Écho de spin
Séquence SE classique
La séquence IRM la plus classique est sans doute la séquence écho de spin. Cette dernière se décompose en:
- une impulsion 90 ° dite d'excitation.
- une période de déphasage dans le plan transverse des protons pendant TE/2.
- une impulsion 180 °, dite d'inversion.
- un rephasage pendant TE/2.
- la lecture du signal (lecture de l'echo de spin).
Cette sequence permet les pondérations T1, T2 et de densité protonique. Elle n'est plus utilisée car le temps d'acquisition est beaucoup trop long car il faut compter environ 50 minutes pour l'acquisition d'une coupe sur une matrice de 256².
Séquence TSE/FSE rapide
TSE pour Turbo Spin Echo et FSE pour Fast Spin Echo (le nom de la séquence dépend des constructeurs mais le principe est identique)
la technique associe la méthode écho de gradient et écho de spin pour une acquisition plus rapide mais plus sensible aux artéfacts.
Le principe de ces techniques reste basé sur un angle d'impulsion radiofréquece (généralement 40 °) appelé angle de Ernst intermédiaire entre la séquence SE et IR avec des temps de répétitions plus courts (300 ms) , cette technique appliquée à haut champ permet d'éviter certains arterfacts dus aux spins mobiles.
Inversion-Récupération
Séquence IRT1 ou FLAIRT1 ou TRUET1
On envoie une impulsion a 180 °, puis on attend un délai T pendant lequel ML (proportionnel à l'intensité longitudinale) a augmenté. Après T, on envoie une impulsion à 90 °, qui provoque un basculement de ML, on obtient ainsi un courant mesurable et donc un signal lié a T1.
Séquence STIR
(= Short Time of Inversion Recovery) Les séquences STIR ont pour but d'annuler le signal de la graisse.
Séquence FLAIR ou FLAIRT2
Il s'agit d'une séquence en inversion-récupération pondérée T2 sur laquelle on a « supprimé » le signal de l'eau libre (et donc du liquide céphalo-rachidien), qui apparaît alors en hyposignal, en adaptant le temps d'inversion. Cette séquence est très utilisée dans l'exploration cérébrale (notamment du cortex et des parois ventriculaires), l'œdème, la nécrose ou encore la gliose.
Écho de gradient
Gradient de diffusion
Les techniques de gradient de diffusion consistent à mesurer le mouvement brownien des molécules d'eau dans les tissus. Cela permet d'en déduire des informations sur les inhomogénéités des tissus et notamment de la substance blanche du tissu nerveux. Pour ce faire, les mesures de la diffusion sont effectuées sur un plus ou moins grand nombre de directions (de 6 à plus d'une centaine) qui permettent de calculer des tenseurs de diffusion dans chaque voxel. À partir de là, il est possible de définir la direction moyenne des fibres qui passent dans chacun des voxels et de reconstruire la trajectoire des principaux faisceaux de fibres grâce à des algorithmes de tractographie déterministes ou probabilistes. Cette direction moyenne est donnée par la direction propre associée à la plus grande valeur propre ("eigenvalue") du tenseur de diffusion. Le plus souvent, les algorithmes déterministes interpolent les directions de chaque voxel contigü en fonction du degré d'anisotropie (mesuré par la fraction d'anisotropie) et de l'angle formé par deux directions moyennes de voxels jouxtants.
Saturation des graisses (ou fatsat)
La Fat Sat est une technique permettant de supprimer le signal de la graisse en IRM.
C'est une méthode qui utilise la légère différence de fréquence de résonance des protons des atomes d'hydrogène présents dans la graisse par rapport à ceux de la molécule d'eau. Cette différence est d'environ 220 Hz(à 1,5 Tesla). On envoie donc une radiofréquence dirigée spécifiquement sur la fréquence de la graisse afin de la saturer avant de recueillir le signal de la coupe.Avantages :
- méthode utilisable en pondération tant T1 que T2 ;
- permet de mieux mettre en évidence les prises de produit de contraste en pondération T1.
Inconvénients :
- Très sensible aux inhomogénéités de champ, la différence de fréquence de résonance étant très ténue, si le champ magnétique a une valeur trop variable, la Fat Sat ne fonctionnera pas bien. Ce problème se pose souvent en cas de corps étrangers métalliques trop proches ou même en cas d'homogénéité limitée de l'aimant.
Artéfacts
L'IRM, comme toutes les autres techniques d'imagerie médicale, n'échappe pas à la constitution de fausses images : les artéfacts.
Ces images observables n'ont, pour la plupart, pas à proprement parler de réalité anatomique. Ils peuvent être évités ou minimisés en modifiant certains paramètres d'acquisitions ou de reconstructions. Cependant certains d'entre eux ne sont pas sans utilité diagnostique.
Artéfacts de mouvement
L'artéfact de mouvement est un des artéfacts les plus fréquemment rencontré. Comme son nom l'indique, il se constitue lorsqu'il y a translation dans l'espace du segment étudié au cours de l'acquisition. Il y a deux types de mouvements rencontrés :
- Les mouvements périodiques : Ce sont les mouvements de la respiration, les battements cardiaques et les flux sanguins.
- Les mouvements apériodiques : Ce sont les mouvements du patient, les mouvements oculaires, la déglutition, le péristaltisme digestif et le flux du liquide cérébro-spinal.
Ils ont pour conséquence la dispersion du signal : image floue de la structure en mouvement.
Mais aussi (en particulier pour les mouvements périodiques) des erreurs de localisation du signal : des image « fantômes » ou « ghosting » ; en effet lorsqu'il y a mouvement au cours de différent codage de phase, plusieurs valeurs de codage et donc plusieurs localisations seront attribuées à un même proton.
Ces erreurs de localisations ne sont visibles que dans le sens de la phase car entre deux échantillonnages de codage de phase il peut se passer quelques secondes au cours desquelles un mouvement a lieu. En revanche entre deux échantillonnages de codage de fréquence seules quelques millisecondes se passent, un mouvement d'amplitude significative durant ce laps de temps très court est donc peu probable.
Cette propriété est importante car elle permet de modifier les paramètres en fonction de la zone d'intérêt diagnostic de l'examen. Par exemple : Lorsque que le rachis est étudié en coupes axiales, le codage de phase peut être paramétré en droite-gauche afin d'éviter que le ghosting du flux sanguin de l'aorte ne vienne se projeter dessus. Les techniques de pré-saturations permettent de saturer les spins mobiles et d'éviter leurs artéfacts sur l'acquisition d'image statique (cf respiration abdominale ou passage de gros troncs vasculaires ou du LCR dans la région spinale surtout à partir de 1.5 Tesla)) dans la zone d'examen.
Artéfacts de champ magnétique
Artéfact de susceptibilité magnétique métallique
Artéfact de susceptibilité magnétique
Artéfact d'hétérogénéité globale du champ magnétique principal
Artéfact de non linéarité d'un gradient de champ magnétique
Artéfacts d'impulsions de radiofréquence
Artéfact d'impulsions de radiofréquence croisées
Artéfact de croisement de coupe
Artéfact d'interférences aux radiofréquences extérieures
Cet artéfact est due aux interférences des radiofréquences émises par des appareils extérieurs ( GSM, 3G, Radio, etc.)
Artéfact d'hétérogénéité des impulsions de radiofréquence
Artéfacts de reconstruction d'image
Ce sont les artefacts liés au problème de numérisation du signal (échantillonnage). Ainsi, si un pixel intersecte plusieurs objets, son niveau de gris sera une combinaison des niveaux de gris issus de chacun des objets traversés.
Artéfact de déplacement chimique
Artéfact de repliement
Artéfact de troncature (phénomène de Gibbs)
Applications
Angio-IRM
L'angio-IRM ou ARM est utilisée pour visualiser les artères afin de mettre en évidence des anomalies telles que les sténoses, dissections, fistules, les anévrismes et artérite. Les artères cérébrales, cervicales, rénales, iliaques, pulmonaires et l'aorte sont les artères les mieux étudiées par cette technique.
L'angio-IRM fait appel aux séquences en échos de gradient ultrarapides avec injection de chélates de gadolinium en intra-veineuse[8].
IRM Cardiaque
Généralités
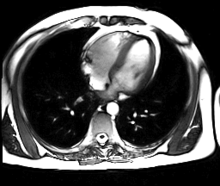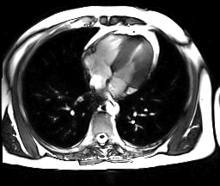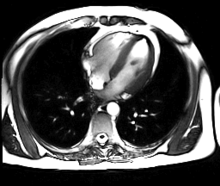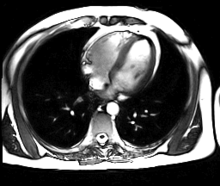
L’IRM cardiaque est un procédé d’imagerie reposant sur l’excitation des noyaux d’hydrogène de l’organisme par impulsions de radiofréquence, qui permet d’obtenir une image des organes intra-thoraciques sans limitation liée à la composition des tissus. Contrairement à l’échocardiographie pour laquelle la pénétration du faisceau d’ultrasons dans les tissus est entravée par l’interposition de tissu pulmonaire ventilé, empêchant une évaluation cardiaque satisfaisante chez environ 10% des patients, l’IRM cardiaque procure des images diagnostiques chez tous les patients, indépendamment de leur morphologie. L’acquisition d’un large champ de vision (field of view, FOV) permet une évaluation des structures thoraciques en plus de l’examen du cœur et des gros vaisseaux. L’IRM acquiert des images dans n’importe quel plan anatomique déterminé par l’opérateur, ce qui permet une imagerie adaptée à l’anatomie complexe du cœur et en particulier une évaluation morphologique dirigée des cardiopathies congénitales. Une caractéristique déterminante de l’IRM en cardiologie est sa capacité de caractériser les tissus mous pour détecter les pathologies du myocarde ; schématiquement, on utilisera les séquences en pondération T1 pour rechercher la présence de graisse, les séquences en pondération T2 pour l’œdème myocardique, et le rehaussement tardif après injection de chélates gadolinium (T1) pour la fibrose myocardique. En comparaison avec l’IRM d’organes statiques (par exemple l’IRM cérébrale), les défis de l’IRM cardiaque sont de représenter avec une définition maximale un organe se contractant de façon rythmique, et se déplaçant dans la cage thoracique tout au long du cycle respiratoire. Ces contraintes ont rendu nécessaire le développement de séquences d’acquisition rapides, synchronisées à l’électrocardiogramme, d’une durée de 15 à 20 secondes afin de permettre une acquisition en apnée. Il est de ce fait difficile d’obtenir des images de qualité chez un patient très dyspnéique ou incapable d’effectuer des apnées répétées. De façon analogue, un rythme cardiaque rapide (>100 bpm) ou très irrégulier (notamment en cas de fibrillation auriculaire, rythme bigéminé ou fréquentes extrasystoles), ou un signal ECG de mauvaise qualité réduisent sensiblement la définition des images. Le temps total d’acquisition d’un protocole standard d’IRM cardiaque varie entre 30 et 60 minutes. Il dure sensiblement plus longtemps qu’un CT scan cardiaque mais l’absence de rayons X est un bénéfice notable pour le patient, en particulier si des examens répétés sont à envisager. La station prolongée dans le tunnel de l’IRM peut être problématique pour les patients claustrophobes (environ 2% des patients), et reste contre-indiquée pour les porteurs de pacemaker, défibrillateurs implantables, implants cochléaires ou clips neurochirurgicaux. Il est recommandé de contrôler la compatibilité IRM des appareils ou prothèses implantées chirurgicalement dans un patient sur un site internet de référence[9]. L’injection de produit de contraste, gadolinium chélaté, est en principe contre indiquée pour les patients avec insuffisance rénale de degré IV selon la classification Kdoqi-CKD (débit de filtration glomérulaire estimée inférieure à 30 ml/min)[10] en raison du risque de fibrose systémique néphrogénique, une maladie invalidante de la peau, ressemblant à la sclérodermie[11],[12]. Ce risque a été très fortement diminué et pourrait même disparaître avec le recours à des produits de contraste dits cycliques. Les chélates de gadolinium sont également contre-indiqué de principe chez la femme enceinte.
Techniques d’IRM et séquences
Analyse de la morphologie
Echo de spin : images « sang noir »
Une série de 10 à 15 coupes transverses de 5 à 10 mm d’épaisseur, avec espace entre les coupes de 0 à 5 mm, acquise durant la diastase (acquisition en phase unique), permet l’évaluation initiale de l’anatomie thoracique ainsi que de la disposition des cavités cardiaques et de leurs connexions. En cas d’anatomie complexe, on y ajoute fréquemment une série de coupes sagittales et une série de coupes coronales afin de mieux préciser les relations anatomiques. Une série de coupes sagittales obliques est parfois nécessaire pour préciser l’anatomie de l’arche aortique. La séquence utilisée est le turbo spin echo, une séquence d’écho de spin rapide dont le train d’écho comporte entre 9 et 15 impulsions de rephasage de 180 °, produisant à chaque rephasage un écho, réalisant une ligne d’encodage de phase différente. La séquence est précédée d’une double impulsion d’inversion (180 °), l’une non-sélective et la seconde sélective à la coupe, permettant d’annuler le signal du sang circulant[13],[14]. Ces images sont caractérisées par une forte pondération en T1 avec un excellent contraste entre le pool sanguin, hypo-intense (noir), et les structures vasculaires et musculaires, plus intenses. On parle donc de séquences en sang noir ou black blood. La durée d’acquisition de ce type de séquences est relativement longue, car la répétition d’impulsions de radiofréquence (impulsions d’inversion de 180 °) est nécessaire pour rephaser le signal et produire un écho ; en contrepartie, cette séquence est peu sensibles aux artefacts de susceptibilité que peuvent causer les structures métalliques (stents, cerclages de sternotomie…). Le contraste entre le sang circulant et la paroi vasculaire est en général bonne, mais l’annulation du signal sanguin peut être imparfaite (pool sanguin incomplètement noirci) dans les cavités où le flux sanguin est ralenti (veines pulmonaires ou systémiques, conduits veineux obstrués, thromboses, ventricule fortement dilaté…) pouvant résulter en une mauvaise délimitation endothéliale.
Séquences bSSFP : images « sang clair »
Dans le cas où les images en « sang noir » sont équivoques, la morphologie peut être précisée en répétant les mêmes séries de coupes axiales, sagittales et coronales en utilisant une séquence en écho de gradient de type bSSFP (balanced steady-state free precession), particulièrement peu susceptible aux artefacts de flux. Il s’agit d’une séquence d’acquisition très rapide en mode de phase unique, qui produit un signal d’écho sans appliquer d’impulsion de rephasage, mais en inversant simplement la direction du gradient d’encodage de fréquence. L’inversion du gradient de champ magnétique étant nettement plus rapide que l’application d’une nouvelle impulsion de radiofréquence, ces séquences de type écho de gradient permettent d’accélérer sensiblement la production des signaux et l’acquisition des données. La bSSFP est la séquence d’écho de gradient la plus utilisée en IRM cardiaque en raison de son contraste élevé et de son important rapport signal / bruit. Le contraste est fonction du rapport T2/T1 des tissus ; le sang présent dans la cavité ventriculaire apparaît donc clair, avec une excellente délimitation endothéliale, indépendamment du flux sanguin[15]. On parle d’imagerie en « sang clair » ou bright blood. Cette séquence, comme toutes les séquences d’écho de gradient, est en revanche susceptible aux inhomogénéités du champ magnétique et l’on observe fréquemment une perte de signal (signal void) au voisinage des stents ou d’autres structures métalliques.
Acquisition tridimensionnelle bSSFP
Alternativement, il est possible d’obtenir une évaluation anatomique des structures cardiaques non pas par séries de coupes successives, mais par l’acquisition directe d’un volume qu’il sera possible d’interroger à loisir dans différents plans au moment de l’analyse. Pour permettre ces reconstructions et garantir une résolution spatiale suffisante, il est primordial d’acquérir des voxels isotropiques, c’est-à-dire ayant la même dimension dans les trois plans. Les coupes standard ont une résolution de 1-2 x 1–2 mm dans le plan et une épaisseur de coupe de 8 à 10 mm produisant des voxels en forme de parallépipèdes rectangles. L’acquisition volumétrique implique un encodage de phase dans deux directions différentes, rallongeant sensiblement le temps d’acquisition ; avec l’utilisation de séquences rapides de type bSSFP, le temps d’acquisition du volume cardiaque est de l’ordre de 3 à 4 minutes pour une résolution isotropique de 2,1 mm[16]. L’acquisition se fait en respiration libre, et les artefacts de mouvement liés à l’excursion diaphragmatique sont réduits par l’utilisation d’un navigateur, une séquence IRM rapide détectant au début de chaque cycle cardiaque la position de la coupole droite du diaphragme : l’acquisition de données du volume cardiaque ne sera pratiquée que durant les cycles cardiaques coïncidant avec un diaphragme en position d’expirium. Les techniques 3D sont principalement utilisées pour l’analyse des cardiopathies congénitales[17], ainsi que pour évaluer la morphologie et le trajet épicardiques des artères coronaires[18].
Analyse de la fonction cardiaque
Séquences ciné bSSFP des ventricules[19]
Sa rapidité et le remarquable contraste qu’elle procure entre le muscle cardiaque et le sang circulant fait de cette séquence en écho de gradient la séquence de choix pour l’évaluation de la fonction des ventricules. Au contraire des images morphologiques, statiques, il s’agit d’une acquisition multi-phases de la même coupe myocardique (habituellement entre 25 et 35 phases par cycle cardiaque, en fonction de l’intervalle RR) permettant d’obtenir une image en mouvement – ou coupe ciné du ventricule. Ce type d’acquisition permet s’effectue sur plusieurs cycles cardiaques et requiert une apnée de 10 à 20 secondes. Il ne s’agit donc pas d’une imagerie en temps réel, contrairement à l’échocardiographie. La résolution spatiale, la définition de l’endocarde et la reproductibilité de la méthode sont en revanche supérieures en IRM, faisant d’elle le procédé d’imagerie de choix pour l’évaluation des volumes, de la masse et de la fonction ventriculaire par méthode de Simpson modifiée. L’avantage de l’IRM est d’autant plus évident dans l’évaluation du ventricule droit, difficile à visualiser entièrement en échocardiographie. Typiquement, on acquiert des images caractérisées par une épaisseur de coupe de 8–10 mm avec espacement de 0–2 mm, une résolution dans le plan de 1-2 x 1–2 mm et une résolution temporelle de l’ordre de 40 à 60 ms. Pour le ventricule gauche, les coupes standard sont la vue 4 cavités, 2 cavités et 3 cavités ou vue de la chambre de chasse. Un plan orthogonal à la vue 3 cavités est acquise afin de compléter l’évaluation de la chambre de chasse gauche et de la valve aortique. On effectue ensuite une série de 8 à 12 coupes en court axe des ventricules, parallèles au plan atrio-ventriculaire, couvrant tout le volume ventriculaire de la base à l’apex. Pour le ventricule droit, on effectue une vue 2 cavités en traçant un axe perpendiculaire à la vue 4 cavités et reliant le milieu de l’anneau tricuspide à l’apex du ventricule droit. Une vue simultanée de la chambre de réception et de la chambre de chasse du ventricule droit peut ensuite être construite, de même qu’une seconde vue orthogonale de la chambre de chasse droite, permettant l’évaluation de la valve pulmonaire. On ajoute une série de coupes ciné axiales pures destinées à rechercher des anomalies segmentaires de la contraction de la paroi libre du ventricule droit, notamment en cas de suspicion de dysplasie arythmogène du ventricule droit. Dans le cas de cardiopathies congénitales, on ajoutera au besoin des coupes ciné supplémentaires, dont l’orientation sera adaptée à l’anatomie particulière du patient. Les vues utiles dans ce contexte sont par exemple les coupes des artères pulmonaires afin d’en évaluer le diamètre et la pulsatilité dans les tétralogies de Fallot opérées, et l’évaluation morphologique des conduits veineux dans les circulations de type Fontan, ou après la correction d’une transposition des gros vaisseaux par opération de Senning ou Mustard. En cas de suspicion de communication inter-auriculaire, l’acquisition d’une série de coupes ciné des oreillettes, parallèles au plan atrio-ventriculaire, est recommandée ; comme principe général dans les acquisitions destinées à rechercher une communication anormales entre deux cavités cardiaques, on choisira une épaisseur de coupe plus fine (5 à 8 mm) sans espace entre les coupes.
Séquences ciné ultra-rapides en respiration libre
Ces séquences consistent à acquérir une coupe ciné complète du cœur en temps réel sans synchronisation à l’ECG. La séquence est de type bSSFP couplée à des techniques d’imagerie parallèle afin d’accélérer la vitesse d’acquisition. Inévitablement, les images produites ont une faible définition mais ont l’avantage de pouvoir évaluer les modifications de la contraction ventriculaire au cours du cycle respiratoire. La résolution temporelle est de l’ordre de 50-70 ms pour une résolution spatiale dans le plan de 2–3 x 2–3 mm. L’acquisition dure environ 20 secondes, s’étalant sur 3 cycles respiratoires. Ces séquences trouvent leur utilité dans la recherche d’interférence entre le ventricule droit et le ventricule gauche en cas de suspicion de constriction péricardique[20].
Caractérisation tissulaire sans injection de produit de contraste
Images en pondération T1
Il s’agit d’images morphologiques fixes acquises en diastole. La séquence utilisée est un écho de spin avec double pré-impulsion d’inversion destinée à annuler le signal du sang circulant (« sang noir »), identique à la séquence utilisée pour les séries de coupes morphologiques décrites ci-dessus. On l’applique en général sur des coupes en 4 cavités et en court axe, mais on peut y ajouter d’autres coupes adaptées à l’anatomie du patient, notamment pour mieux caractériser une tumeur myocardique. Alors que le signal du sang circulant est annulé et apparaît noir, la graisse, caractérisée par un temps de relaxation T1 court, apparaît hyperintense et le muscle cardiaque est d’intensité intermédiaire. Cette séquence trouve son utilité dans la caractérisation des masses et tumeurs myocardiques (intensité différente entre la tumeur et le muscle cardiaque normal, signal hyperintense caractéristique du lipome), dans la recherche d’une infiltration graisseuse du myocarde (cas avancés de dysplasie arythmogène du ventricule droit, transformation adipeuse d’une cicatrice d’infarctus), ainsi qu’en cas de pathologie péricardique (mesure de l’épaisseur du péricarde, hypointense et bordé par deux lignes hyperintense de graisse épicardique et péricardique). À noter que la présence de graisse peut être confirmée en répétant la même séquence, précédée d’une pré-impulsion destinée à supprimer le signal du tissu adipeux (impulsion d’inversion standard (STIR : short tau inversion recovery) ou sélective au spectre de fréquence du tissu adipeux (SPIR : spatial inversion recovery) ; TI 120-150 ms). Sur ces séquences de saturation de graisse (séquences en triple inversion), le signal hyperintense visualisé sur la séquence T1 standard est spécifiquement annulé et apparaît hypo-intense.
Images en pondération T2
Il s’agit d’images morphologiques fixes acquises en diastole. Cette séquence d’écho de spin est destinée à mettre en évidence les structures liquidiennes, tirant parti du temps de relaxation T2 particulièrement long de l’eau. Cette séquence, caractérisée par un temps de répétition (TR) prolongé, classiquement de 2 intervalles RR, et d’un temps d’écho (TE) élevé, de l’ordre de 80 ms, est d’acquisition relativement longue. Pour en accélérer l’acquisition à 15-20 secondes, on utilise, comme pour les séquences pondérées en T1, la technique de turbo spin echo consistant à appliquer plusieurs impulsions d’inversion de 180 ° après l’écho initial afin de créer de multiples échos durant le même intervalle TR. Contrairement aux séquences T2 classiques (c’est-à-dire n’utilisant pas le turbo), pratiquées notamment en imagerie cérébrale, la séquence T2 en turbo spin echo tend à créer un signal paradoxalement hyperintense pour la graisse en raison d’interactions spin-spin particulières dans ce tissu (J-coupling), nécessitant d’y associer une pré-impulsion de saturation de graisse (séquence T2-STIR[21]). Cette séquence détecte l’œdème intramyocardique, notamment dans le contexte d’infarctus myocardique aigu ou de myocardite ; il se traduit par un signal hyperintense comparé au signal du myocarde sain. Un tel signal hyperintense en T2 peut également s’observer dans les tumeurs myocardiques mitotiquement actives, associée à de l’œdème tumoral, ou dans le myxome de l’oreillette, de composition riche en eau.
Surcharge en fer et hémochromatose
En raison de ses propriétés ferromagnétiques, le fer présent dans les tissus engendre des inhomogénéités du champ magnétique. Ces inhomogénéités induisent une accélération du déphasage du spin des protons après impulsion de radiofréquence, résultant en une dégradation plus rapide du signal et un raccourcissement du temps T2*. Pratiquement, le myocarde surchargé en fer des patients souffrant d’hémochromatose présente, pour un TE identique, un signal moins intense que le myocarde d’un sujet normal. La valeur T2* du myocarde d’un patient peut être déterminée par relaxométrie IRM. Il s’agit d’une acquisition rapide en écho de gradient répétée une dizaine de fois sur une même coupe court axe mi-ventriculaire avec augmentation progressive du temps d’écho (TE), par exemple entre 2,5 ms et 18 ms (spoiled gradient multi-echo T2* sequence). L’intensité du signal myocardique est mesurée sur chaque coupe au niveau du septum inter-ventriculaire et sa valeur est rapportée graphiquement en fonction de la valeur du TE. La courbe obtenue est exponentielle de forme y = K·e-TE/T2* où y représente l’intensité du signal et K est une constante. De cette relation, la valeur du T2* est calculée comme le temps nécessaire à la réduction de 63% de l’intensité du signal initial. Un T2* inférieur à 10 ms a été associé à une surcharge martiale sévère et cliniquement significative du myocarde[22],[23].
Produit de contraste IRM : le gadolinium
Le gadolinium (64Gd) est un métal rare qui a la propriété de posséder sur sa dernière orbitale un nombre élevé de spins d’électrons non-appariés. Le champ magnétique produit par un électron est plus fort que celui produit par un proton (noyau d’hydrogène), et cet élément paramagnétique constitue donc un candidat idéal pour la fabrication de produits de contraste IRM, raccourcissant les temps de relaxation T1 et T2 des protons des tissus et modifiant l’intensité de leur signal. Toxique à l’état pur, le gadolinium doit être chélaté pour être rendu soluble et utilisable par voie intraveineuse en clinique. Différents chélateurs sont utilisés, et les chélateurs les plus fréquemment utilisés en clinique sont de petite taille (<1000 Da) et ont une distribution extracellulaire (DTPA[24], le DO3A ou le BOPTA par exemple). Au niveau du cœur, le contraste est rapidement éliminé du myocarde normal, pauvre en tissu interstitiel, mais s’accumule de façon prolongée dans les zones de nécrose, de fibrose ou d’œdème, où l’espace interstitiel est pathologiquement augmenté. L’effet du gadolinium étant de raccourcir le temps de relaxation T1 des tissus où il s’accumule, les séquences d’IRM avec contraste sont en règle générale des séquences pondérées en T1. En raison de la cinétique particulière de distribution et d’élimination du gadolinium dans les tissus, le délai écoulé entre l’injection de contraste et l’acquisition des images est très important car il détermine le type d’informations, morphologiques ou fonctionnelles que procure la séquence. Ainsi, les images de premier passage du contraste dans le tissu myocardique sont à la base de l’imagerie de perfusion, les images acquises immédiatement (<2 minutes) après injection (rehaussement précoce) permettent l’identification de zones myocardiques avasculaires ou de thrombus intra-cavitaires, et les images acquises tardivement (10 à 15 minutes) après injection de gadolinium (rehaussement tardif) évaluent la présence de fibrose ou de cicatrices myocardiques. De plus, l’angiographie IRM nécessite l’injection de produit de contraste, et permet l’imagerie des structures vasculaires par des séquences d’acquisition tridimensionnelles rapides suivant la progression du bolus de gadolinium dans l’arbre vasculaire et les cavités cardiaques.
Imagerie de perfusion myocardique
L’imagerie de perfusion repose sur l’imagerie en temps réel du premier passage d’un bolus de gadolinium à travers le muscle cardiaque. Elle utilise des séquences rapides en écho de gradient (spoiled gradient echo ou bSSFP), précédées d’une pré�impulsion de saturation (90 °) afin d’accentuer la pondération T1 des images. Jusqu’à 3 coupes en court axe du ventricule gauche sont acquises lors de chaque battement cardiaque, ou jusqu’à 6 coupes tous les deux battements cardiaques. Les images sont acquises de préférence en diastole, ce qui peut s’avérer difficile pour les patients tachycardes, notamment durant un protocole de stress pharmacologique. Le bolus de contraste est injecté dans une veine de large calibre du pli du coude à l’aide d’une pompe automatique. La dose usuelle est de 0.05-0.1 millimoles de gadolinium par kilogramme de poids corporel. Pour la recherche d’ischémie myocardique, l’injection de gadolinium est effectuée au pic d’un stress pharmacologique par adénosine, dipyridamole ou dobutamine dans le but d’obtenir une vasodilatation coronaire, respectivement une contractilité myocardique, maximale. L’acquisition dynamique est débutée au moment de l’injection du contraste, qui rehausse successivement les cavités droites puis gauches avant de perfuser le muscle cardiaque. On observe alors la progression rapide du contraste, de l’épicarde vers l’endocarde chez le sujet sain, et le rehaussement du myocarde est homogène et complet à la fin du premier passage de gadolinium. Chez les patients atteints de maladie coronaire significative, les zones de déficit de perfusion sont caractérisées par un retard ou un déficit segmentaire du rehaussement myocardique. Une analyse semiquantitative peut être effectuée[25],[26]. Dans certains centres, la même séquence de perfusion est répétée après quelques minutes, sans stress pharmacologique. L’analyse de la perfusion myocardique de repos est destinée à mieux différencier les artéfacts des déficits de perfusion réels en comparant les images de stress et les images de repos (en cas de sténose coronarienne significative, seul un déficit de perfusion au stress est en principe observé); elle ne permet pas toujours de trancher de façon définitive et n’est pas pratiquée dans tous les centres. Notons encore que l’imagerie de perfusion de repos est utilisée pour la caractérisation des masses et tumeurs myocardiques afin d’en préciser le degré de vascularisation ; une tumeur maligne, hypervasculaire, présentera par exemple un rehaussement important durant l’imagerie de perfusion.
Rehaussement précoce après injection de gadolinium
Il s’agit d’une séquence en écho de gradient avec pré-impulsion d’inversion ou de saturation, acquise immédiatement après l’injection de produit de contraste. La dose maximale de gadolinium injectée durant un examen standard est de 0.2 millimoles par kilogramme de poids corporel. On retranchera de cette dose la quantité de produit de contraste déjà injectée durant la – ou les séquences de perfusion. Les images de rehaussement précoce montrent un myocarde complètement rehaussé et hyper-intense ; seules les zones non-vascularisées sont de signal hypo-intense. Dans le contexte d’un infarctus du myocarde récent, une zone hypo-intense au sein du territoire infarci révèle la présence d’obstruction microvasculaire[27] (correspondant au phénomène de no-reflow angiographique) tandis qu’une zone hypointense située dans la cavité ventriculaire, accolée au myocarde akinétique, indique la présence d’un thrombus mural[28]. Pour le diagnostic de la myocardite aiguë, le recours aux séquences de rehaussement précoce est recommandée, afin d’identifier les zones d’inflammation myocardique, hyperémiques, qui apparaissent plus hyperintenses que le myocarde normal.
Rehaussement tardif après injection de gadolinium[29],[30]
Il s’agit d’une séquence acquise entre 10 et 20 minutes après l’injection du produit de contraste. Appelée également imagerie de la cicatrice, cette séquence a pour but de mettre en évidence les zones de fibrose intra-myocardique. L’étude de la cinétique du produit de contraste dans le tissu cardiaque montre que le contraste est rapidement évacué de l’espace interstitiel du myocarde normal alors que sa vidange est ralentie dans les zones de fibrose où l’espace extracellulaire est augmenté ; le temps de relaxation T1 des zones de fibrose se trouve donc significativement raccourci par rapport à celui du myocarde sain. La séquence utilisée est une séquence en écho de gradient (ou une séquence en bSSFP) précédée d’une impulsion d’inversion (180 °) permettant de maximiser le contraste T1. Afin de produire un contraste maximal entre les zones de myocarde sain et de fibrose, le réglage du temps d’inversion (TI), c'est-à-dire le délai entre la pré-impulsion d’inversion et le début de la séquence proprement dite, est déterminant ; il s’agit en effet de débuter la séquence au moment précis où le myocarde normal ne produit aucun signal alors que les zones de fibrose, dont le T1 est raccourci par accumulation de gadolinium, produisent un signal d’écho. On obtient ainsi un rapport d’intensité en théorie infini entre la fibrose et le myocarde normal (en pratique, ce rapport d’intensité est supérieur à 10), faisant de cette séquence un moyen très sensible pour la détection de la fibrose macroscopique. Le myocarde sain apparaît alors hypo-intense (noir) et les zones de fibrose hyper-intenses (claires) ; « ce qui est clair est mort » ("bright is dead") est le slogan mnémotechnique qui caractérise cette séquence. Cette séquence est également appropriée pour la recherche d’obstruction microvasculaire, apparaissant comme un noyau hypo-intense au sein d’une zone de fibrose hyper-intense. La résolution dans le plan des images de rehaussement tardif est de l’ordre de 1.4-1.8 x 1.4-1.8 mm avec une épaisseur de coupe de 5 à 8 mm[31]. Etant donné que la cinétique d’élimination du contraste dépend du poids du patient, de la dose de contraste injectée et du délai entre l’injection et l’acquisition des images, le choix du TI idéal doit tenir compte de ces paramètres ; il varie entre 250 et 400 ms. Très utilisée dans l’évaluation de la cardiopathie ischémique et de la viabilité myocardique, l’étude du rehaussement tardif est également importante dans l’évaluation des cardiomyopathies (recherche de fibrose interstitielle), des masses et tumeurs myocardiques (rehaussement homogène du fibrome, détection de zones de nécrose) et des pathologies péricardiques (rehaussement du péricarde enflammé).
Angiographie IRM
Les séquences d’angiographie consistent en une acquisition volumétrique durant le transit d’un bolus de contraste. Grâce à la rapidité des scanners modernes, plusieurs angiographies peuvent être acquises durant une même apnée d’environ 20 secondes, permettant d’obtenir en une seule séquence une angiographie pulmonaire et une angiographie aortique ; on parle de séquences en quatre dimensions ou 4D. L’acquisition s’effectue en deux temps, avec dans un premier temps, l’acquisition avant l’injection de contraste de signaux de haute fréquence et de faible amplitude, codant pour la définition de l’image. Ces informations définissent les contours des structures intrathoraciques qui ne se modifient pas durant l’injection du produit de contraste ; leur acquisition n’est pas répétée durant la phase dynamique afin d’accroître la vitesse de l’acquisition durant cette seconde phase. Le second temps de la séquence débute donc avec l’injection par pompe automatique d’un bolus de produit de contraste. La progression du produit de contraste est suivie en temps réel et l’acquisition proprement dite débutée lorsque le produit de contraste atteint la cavité cardiaque ou la structure vasculaire à caractériser (on débutera par exemple une angiographie de l’arche aortique quand le bolus aura atteint le ventricule gauche). Lors de cette seconde phase de l’acquisition, seuls les signaux de haute amplitude et de basse fréquence qui codent pour le contraste de l’image seront acquis, de façon répétée, durant les 20 secondes suivant le déclenchement de la séquence. La superposition des deux acquisitions forme l’image finale, d’une résolution dans le plan de 1-2.5 x 1-2.5 mm. Elle pourra être reconstruite en trois dimensions ou visualisée en projection maximale selon les besoins diagnostiques.
Cartographies de flux
Le signal IRM enregistré est un signal de radiofréquence complexe, comprenant une fréquence, une amplitude et une phase. Les séquences en écho de gradient peuvent être codées en phase de sorte à mesurer la vitesse du flux sanguin. Cette technique repose sur la propriété de déphasage du signal IRM par les protons en mouvement, proportionnel à la vitesse du flux dans le champ magnétique. Il est donc possible, par ces séquences particulières, d’encoder la vitesse d’un flux et d’en mesurer le débit. La précision de la mesure dépend de la position du plan d’acquisition, qui doit être placé perpendiculairement au flux mesuré. L’opérateur décide, pour une acquisition donnée, d’une vitesse d’encodage maximale (VENC), la vitesse causant un déphasage de signal de 180 °. Le VENC doit être légèrement supérieur (120%) à la vitesse du flux pour en obtenir une mesure optimale. S’il est trop grand, le signal obtenu sera de mauvaise qualité, avec un rapport signal sur bruit élevé. S’il est trop petit, un phénomène d’aliasing survient, empêchant toute évaluation quantitative du flux[32]. Ces mesures trouvent principalement leur application dans l’estimation de la sévérité de shunts intracardiaques, ou dans l’estimation de la sévérité d’insuffisances valvulaires aortique ou pulmonaire par mesure du volume régurgitant et de la fraction de régurgitation.
Tissue tagging et analyse de la déformation
Les séquences de tagging ou « tatouage myocardique » ont pour but d’analyser et de quantifier la déformation du myocarde durant le cycle cardiaque, et sont utilisées conjointement avec des séquences ciné en bSSFP ou en écho de gradient. Le principe est de "tatouer" sur la coupe IRM une grille de référence à l’aide de pré-impulsions de saturation (90 °). Les bandes de saturation sont appliquées au début de l’acquisition et persistent pour la durée du cycle cardiaque. Comme le tissu saturé se déplace de façon cohérente avec la contraction myocardique sur une image ciné, la déformation de la grille au cours du cycle cardiaque reflète la déformation myocardique. Ces séquences ont montré leur utilité dans l’analyse de la déformation myocardique (strain, strain rate, torsion…)[33] ainsi que dans l’analyse de la synchronisation de la contraction myocardique. La nécessité de disposer d’outils informatiques complexes pour quantifier la déformation limitent actuellement l’utilisation des ces techniques en routine clinique. Elles sont néanmoins parfois utilisées de façon qualitative, par exemple pour détecter une fusion des feuillets péricardiques viscéral et pariétal en cas de suspicion de péricardite constrictive ou de tumeur médiastinale invasive.
Spectroscopie IRM
Si l’imagerie conventionnelle par IRM repose sur l’excitation des protons (noyaux d’hydrogène) de l’organisme, il est important de rappeler que tous les noyaux d’atomes caractérisés par un nombre de masse impair ont une charge nette et peuvent également acquérir un moment magnétique. Ces éléments sont dits IRM-actifs, peuvent s’aligner dans le champ magnétique de l’IRM et sont capables de produire un signal après excitation par un signal de radiofréquence adéquat. Les principaux éléments actifs sont l’hydrogène, le carbone, l’azote, l’oxygène, le fluor, le sodium et le phosphore. La spectroscopie IRM est la seule technique permettant l’analyse du métabolisme cardiaque de façon non-invasive et sans traceurs radioactifs. Elle nous renseigne sur le métabolisme énergétique du myocarde dans la cardiopathie ischémique, l’insuffisance cardiaque, l’hypertrophie myocardique et les maladies valvulaires, et permet d’évaluer la réponse aux traitements. La spectroscopie IRM relève encore du domaine de la recherche[34].
Applications cliniques
Maladie coronarienne
L’IRM cardiaque offre en un seul examen une évaluation exhaustive de la cardiopathie ischémique avec caractérisation de la morphologie, de la fonction, de la perfusion et de la viabilité myocardiques. Un protocole d’imagerie standard comprend la mesure des volumes et de la fraction d’éjection du ventricule gauche à l’aide de séquences ciné en long axe et court axe. Les anomalies de la cinétique segmentaire sont évaluées sur ces mêmes images ; leur sévérité est classifiée de façon semi-quantitative (normokinésie, hypokinésie, akinésie, dyskinésie) et leur distribution est décrite à l’aide du modèle des 17 segments myocardiques. Après injection de gadolinium, les séquences de rehaussement tardif détectent les cicatrices d’infarctus, de localisation sous-endocardique ou transmurale avec une sensibilité supérieure à celle de la scintigraphie[35]. La distribution des zones de fibrose est décrite à l’aide du modèle des 17 segments. Le degré de transmuralité est inversement proportionnel à la probabilité de récupération fonctionnelle après revascularisation et constitue un indicateur de la viabilité myocardique[36]. Schématiquement, un segment akinétique avec rehaussement sous-endocardique touchant moins de 50% de l’épaisseur myocardique peut être considéré comme probablement viable, tandis qu’un segment avec rehaussement supérieur à 50% de l’épaisseur myocardique est considéré non-viable. Au sein de la cicatrice, hyper-intense, on peut parfois observer un noyau hypo-intense correspondant à une zone d’obstruction micro-vasculaire où le contraste ne peut pas pénétrer. La présence d’obstruction micro-vasculaire est un marqueur de sévérité de l’infarctus myocardique et est associé à un pronostic plus réservé en termes de récupération fonctionnelle[37],[38]. Dans la phase aiguë (1-20 jours) de l’infarctus myocardique, les séquences en pondération T2 permettent d’identifier l’œdème myocardique, dont l’extension a été corrélée avec le volume myocardique à risque de nécrose[39]. L’œdème myocardique est de signal hyper-intense en pondération T2. Le rehaussement précoce après injection de gadolinium identifie également l’obstruction micro-vasculaire comme une zone myocardique hypo-intense au sein d’un myocarde fortement rehaussé par le gadolinium. Un signal hypo-intense situé dans la cavité ventriculaire et localisé en regard d’une paroi myocardique akinétique ou anévrysmale indique la présence d’un thrombus mural intra-ventriculaire associé à l’infarctus. Les séquences de rehaussement après injection de gadolinium en IRM cardiaques sont supérieures à l’échocardiographie de contraste pour l’identification de thrombus intra-cavitaires[40]. Les artères coronaires peuvent être visualisées directement à l’aide de séquences 3D de haute résolution (épaisseur de coupe de 1,5 mm avec résolution dans le plan de 1.0 x 1,0 mm). Leur trajet épicardique peut être évalué mais la résolution des images est actuellement insuffisante pour pouvoir juger de la présence et de la sévérité de sténoses coronariennes[41]. L’angiographie coronaire par IRM est un domaine de recherche actif et l’on s’attend à une amélioration notable de la résolution de ces acquisitions avec l’utilisation de champs magnétiques de plus haute intensité (3 Teslas ou plus) ; l’intérêt du développement de la coronarographie par IRM est de pouvoir caractériser la composition de la plaque et son risque de rupture en plus de la simple évaluation du degré de sténose, sans exposer le patient aux radiations[42]. Si l’IRM est actuellement inférieure à l’angio-CT coronaire pour la détection des sténoses coronariennes[43], elle permet en revanche une excellente évaluation fonctionnelle de la perfusion myocardique. Dans les séquences de perfusion sous stress pharmacologique, on obtient une détection au moins aussi sensible de défauts de perfusion par rapport à la scintigraphie myocardique[44]. Plusieurs études ont démontré la valeur pronostique de l’IRM de perfusion, avec une excellente survie sans événement cardiovasculaire en cas d’IRM de perfusion normale[45],[46],[47]. Il s’agit donc d’un examen de choix dans le dépistage de la maladie coronarienne chez les patients présentant des douleurs thoraciques avec une probabilité clinique intermédiaire, ou dans le suivi des patients revascularisés qui présentent une récidive de douleurs thoraciques.
Maladies valvulaires
Les valves normales sont des structures fines au mouvement rapide, de faible densité de proton, rendant leur visualisation difficile sur les séquences d’écho de spin. Elles sont mieux visualisées sur les séquences d’écho de gradient ou bSSFP, notamment en raison de la perte de signal occasionnée par les minimes turbulences du sang circulant au contact des feuillets valvulaires[48]. Ces séquences ciné permettent de juger de l’ouverture d’une valve cardiaque et d’en dépister une éventuelle insuffisance. La résolution temporelle de l’IRM, de l’ordre de 30 phases par cycle cardiaque, est nettement inférieure à celle de l’échocardiographie, et ne permet pas une évaluation morphologique complète de l’appareil valvulaire et sous-valvulaire. En particulier, il est difficile d’identifier la présence de petites structures très mobiles et, en cas de suspicion d’endocardite, seules les larges végétations peuvent être identifiées. L’IRM peut néanmoins être utile dans ce contexte pour identifier un abcès ou une extension extracardiaque de l’infection. L’intérêt principal de l’IRM dans l’évaluation des valvulopathies est sa capacité de juger de la sévérité des insuffisances valvulaires, de façon qualitative en inspectant la taille du jet régurgitant sur les images ciné, ou de façon quantitative par mesure des volumes ventriculaires et par mesure des débits par cartographie de flux. En ce qui concerne les valves aortique et pulmonaire, la mesure par cartographie de flux du volume d’éjection systolique et du volume régurgitant diastolique, au niveau de l’aorte ascendante ou du tronc pulmonaire, permet une quantification précise de la sévérité d’une insuffisance. Le rapport du volume régurgitant et du volume d’éjection correspond à la fraction de régurgitation qui caractérise la sévérité de l’insuffisance valvulaire. Des fractions de régurgitation supérieures à 50% pour la valve aortique et à 35% pour la valve pulmonaire ont été provisoirement suggérées comme un critère d’insuffisance sévère[49]. Pour la quantification d’une insuffisance mitrale, il est nécessaire de comparer le volume d’éjection obtenu par cartographie de flux au niveau de l’aorte ascendante (méthode des flux) avec le volume d’éjection calculé à partir des volumes télédiastolique et télésystolique du ventricule gauche (méthode des volumes). En l’absence d’insuffisance valvulaire aortique, le volume d’éjection est similaire pour les deux méthodes. En cas d’insuffisance mitrale isolée, la différence entre le volume d’éjection par méthode des volumes et le volume d’éjection par méthode des flux correspond au volume régurgitant à travers la valve mitrale[49]. Un protocole spécifique a été proposé pour caractériser la morphologie de la valve mitrale en cas d’insuffisance significative, afin de détecter la présence d’un prolapsus localisé et d’en estimer la sévérité[50]; cette étude montre la faisabilité de la technique mais ne compare pas ses performances à celles de l'échocardiographie trans-thoracique ou trans-oesophagienne. Pour l’insuffisance tricuspide, la planimétrie de l’orifice régurgitant à la vena contracta sur une séquence de cartographie de flux a été suggéré[49]. Pour l’évaluation de la sténose aortique, la mesure du gradient maximal peut s’effectuer par cartographie de flux, en plaçant de façon très soigneuse le plan de mesure, perpendiculaire au flux et à l’endroit de l’accélération maximale. Une bonne corrélation a été montrée entre l’IRM et l’échocardiographie pour la mesure du gradient maximal[51]. La surface d’ouverture de la valve peut être estimée par équation de continuité[52] ou par planimétrie directe[53]. Sur le plan technique, rappelons que les mesures par cartographie de flux sont des mesures délicates qui requièrent de l’expérience de la part de l’opérateur. Le plan de mesure doit être soigneusement placé perpendiculairement au flux sanguin afin d’éviter toute sous-estimation des débits. Un champ magnétique très homogène est requis et une correction pour les inhomogénéités du champ peut s’avérer nécessaire lors de l’analyse des données[54]. Enfin, pour l’évaluation d’une insuffisance aortique, il faut se rappeler que le plan valvulaire se déplace vers l’apex en systole et vers l’aorte en diastole alors que le plan de mesure par l’IRM reste immobile. En diastole, le plan valvulaire se déplace donc en direction opposée au flux régurgitant, ce qui implique une sous-estimation systématique du volume régurgitant. Le degré de sous-estimation sera d’autant plus important que le la fonction systolique longitudinale du ventricule gauche est dynamique[49].
Cardiopathies congénitales
L’IRM cardiaque est actuellement incontournable pour l’évaluation des cardiopathies congénitales. Les protocoles d’imagerie sont souvent complexes et doivent être ajustés à la pathologie de chaque patient. Ils associent, de façon variable, une évaluation morphologique de la disposition des organes intra-thoraciques et de l’arrangement des cavités cardiaques (séries de coupes diastoliques en « sang noir » ou « sang clair », ou acquisition d’un bloc 3D en respiration libre), une mesure de la taille et de la fonction des ventricules (séquences ciné), une évaluation de la perméabilité des conduits veineux ou chirurgicaux (séquences ciné, séquences d’angiographie), le dépistage de shunts intracardiaques (cartographie de flux), une évaluation de la fonction des valves (séquences ciné, cartographie de flux), la recherche de fibrose myocardique ou de cicatrice d’infarctus (rehaussement tardif, notamment après opérations nécessitant une réimplantation des artères coronaires), une évaluation de la perfusion myocardique en cas d’anomalies coronaires, une évaluation morphologique de l’anatomie des gros vaisseaux (avec notamment la recherche d’anomalies des branches de l’arche aortique ou de coarctation aortique par séquences d’angiographie), ou la localisation de collatérales aorto-pulmonaire ou de shunts chirurgicaux (séquences d’angiographie). Une partie importante de cette évaluation morpho-fonctionnelle peut être effectuée par échocardiographie. Cependant, son caractère multimodal et sa capacité de visualiser sans restriction les organes intra-thoraciques (notamment les cavités cardiaques droites, les veines pulmonaires, les gros vaisseaux et les conduits chirurgicaux) font de l’IRM le procédé d’imagerie de choix des cardiopathies congénitales. Au vu de la complexité des protocoles d’acquisition, il est important de planifier à l’avance le protocole d’imagerie pour un patient particulier en fonction de son histoire clinique, de ses antécédents chirurgicaux et de la problématique actuelle. Des recommandations synthétiques ont été publiées par les sociétés savantes concernées afin d’aider le radiologue et le cardiologue dans cette tâche[55].
Cardiomyopathies
Cardiomyopathie hypertrophique (CMH)
Les formes classiques de CMH avec hypertrophie asymétrique du septum sont facilement reconnues en échocardiographie qui permet une mesure précise de l’épaisseur des parois myocardiques, l’évaluation de la morphologie et de la fonction de la valve mitrale et la détection d’obstruction dynamique de la chambre de chasse du ventricule gauche. Sur le plan de l’évaluation morphologique, l’IRM cardiaque, en utilisant des séquences ciné en long axe et court axe des ventricules, est supérieure à l’échocardiographie pour la détection des formes atypiques, et en particulier de la CMH apicale[56],[57]. Elle est également utile pour différencier la CMH d’une hypertrophie physiologique chez un sportif d’élite[58]. Les images ciné en long axe (3 et 4 cavités) peuvent détecter un mouvement antérieur systolique de la valve mitrale et la présence de flux turbulent dans la chambre de chasse, suggérant une possible obstruction dynamique (cardiomyopathie hypertrophique obstructive). Toutefois, la résolution temporelle de l’IRM, nettement inférieure à celle de l’échocardiographie, ne permet pas d’apprécier en détail le mouvement rapide du feuillet antérieur de la valve mitrale et la présence d’une obstruction dynamique significative ne peut pas être identifiée avec certitude. Il est ainsi préférable d’y associer une évaluation par échocardiographie avec mesure Doppler de la vitesse du flux de la chambre de chasse gauche. Dans la CMH, le rehaussement tardif identifie fréquemment une fibrose localisée aux points d’insertion du ventricule droit dans le septum. Cette zone où s’enchevêtrent les fibres issues des deux ventricules semble être particulièrement susceptible au développement de fibrose dans diverses cardiomyopathies ; elle n’est donc pas spécifique de la CMH et sa valeur pronostique est incertaine. Le rehaussement tardif est parfois détecté dans d’autres localisations myocardiques, et principalement dans les zones les plus hypertrophiées. À l’inverse de la fibrose de l’infarctus myocardique, homogène et de distribution sous-endocardique, le rehaussement de la CMH se distribue habituellement en patches irréguliers d’hyper-intensité variable. Il est tentant d’associer le degré de fibrose par rehaussement tardif à un pronostic plus défavorable ; cependant, bien que la présence de rehaussement tardif ait été associée à la présence de tachycardies ventriculaires non-soutenue et à une fréquence accrue d’extrasystoles ventriculaires, une corrélation directe n’a pas été établie de façon satisfaisante entre la fibrose myocardique et la mort subite[59],[60],[61]. La présence de fibrose étendue a été associée avec une évolution vers la cardiopathie dilatée et la dysfonction systolique[62].
Cardiomyopathie dilatée
Le volume ventriculaire gauche et sa fraction d’éjection sont mesurés avec précision et reproductibilité sur les séquences ciné. La cardiopathie ischémique est le principal diagnostic différentiel et le rehaussement tardif offre un outil pour différencier une cardiomyopathie dilatée d’une cardiopathie dilatée d’origine ischémique[63]. La présence de rehaussement sous-endocardique atteste d’épisodes ischémiques anciens et suggère une origine ischémique à la dysfonction ventriculaire. En l’absence de maladie coronarienne, le rehaussement sous-endocardique est en général absent, mais on peut observer, dans environ 35% des cas de cardiomyopathie dilatée, un rehaussement linéaire de distribution medio-ventriculaire, correspondant histologiquement à une bande de fibrose. La présence d’une bande de fibrose linéaire a été associée à un pronostic plus défavorable dans la cardiomyopathie dilatée[64]. Bien qu’elle apporte des informations pronostiques utiles dans la cardiomyopathie dilatée, l’IRM n’est pas recommandée actuellement comme le moyen de référence pour exclure une maladie coronarienne sous-jacente selon les recommandations actuelles[65]. Relevons enfin la possibilité d’une évaluation de la déformation et de la synchronisation myocardique par les séquences de tagging, qui pourrait à l’avenir complémenter l’évaluation échocardiographique dans le bilan avant implantation d'une thérapie de resynchronisation[66].
Dysplasie arythmogène du ventricule droit (DAVD)
Le diagnostic précoce de la DAVD est difficile à poser en raison d’une longue phase dormante initiale de la maladie ; il comprend plusieurs critères décrits en 1994 par la ARVD Task Force[67], révisés au début de l’année 2010[68]. Ces critères, spécifiques mais relativement peu sensibles pour le diagnostic de DAVD, regroupent des anomalies morphologiques, ECG, histologiques et cliniques. L’IRM cardiaque est le procédé d’imagerie de choix du ventricule droit et permet d’évaluer de façon très précise son volume et sa fonction systolique globale, et de détecter des anomalies de la cinétique segmentaire. Les anomalies retenues comme critères majeurs ou mineurs de la maladie sont la présence soit d’une akinésie ou d’une dyskinésie régionale, soit d’une asynchronie de contraction du ventricule droit, pour autant qu’elles s’accompagnent d’une dilatation du ventricule ou d’une dysfonction systolique. Les nouvelles recommandations de la Task Force introduisent des seuils de normalité pour le volume du ventricule droit et sa fraction d’éjection, offrant une meilleure reproductibilité des critères diagnostiques. Rappelons que la recherche d’infiltration fibro-adipeuse du myocarde par IRM à l’aide de séquences T1 avec et sans saturation de graisse ne fait pas partie des critères diagnostiques de DAVD et que la présence d’infiltration doit être prouvée en histopathologie. Il est également important de souligner que le diagnostic de dysplasie arythmogène ne s’établit pas uniquement sur la base de la morphologie du ventricule droit en IRM cardiaque, mais qu’il requiert l’intégration de ce résultat avec d’autres données ECG, cliniques et histopathologiques.
Amyloïdose
L’amyloïdose cardiaque consiste en l’accumulation dans l’espace interstitiel de diverses protéines – l’atteinte cardiaque est principalement liée à l’amyloïdose de type chaînes légère d’immunoglobulines (AL) ou de type transthyretin (TTR), en conformation insoluble de fibrilles amyloïdes, conduisant à une dysfonction diastolique puis à une cardiomyopathie restrictive. Dans les cas typiques, les séquences ciné montrent un épaississement homogène et concentrique du myocarde des deux ventricules, un épaississement des feuillets valvulaires, une dilatation des deux oreillettes et la présence d’un épanchement péricardique. La fraction d’éjection des ventricules est préservée jusque dans les phases tardives de la maladie, mais on peut observer déjà précocement une réduction marquée de la contraction longitudinale avec préservation de la contraction radiale. La cinétique de distribution du produit de contraste dans le myocarde est altérée en cas d’amyloïdose, permettant d’obtenir une orientation diagnostique non-invasive et spécifique à l’aide des séquences de rehaussement tardif. On observe en effet une évacuation rapide du produit de contraste du pool sanguin avec un rehaussement des zones myocardiques les plus infiltrés par la protéine amyloïde, généralement sous-endocardiques[69]. La singularité de cette cinétique de distribution est la disparition très précoce du produit de contraste de la cavité ventriculaire, comme s’il était « aspiré » dans les tissus par la protéine amyloïde diffusément infiltrée. Le diagnostic d’amyloïdose peut être fortement suggéré à l’aide de séquences TI-scout (ou look-locker), des séquences de repérage consistant à répéter une acquisition en rehaussement tardif d’une coupe court axe du ventricule gauche, en incrémentant à chaque acquisition la valeur du temps d’inversion (TI), par exemple entre 80 ms et 400 ms. Les caractéristiques de l’amyloïdose dans cette séquence sont d’une part l’impossibilité de trouver un TI capable d’annuler complètement et de façon homogène le signal du myocarde, et d’autre part une séquence paradoxale d’annulation de signal, avec l’annulation de la majorité (>50%) du signal myocardique à des TI plus courts que celle du signal de la cavité ventriculaire[70]. L’image typique est celle d’un rehaussement diffus sous-endocardique en présence d’une cavité ventriculaire de signal hypo-intense (pour rappel, chez les patients sans amyloïdose, la cavité ventriculaire reste claire, d’intensité intermédiaire entre le myocarde de signal complètement annulé et les zones de fibrose hyperintenses). Il est important de rappeler qu’en cas de suspicion d’amyloïdose, ces séquences de rehaussement « tardif » doivent s’effectuer précocement (<4 minutes) après injection de gadolinium en raison de l’évacuation rapide du contraste dans les tissus, au contraire des séquences de rehaussement tardif standard, effectuées au moins 10 minutes après injection de gadolinium.
Hémochromatose
Les séquences dédiées à l’hémochromatose en IRM permettent de mesurer le temps de relaxation T2* à partir d’acquisitions répétées en écho de gradient, en incrémentant à chaque acquisition la valeur du temps d’écho (TE). L’infiltration martiale du myocarde cause un déphasage plus rapide des spins des protons induisant une réduction du temps T2* proportionnelle à la sévérité de l’infiltration. Des valeurs de T2* inférieures à 10 ms ont été associées au développement d’insuffisance cardiaque[71] et il a été montré que l’initiation et l’intensification d’un traitement chélateur en fonction des indices mesurés en IRM induit une réduction de la mortalité cardiaque chez ces patients[72]. L’IRM est donc un outil central dans l’évaluation de la sévérité de la maladie et dans l’optimisation des traitements. Il faut souligner que la sévérité de l’infiltration myocardique n’est pas forcément corrélée à celle de l’infiltration hépatique et que le résultat d’une biopsie hépatique ne permet pas de présumer de la sévérité de l’atteinte myocardique ; cette constatation a son importance si l’on garde à l’esprit que le pronostic de ces patients est largement conditionnée par la sévérité de l’atteinte cardiaque.
Myocardite
La myocardite est une atteinte inflammatoire du myocarde, d’origine le plus virale ou post-virale (la maladie de Chagas, une infection parasitaire, représente un diagnostic différentiel important en Amérique du Sud). Le tableau clinique en phase aiguë associe fréquemment des douleurs thoraciques, des anomalies ECG de type péricardite et une élévation de la concentration sérique de troponine, attestant d’un dommage myocardique. La fonction systolique des ventricules est le plus souvent préservée ou légèrement diminuée, mais des atteintes fulminantes avec dysfonction systolique sévère et choc cardiogène sont possibles. La myocardite aiguë peut évoluer vers une résolution complète ou progresser vers une dysfonction systolique[73]. Il a été suggéré que la myocardite virale contribue de façon importante au développement de la cardiomyopathie dilatée jusque dans 60% des cas[74],[75]. L’IRM cardiaque mesure avec précision les volumes ventriculaires et la fraction d’éjection. Des anomalies de la cinétique segmentaire sont occasionnellement détectées, de même que la présence d’épanchement péricardique. En IRM, les séquences de rehaussement tardif mettent en évidence une fibrose myocardique dont la distribution est typiquement sous-épicardique ou medio-ventriculaire et touche fréquemment la paroi latérale[76] ; dans les cas où la présentation clinique est équivoque, la distribution du rehaussement tardif aide à différencier une atteinte inflammatoire (rehaussement épicardique ou medio-ventriculaire) d’une atteinte ischémique (rehaussement sous-endocardique) ; dans une minorité de cas, le rehaussement est transmural, et l’IRM ne permet pas de distinguer les deux étiologies. Il a été suggéré que la localisation de la fibrose et de l’inflammation, ainsi que le pronostic étaient corrélés à l’étiologie virale : une atteinte sous-épicardique de la paroi inférolatérale était associée à la présence de génome de parvovirus B19 et à une résolution spontanée alors qu’une atteinte septale était associée au virus herpès HHV-6 (ou à l’association HHV-6 et parvovirus B19) avec un risque plus élevé de progression vers l’insuffisance cardiaque[77]. En phase aiguë, un œdème myocardique est fréquemment détecté à l’aide des séquences en pondération T2, de même qu’un hypersignal dans les séquences de rehaussement précoce après injection de gadolinium ; ces séquences sont proposées, en plus de l’étude des volumes et du rehaussement tardif, pour le diagnostic de la myocardite en IRM[78].
Sarcoïdose cardiaque
La sarcoïdose est une maladie inflammatoire systémique impliquant le myocarde. Une atteinte myocardique est fréquente mais difficile à diagnostiquer dans les phases précoces de la maladie et n’est reconnue que dans une minorité des cas. L’atteinte cardiaque se manifeste par une dilatation ventriculaire avec dysfonction systolique progressive, ou par des arythmies ventriculaires. Alors que les atteintes tardives avec dysfonction ventriculaire et anomalies de la cinétique segmentaire peuvent être facilement reconnues à l’échocardiographie, l’IRM peut détecter une atteinte myocardique à un stade précoce[79], et guider le traitement immunosuppresseur afin de tenter de retarder la survenue de complications. Le rehaussement tardif permet la détection de patches hyperintenses d’inflammation et de fibrose myocardique. Les séquences pondérées en T2 détectent fréquemment un signal hyperintense dans ces mêmes zones en phase aiguë. La présence de patches de rehaussement tardif détecte une atteinte cardiaque de la sarcoidose avec plus de sensibilité que les critères cliniques actuellement recommandés (Japanese Ministry of Health JMH guidelines) et semble associée à un pronostic plus défavorable[80].
Fibrose endomyocardique
Il s’agit d’une cardiopathie acquise, associée à un syndrome hyperéosinophile idiopathique, caractérisée par une inflammation de l’endocarde et la présence de thrombus comblant l’apex d’un ou des deux ventricules. La maladie peut évoluer vers une véritable fibrose de l’apex ventriculaire avec développement d’une cardiopathie restrictive. L’IRM montre sur les séquences ciné un ventricule de taille et de fonction systolique normales, ainsi que la présence d’un comblement de l’apex. Le rehaussement précoce et tardif permet d’identifier la présence de fibrose endocardique et de thrombus moulant l’apex ventriculaire[81].
Maladies du péricarde
L’échocardiographie comme l’IRM détectent facilement un épanchement péricardique et mettent en évidence le cas échéant des signes de tamponnade. La péricardite constrictive est un diagnostic plus difficile à poser, nécessitant souvent l’association des résultats morphologiques (échocardiographie, IRM, CT), hémodynamiques et d’écho-Doppler (présence de variations respiratoires pathologiques des flux trans-valvulaires ou veineux hépatiques). Le CT-scan thoracique peut contribuer au diagnostic en détectant un épaississement du péricarde ou la présence de calcifications péricardiques. Un épaississement péricardique significatif (>4 mm) est suggestif d’une péricardite constrictive en présence d’une clinique compatible ; il faut toutefois souligner qu’un péricarde épaissi peut se rencontrer sans physiologie de constriction, et que jusqu’à 18% des patients présentant une péricardite constrictive confirmée ont un péricarde d’épaisseur normale (<2 mm)[82]. En IRM, le péricarde se présente comme une ligne hypointense flanquée de deux bandes graisseuses hyperintenses – épicardique et péricardique, dans les séquences en pondération T1. Il est ainsi facile de mesurer l’épaisseur du péricarde mais les calcifications péricardiques ne sont pas détectées (signal nul). Dans les séquences de rehaussement tardif, le péricarde apparaît hyper-intense en cas d’inflammation active. Sur le plan morphologique, la péricardite constrictive se caractérise par un péricarde épaissi, des cavités cardiaques aplaties ou de forme tubulaire, et une dilatation importante de la veine cave inférieure et des veines sus-hépatiques[83]. L’IRM permet enfin de dépister une interférence entre le ventricule droit et le ventricule gauche durant le cycle respiratoire. Des séquences ultra-rapides et de faible résolution permettent l’acquisition d’une coupe myocardique complète lors de chaque battement cardiaque, offrant une évaluation de la fonction systolique en temps réel. Un déplacement brusque du septum interventriculaire en direction du ventricule gauche à l’initiation de l’inspirium, et un retour brusque en position normale à l’initiation de l’expirium sont caractéristiques d’une physiologie constrictive[84]. Ce signe est d’une aide précieuse pour le diagnostic de péricardite constrictive, en particulier chez les patients en fibrillation auriculaire pour lesquels l’évaluation des variations respiratoires des flux Doppler est particulièrement fastidieuse.
Tumeurs cardiaques
Les tumeurs primaires du myocarde sont très rares, avec une incidence estimée à moins de 0.3%, dont 75% de tumeurs bénignes ; les tumeurs secondaires, ou métastases de tumeurs extracardiaques sont en revanche plus fréquentes, d’une incidence au moins 20 fois plus élevée. De par sa capacité de caractériser les tissus mous, l’IRM cardiaque est un outil unique pour le diagnostic des tumeurs cardiaques. Des séries de coupes morphologiques en « sang noir » ou « sang clair » précisent l’anatomie et l’extension de la masse tumorale ainsi que sa relation avec les structures cardiaques et thoraciques. Des coupes ciné standard évaluent la fonction systolique des ventricules et détectent la présence d’épanchement péricardique. Pour la caractérisation tissulaire, on construit un plan coupant la masse tumorale de façon optimale, et l’on applique successivement différentes séquences afin d’en analyser sa composition. Le protocole idéal pour la caractérisation d’une masse myocardique n’est pas clairement défini, mais peut inclure des séquences en pondération T1 (comparaison de l’intensité de la masse tumorale avec l’intensité du myocarde normal, détection de contenu adipeux de signal hyperintense) associées ou non à une pré-impulsion de saturation de graisse, des séquences en pondération T2 (recherche d’œdème, pouvant suggérer une haute activité mitotique ou une composante kystique/myxomateuse), une séquence de perfusion de repos (évaluation de la vascularisation), l’analyse du rehaussement précoce (recherche de zones de thrombose ou de nécrose avasculaire) et de rehaussement tardif (recherche de fibrose ou de nécrose)[85].
Myxome de l’oreillette
Il s’agit de la tumeur primaire cardiaque la plus fréquente. Elle est en général bénigne et se présente le plus souvent comme une masse gélatineuse, pédiculée, attachée au versant gauche du septum inter-auriculaire et flottant dans la cavité de l’oreillette gauche (75%). Dans 20% des cas, le myxome se situe dans l’oreillette droite, et rarement dans l’un ou l’autre ventricule. La croissance de cette tumeur est rapide. En IRM, le myxome est caractérisé par un signal intense en pondération T2, une bonne perfusion de repos et un rehaussement tardif hétérogène après injection de gadolinium. Un thrombus est parfois accolé à la masse tumorale, bien reconnaissable après injection de gadolinium[86].
Fibroelastome
Le fibroélastome est une petite tumeur mobile et pédonculée, sise le plus souvent sur les valves cardiaques. Il est de signal hyperintense dans les séquences des rehausement tardif après injection de gadolinium[87].
Lipome
Situé le plus souvent au niveau du septum interauriculaire, le lipome peut être intra-myocardique dans une minorité de cas. De structure essentiellement cellulaire, le lipome présente un signal intense en pondération T1, qui s’annule complètement dans les séquences de saturation de graisse. Sa perfusion est peu marquée et son rehaussement tardif après injection de gadolinium est faible.
Fibrome
Tumeur bénigne peu fréquente, le fibrome est le plus souvent intra-myocardique au niveau ventriculaire, et peut mimer une hypertrophie myocardique localisée ou une cardiomyopathie hypertrophique. L’intensité de son signal en T1 est très proche de celle du myocarde normal mais on observe un intense rehaussement tardif après injection de gadolinium. Le centre de la tumeur se rehausse souvent plus faiblement, probablement en raison d’une plus faible vascularisation[88].
Lymphome
Il s’agit d’une tumeur myocardique maligne. Rarement primaire, en général en association avec le HIV, elle se rencontre plus fréquemment au niveau cardiaque comme métastase d’un lymphome d’autre origine. Elle est caractérisée par une ou plusieurs masses polylobées infiltrant le muscle cardiaque et situées en général au niveau des ventricules. Une compression des cavités cardiaques, de l’anneau tricuspide ou des veines caves peut être observée. Un épanchement péricardique est souvent associé. L’IRM cardiaque est utile pour délimiter l’extension intra-thoracique de la tumeur, mais la caractérisation tissulaire manque de spécificité. On observe un signal homogène en pondération T1 et un signal intense en pondération T2, reflétant l’œdème tumoral. La perfusion est importante et le rehaussement précoce et tardif souvent inhomogènes, variant selon leur degré de cellularité.
Sarcomes
Il s’agit des tumeurs malignes primaires les plus fréquentes au niveau cardiaque. Les types histologiques les plus fréquents sont l’angiosarcome et le fibrosarcome. Ces tumeurs sont volumineuses, de croissance rapide, infiltrant le plus souvent le myocarde de l’oreillette et du ventricule droits. Un épanchement péricardique hémorragique est fréquemment associé. La caractérisation tissulaire du sarcome en IRM est peu spécifique ; il n’est souvent pas possible de différencier un sarcome d’un lymphome cardiaque, bien que le signal du sarcome soit souvent décrit comme très hétérogène en pondération T1 en raison de fréquentes zones d’hémorragie intra-tumorale[89]. Un diagnostic par biopsie est essentiel afin d’orienter le traitement.
Métastases cardiaques et péricardiques
Vingt à quarante fois plus fréquentes que les tumeurs malignes primaires, les néoplasies secondaires sont souvent multiples et associées à un volumineux épanchement péricardique, avec ou sans tamponnade. Les tumeurs primaires le plus souvent associées à des métastases cardiaques sont les cancers du poumon et du sein (invasion directe par continuité ou dissémination hématogène ou lymphatique), les cancers du rein et le carcinome hépatocellulaire (invasion de la veine cave inférieure), ainsi que le mélanome, le lymphome et les sarcomes (par dissémination hématogène)[90]. Les caractéristiques morphologiques suggestives de malignité sont une localisation autre que le ventricule ou l’oreillette gauche, un signal inhomogène, un aspect infiltratif, une dimension supérieure à 5 cm, la présence d’un épanchement péricardique ou pleural, et la présence de rehaussement après injection de gadolinium. Aucune de ces caractéristiques n’est diagnostique de malignité à elle seule, mais la combinaison de plusieurs de ces caractéristiques augmente la probabilité d’une origine maligne[91]. Rappelons enfin que grâce à son large champ d’imagerie (field of view), l’IRM cardiaque permet dans le même temps de détecter une tumeur intrathoracique extracardiaque, la présence de métastases pulmonaires ou un comblement tumoral de la veine cave inférieure. Ces informations permettent également de mieux orienter le diagnostic final.
Imagerie des gros vaisseaux
L’IRM procure une imagerie complète de l’aorte thoracique permettant la détection d’anévrysmes, de coarctation ou de dissection. La sensibilité de l’IRM cardiaque pour la détection d’une dissection aortique est excellente et comparable à celle de l’angio-CT ; toutefois, l’accès plus restreint à l’IRM en urgence favorise souvent l’utilisation du CT en phase aiguë. L’absence d’exposition aux radiations fait en revanche de l’IRM le procédé d’imagerie de choix pour le suivi de ces patients. En l’absence de dissection, l’IRM permet d’identifier d’autres causes de syndrome aortique aigu, comme l’hématome intramural, ou l’ulcère aortique. Le protocole d’imagerie comprend des séries de coupes axiales en « sang noir » et en « sang clair », des séries de coupes sagittales obliques, suivant l’axe de l’arche aortique, pour préciser l’anatomie de l’aorte, ainsi qu’une angiographie de l’aorte thoracique[92]. En cas de dissection, l’angiographie confirme la perméabilité des branches aortiques et détermine leur relation avec la vraie ou la fausse lumière de l’aorte. En cas de coarctation, l’IRM permet d’évaluer la sévérité de la sténose et l’abondance des vaisseaux collatéraux. La comparaison des débits en amont de la coarctation et au niveau de l’aorte diaphragmatique par cartographie de flux permet une quantification du flux collatéral. Si la coarctation a été traitée par stenting aortique, il est important de rappeler que la structure métallique du stent peut causer des artefacts de susceptibilité, particulièrement dans les séquences d’écho de gradient, rendant difficile l’évaluation de la perméabilité du stent. Le CT scan apporte un complément d’information important dans ces cas sélectionnés.
Ressources
Les sociétés européenne (EuroCMR) et américaine (SCMR) d’IRM cardiaque émettent de multiples recommandations pour la bonne pratique de l’IRM cardiaque et la standardisation des techniques. Ces recommandations sont publiées dans la littérature médicale et décrivent le cursus reconnu de formation en IRM cardiaque[93], proposent des protocoles d’imagerie standard[94] et une systématique concernant la manière de rapporter les examens[95].
Cholangio-IRM
L'étude des voies biliaires et pancréatiques par l'IRM de manière non invasive est une nouvelle approche des bilans d'imagerie des pathologies hépato-pancréatico-biliaires.
IRM fonctionnelle (IRMf)
La méthode la plus utilisée actuellement est celle basée sur l’aimantation de l’hémoglobine contenue dans les globules rouges du sang. L’hémoglobine se trouve sous deux formes :
- les globules rouges oxygénés par les poumons contiennent de l’oxyhémoglobine (molécule non active en RMN) ;
- les globules rouges désoxygénés par le métabolisme des tissus contiennent de la désoxyhémoglobine (active en RMN car fortement paramagnétique).
En suivant la perturbation du signal de RMN émis par cette molécule, il est donc possible d’observer l’afflux de sang oxygéné, qui chasse le sang désoxygéné. Lorsqu'une zone du cerveau augmente son activité, un afflux de sang oxygéné lui parvient grâce à un mécanisme combinant la dilatation des vaisseaux sanguins à divers autres mécanismes mal élucidés, ce qui répond ainsi à la demande de consommation locale en dioxygène des cellules actives : c'est le signal BOLD. En faisant l’acquisition d’images pondérées T2* à une cadence rapide (environ une image toutes les secondes, voire moins), il est possible de suivre en direct, sous forme de film, les modulations de débit sanguin liées à l’activité cérébrale, par exemple lors d'une tâche cognitive.
Article détaillé : Imagerie par résonance magnétique fonctionnelle.IRM paramétrique
Cette méthode consiste à mesurer par IRM des paramètres hémodynamiques ou de perméabilité des vaisseaux capillaires, dont les calculs dérivent d'un modèle mathématique appliqué aux données d'imagerie obtenues dans des conditions particulières. En général il s'agit de séquences dites dynamiques car avec une résolution temporelle élevée, permettant de suivre l'évolution de l'intensité de signal après injection d'un produit de contraste paramagnétique. Cette méthode permet de calculer le flux et le volume sanguin d'un tissu, et la perméabilité des capillaires (microvaisseaux) de ce tissu. Cette méthode semble très prometteuse en cancérologie pour déterminer quand une tumeur est cancéreuse, mais reste utilisée de façon très marginale compte tenu du haut niveau technique nécessaire. Actuellement, seules les universités américaines disposent de tels équipements.
Imagerie du tenseur de diffusion
Article détaillé : Imagerie du tenseur de diffusion.L’imagerie du tenseur de diffusion (DTI) est une technique basée sur l'IRM qui permet de visualiser la position, l’orientation et l’anisotropie des faisceaux de matière blanche du cerveau.
Spectroscopie RMN
Il permet l'étude de la présence et concentration de certains métabolites. Son application est encore rare, il demande des IRM de haut-champ (1,5 Tesla minimum et 3 Tesla pour obtenir des pics bien différenciés) et des formations spécifiques pour les radiologues.
Cependant la technique semble très prometteuse notamment en oncologie, par exemple, il permet de faire la différence entre récidive locale et nécrose post-radiothérapique dans un stade précoce avec une précision que, seule, une biopsie (invasive et parfois risquée) peut égaler.
Déroulement de l'examen médical IRM
Un examen IRM anatomique dure en général entre 10 à 30 minutes. Un ensemble complet d'examens prend souvent entre une demi-heure et une heure pleine. L'examen est absolument sans douleur. Le patient est allongé sur une table d'examen motorisée. Au cours de l'acquisition, il ne doit pas bouger : la table se déplace automatiquement pour le faire passer dans l'antenne. Les seules gênes à en attendre sont le bruit notable (mais assurément pas assourdissant) et la sensation d'enfermement (le corps étant dans un tube ouvert) pouvant poser quelques problèmes chez certains claustrophobes. En général, le ou les manipulateurs en électroradiologie médicale restent en contact constant avec le patient qui peut même faire une petite sieste (tout en restant immobile).
L'examen IRM se réalise sur un patient en pyjama ; il doit retirer montres, bijoux, ceinture, clés, carte de crédit à puce ou magnétique, pièces de monnaie etc... c'est-à-dire tout élément métallique qui pourrait être attiré par l'aimant. Les accompagnants (parents s'il s'agit d'enfants) doivent également se séparer de ces accessoires pour pénétrer dans la salle de l'appareil d'imagerie.
Indications
L'Imagerie par Résonance Magnétique a l'avantage d'apporter une bonne visualisation de la graisse, de l'eau, donc de l'œdème et de l'inflammation avec une bonne résolution et un bon contraste.
En particulier, l'IRM permet d'imager la fosse sous-tentorielle de l'encéphale, dont l'exploration est difficile en CT-scan à cause d'artéfact de durcissement de faisceaux.
Cette imagerie n'est pas adaptée à l'étude des tissus pauvres en protons comme les tendons et le tissus osseux.
Les éléments anatomiques étudiés par l'IRM :
- Le cerveau et la moelle épinière :
-
- Diagnostic des maladies neurologiques inflammatoires (Sclérose en plaque),
- La fosse postérieure du cerveau est particulièrement bien visible par l'IRM (ce qui n'est pas le cas par le scanner cérébral),
-
- Le rachis : Hernie discale et toutes les pathologies disco-somatiques, lésions traumatiques du rachis et de la moelle, la spondylodiscite infectieuse,
- Les viscères digestifs et pelviens ainsi que les muscles,
- Les articulations et les structures adjacentes (hanches, genoux, ménisques, ligaments croisés), notamment chez les sportifs,
- Les processus tumoraux, même osseux.
- Les gros vaisseaux comme l'aorte et ses branches (artères rénales, iliaques), les vaisseaux cérébraux et cervicaux sont étudiés pour le bilan de maladie athéromateuse, des dissections, sténoses (artérite oblitérante des membres inférieurs). L'artère pulmonaire peut être analysée par l'ARM dans le cadre de l'embolie pulmonaire.
- Les malformations artério-veineuse mais aussi les malformations cardiaques congénitales (tétralogie de Fallot, atrésie pulmonaire, transposition des gros vaisseaux).
- Les arbres hépato-biliaire et pancréatico-biliaire sont étudiés dans certaines pathologies hépatiques (CBP) et pancréatiques (tumeur du pancréas, insuffisance pancréatique exocrine) (cholangio-IRM) ainsi que le système porte (en ARM).
Contre-indications
Les contre-indications[96] au passage d'examen IRM sont :
- la présence de métaux susceptibles de se mobiliser dans le corps :
-
- clips vasculaires cérébraux surtout chez les patients opérés d'un anévrisme cérébral.
- corps étranger métallique ferro-magnétique intra-oculaire ou dont la mobilisation exposerait le patient à des blessures. (Accident de chasse, accident de meulage...).
- valves cardiaques non compatibles, ce qui est le cas de la valve Starr-Edwards pré 6000. La plupart des valves cardiaques sont compatibles avec l'examen IRM.
- Les clips caves inférieurs, clips de trompe de Fallope ou stents coronaires nécessitent une précaution d'emploi. Les différentes prothèses (hanche, genou) ne sont pas des contre-indications.
- On respectera, malgré une compatibilité avérée, un délai après chirurgie. Celui-ci se situant généralement entre 3 et 6 semaines après la pose du matériel. Ce délai correspond au temps nécessaire pour que les différents tissus de l'organisme adhèrent au matériel et le "stabilisent".
- En revanche, il n'y a pas de délai postchirurgical après ablation de matériel, mais attention aux agrafes chirurgicales.
-
- les dispositifs biomédicaux :
-
- stimulateur cardiaque et défibrillateur cardiaque dont le fonctionnement peut être altéré par le champ magnétique et conduire à des troubles du rythme cardiaque potentiellement mortels.
- pompe à insuline.
- neuro-stimulateur.
- Dispositifs transdermiques (patchs)[97]. Certains de ces dispositifs possèdent un mince halo métallique de protection dans leurs couches superficielles qui peut être cause de brûlures. C'est le cas par exemple de Nitriderm TTS®, Scopoderm TTS® et Neupro® qui contiennent de l'aluminium[98].
-
- l'état du patient :
-
- impossibilité de rester allongé (insuffisance cardiaque ou respiratoire avec orthopnée).
- impossibilité de rester immobile (patient pusillanime, enfants, troubles psychiatriques). Les examens d'imagerie peuvent le cas échéant être réalisés sous prémédication, voire sous anesthésie générale. Il convient alors d'utiliser le seul matériel d'anesthésie homologué pour entrer dans la salle d'IRM.
- la claustrophobie, qui peut faire l'objet des mesures citées précédemment.
- l'allergie au gadolinium ou à son chélateur/ligand[note 2] ou encore à l'excipient[note 3] rarissime. Cependant, le produit est très toxique par extravasation (nécrose des tissus). Il n'existe pas d'interaction connue avec d'autres médicaments.
- insuffisance rénale sévère (uniquement en cas d'injection de produit de contraste).
- la grossesse, en dehors d'indication formelle. Il n'a jamais été démontré d'effet délétère des champs magnétiques sur le fœtus. Mais, par précaution, seules les indications mettant en jeu le pronostic vital ou fonctionnel de la mère sont validées. En cas d'injection de gadolinium : il y a un passage lent de la barrière placentaire (constaté uniquement sur spécimen murin).
- allaitement : en cas d'injection de gadolinium uniquement : excrétion faible dans le lait maternel (constaté uniquement sur spécimen murin), recommandation de traite et élimination du lait pendant 24 à 48 heures suivant l'injection.
-
Avec ces précautions, l'imagerie par résonance magnétique est totalement non invasive (excepté, s'il y a indication, l'injection de produit de contraste) et sans irradiation.
Notes et références
Notes
- Le terme nucléaire (du latin nucleus, noyau) renvoie donc simplement au fait que cette technique repose sur les propriétés des noyaux atomiques mais n'a pas de lien avec les processus de fission nucléaire qui produisent les rayonnements ionisants dont les effets peuvent être dangereux sur la santé. Le nom complet de l'IRM devrait donc en réalité être IRMN, imagerie par résonance magnétique nucléaire mais pour ne pas effrayer les patients qui associent souvent, et à tort, le mot nucléaire avec la radioactivité, on omet souvent le terme « nucléaire » pour parler simplement d'IRM
- Une réaction allergique au produit de contraste en IRM est dans la grande majorité des cas due à une intolérance du chélateur (molécule cage) et non au gadolinium. De plus, les différents fabricants de PdC utilisent des chélateurs différents, DTPA-Gd (MAGNEVIST) ou DOTA-Gd (DOTAREM) sont deux exemples. Ceci permet de renouveler un examen avec injection en utilisant une autre marque s'il y a eu réaction avec la première
- Le plus souvent, il s'agit de méglumine, la réaction d'allergie à cet excipient est extrêmement rare
Références
- (en) Timeline of MRI
- (en) MRI — a new way of seeing, réédition de l'article original de Paul Lauterbur initialement paru dans le journal Nature en 1973.
- parc en France
- [PDF] Neurospin 24-nov-2006
- Note sur l'IRM de très haut champ du projet de recherche NeuroSpin
- [PDF]« Évaluation des IRM dédiées et à champs modéré < 1 T », Haute Autorité de santé, juin 2008.
- Exemple d'image,Exemple d'image
- « IRM hépatique », par Mauro Oddone, de l'hôpital Gaslini à Genova en Italie
- http://www.mrisafety.com
- http://www.kidney.org/professionals/Kdoqi/guidelines_ckd
- http://www.icnfdr.org
- Thomsen HS, European Society of Urogenital Radiology (ESUR). ESUR guideline: gadolinium-based contrast media and nephrogenic systemic fibrosis. Eur Radiol 2007; 17: 2692-6
- Stehling MK, Holzknecht NG, Laub G et al. Single-shot T1- and T2-weighted magnetic resonance imaging of the heart with black blood: preliminary experience. MAGMA 1996; 4: 231-40
- Greenman RL, Shirosky JE, Mulkern RV, et al. Double inversion black-blood fast spin-echo imaging of the human heart: a comparison between 1,5 T and 3,0 T. J Magn Reson Imaging 2003; 17: 648-55
- Thiele H, Nagel E, Paetsch I, et al. Functional cardiac MR imaging with steady-state free precession (SSFP) significantly improves endocardial border delineation without contrast agents. J Magn Reson Imaging 2001; 14: 362-7
- Sorensen TS, Körperich H, Greil GF; et al. Operator-independent isotropic three-dimensional magnetic resonance imaging for morphology in congenital heart disease: a validation study. Circulation 2004; 110: 163-9
- Razavi RS, Hill DL, Muthurangu V, et al. Three-dimensional imaging of congenital cardiac anomalies. Cardiol Young 2003; 13: 461-5
- Giorgi B, Dymarkowski S, Maes F, et al. Improved visualisation of coronary arteries using a new three-dimensional submillimeter coronary angiography sequence with balanced gradients. Am J Roentgenol 2002; 179: 901-10
- Henning J, Speck O, Scheffler K. Optimalization of signal behaviour in the transition to driven equilibrium in steady-state free precession sequences. Magn Reson Med 2002; 48: 801-9
- Francone M, Dymarkowski s, Kalantzi M, et al. Real-time cine MRI of ventricular septal motion : a novel approach to assess ventricular coupling. J Magn Reson Imaging 2005; 21: 305-9
- Simonetti OP, Finn JP, White RD, et al. "Black blood" T2-weighted inversion-recovery MR imaging of the heart. Radiology 2003; 199: 49-57
- Anderson LJ, Holden S, Davis B, et al. Cardiovascular T2-star (T2*) magnetic resonance for early diagnosis of myocardial iron overload. Eur Heart J 2001; 22: 2171-9
- Westwood M, Anderson LJ, Firmin DN, et al. A single breath-hold multiechoT2* cardiovascular magnetic resonance technique for diagnosis of myocardial iron overload. J Magn Reson Imaging 2003; 18: 33-9
- Weinmann HJ, Brasch RC, Press WR, et al. Characteristics of Gadolinium-DTPA complex: a potential NMR contrast agent. AJR Am J Roentgenol 1983; 142: 619-24
- Schwitter J, Nanz D, Kneifel S, et al. Assessment of myocardial perfusion in coronary artery disease by magnetic resonance. A comparison with positron emission tomography and coronary angiography. Circulation 2001; 103: 2230-5
- Nagel E, Klein C, Paetsch I, et al. Magnetic resonance perfusion measurements for the noninvasive detection of coronary artery disease. Circulation 2003; 108: 432-7
- Nijveldt R, Hofman MB, Hirsch A, et al. Assessment of microvascular obstruction and prediction of short-term remodeling after acute myocardial infarction: cardiac MR imaging study. Radiology 2009; 250: 363-70
- Barkhausen J, Hunold P, Eggebrecht H, et al. Detection and characterization of intracardiac thrombi on MR imaging. AJR Am J Roentgenol 2002; 179: 1539-44
- Simonetti OP, Kim RJ, Fieno DS, et al. An improved MR imaging technique for the visualization of myocardial infarction. Radiology 2001; 218: 215-23
- Kim RJ, Shah DJ, Judd RM. How we perform delayed enhancement imaging. J Cardiovasc Magn reson 2003; 5: 505-14
- Beek AM, Kuhl HP, Bondarenko O, et al. Delayed contrast-enhanced magnetic resonance imaging for the prediction of regional functional improvement after acute myocardial infarction. J Am Coll Cardiol 2003; 42: 895-901
- Kilner PJ, Gatehouse PD, Firmin DN. Flow measurement by magnetic resonance: a unique asset worth optimising. J Cardiovasc Magn Reson 2007; 9: 723-8
- Petitjean C, Rougon N, Cluzel P. Assessment of myocardial function. A review of quantification methods and results using tagged MRI. J Cardiovasc Magn Reson 2005; 7: 501-6
- Hudsmith LE, Neubauer S. Magnetic resonance spectroscopy in myocardial disease. JACC Cardiovascular Imaging 2009; 2: 87-96
- Wagner A, Marholdt H, Holly TA, et al. Contrast-enhanced MRI and routine single photon emission computed tomography (SPECT) perfusion imaging for detection of subendocardial myocardial infarcts : an imaging study. Lancet 2003; 361: 374-9
- Kim RJ, Wu E, Rafael A, et al. The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med 2000; 343: 1445-53
- Wu KC, Zerhouni EA, Judd RM et al. Prognostic significance of microvascular obstruction by magnetic resonance imaging in patients with acute myocardial infarction. Circulation 1998; 97: 765-72
- Nijveldt R, Beek A, Hirsch A, et al. Functional recovery after acute myocardial infarction: a comparison between angiography, electrocardiography and cardiovascular magnetic resonance measures of microvascular injury. J Am Coll Cardiol 2008; 52: 181-9
- Wright J, Adriaenssens T, Dymarkowski S, et al. Quantification of myocardial area at risk with T2-weighted CMR: comparison with contrast-enhanced CMR and coronary angiography. JACC Cardiovasc Imaging 2009; 2: 825-31
- Weinsaft JW, Kim RJ, Ross M, et al. Contrast-enhanced anatomic imaging as compared to contrast-enhanced tissue characterization for detection of left ventricular thrombus. JACC Cardiovasc Imaging 2009; 2: 969-79
- Jahnke C, Paetsch I, Nehrke K, et al. Rapid and complete coronary arterial tree visualization with magnetic resonance imaging: feasibility and diagnostic performance. Eur Heart J 2005; 26: 2313-9
- Matter CM, Stuber M, Nahrendorf M. Imaging of the unstable plaque: how far have we got. Eur Heart J 2009; 30: 2566-74
- Pouleur AC, le Polain de Waroux JB, Kefer J, et al. Direct comparison of whole-heart navigator-gated magnetic resonance coronary angiography and 40- and 64-slice multidetector row computed tomography to detect the coronary artery stenosis in patients scheduled for conventional coronary angiography. Circ Cardiovasc Imaging 2008; 1: 114-21
- Schwitter J, Wacker C, van Rossum A, et al. MR-IMPACT: comparison of perfusion-cardiac magnetic resonance with single-photon emission computed tomography for the detection of coronary artery disease in a multicentre, multivendor, randomized trial. Eur Heart J 2008; 29: 480-9
- Ingkanisorn W, Kwong R, Bohme N, et al. Prognosis of negative adenosine stress magnetic resonance in patients presenting to an emergency department with chest pain. J Am Coll Cardiol 2006; 47: 1427-32
- Jahnke C, Nagel E, Gebker R, et al. Prognostic value of cardiac magnetic resonance stress tests: adenosine stress perfusion and dobutamine stress wall motion imaging. Circulation 2007; 115: 1769-76
- Pilz G, Jeske A, Klos M, et al. Prognostic value of normal adenosine-stress cardiac magnetic resonance imaging. Am J Cardiol 2008; 101: 1408-12
- Kivelitz DE, Dohmen PM, Lembcke A, et al. Visualization of the pulmonary valve using cine MR imaging. Acta Radiology 2003; 44: 172-6
- Devos DG, Kilner PJ. Calculations of cardiovascular shunts and regurgitation using magnetic resonance ventricular volume and aortic and pulmonary flow measurement. Eur radiol 2010; 20; 410-21
- Chan KM, Wage R, Symmonds K, et al. Toward comprehensive assessment of mitral regurgitation using cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2008; 10: 61
- Eichenberger AC, Jenni R, Schulthess GK, et al. Aortic valve pressure gradients in patients with aortic valve stenosis: quantification with velocity-encoded cine MR imaging. AJR Am J Roentgenol 1993; 160: 971-7
- Caruthers SD, Jiuan Lin S, Brown P, et al. Practical value of cardiac magnetic resonance imaging for clinical quantification of aortic valve stenosis. Comparison with echocardiography. Circulation 2003; 108: 2236-43
- John AS, Dill T, Brandt RR, et al. Magnetic resonance to assess the aortic valve area in aortic stenosis. How does it compare to current diagnostic standards? J Am Coll Cardiol 2003; 42: 519-26
- Gatehouse PD, Rolf MP, Graves MJ, et al. Flow measurement by cardiovascular magnetic resonance: a multi-centre, multi-vendor study of background phase-offset errors that can compromise the accuracy of derived regurgitant or shunt flow measurements. J cardiovasc Magn Reson 2010; 12: 5
- Kilner PJ, Geva T, Kaemmerer H, et al. Recommendations for cardiovascular magnetic resonance in adults with congenital heart disease from the respective working groups of the European society of cardiology. Eur Heart J 2010; 31: 794-805
- Rickers C, Wilke NM, Jerosch-Herold M, et al. Utility of cardiovascular magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy. Circulation 2005; 112: 855-61
- Moon JC, Fisher NG, McKenna WJ, et al. Detection of apical hypertrophic cardiomyopathy by cardiovascular magnetic resonance in patients with non-diagnostic echocardiography. Heart 2004; 90: 645-9
- Petersen SE, Selvanayagam JB, Francis JM, et al. Differentiation of athlete’s heart from pathological forms of cardiac hypertrophy by means of geometric indices derived from cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2005; 7: 551-8
- Moon JC, McKenna WJ, McCrohon JA, et al. Toward risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol 2003; 41: 1561-7
- Adabag AS, Maron BJ, Appelbaum E, et al. Occurrence and frequency of arrhythmia in hypertrophic cardiomyopathy in relation to delayed enhancement on cardiovascular magnetic resonance. J Am Coll Cardiol 2008; 51: 1369-74
- Rubinshtein R, Glockner JF, Ommen SR, et al. Characteristics and clinical significance of late gadolinium enhancement by contrast-enhanced magnetic resonance imaging in patients with hypertrophic cardiomyopathy. Circ Heart Fail 2010; 3: 51-8
- Maron MS, Appelbaum E, Harrigan CJ, et al. Clinical profile and significance of delayed enhancement in hypertrophic cardiomyopathy. Circ Heart Fail 2008; 1: 184-91
- McCrohon J, Moon JC, Prasad S, et al. Differentiation of heart failure related to dilated cardiomyopathy and coronary artery disease using gadolinium-enhanced cardiovascular magnetic resonance. Circulation 2003; 108: 54-9
- Assomull R, Prasad S, Lyne J, et al. Cardiovascular magnetic resonance, fibrosis, and prognosis in dilated cardiomyopathy. J Am Coll Cardiol 2005; 48: 1977-85
- Hendel RC, Patel MR, Cramer CM, et al. ACCF/ACR/SCCT/SCMR/ASNC/ NASCI/SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging. A report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group. J Am Coll Cardiol 2006; 48: 1475-97
- Bilchick KC, Dimaano V, Wu KC, et al. Cardiac magnetic resonance assessment of dyssynchrony and myocardial scar predicts function class improvement following cardiac resynchronization therapy. JACC Cardiovasc Imaging 2008; 1: 561-8
- McKenna WJ, Thiene G, Nava A, et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Br Heart J 1994; 71: 215-8
- Marcus FI, McKenna WJ, Sherrill D, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia. Proposed modifications of the Task Force Criteria. Eur Heart J 2010; 31: 806-14
- Vogelsberg H, Mahrholdt H, Deluigi C, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008; 51: 1022-30
- Maceira A, Joshi J, Prasad SK, et al. Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation 2005; 111: 122-4
- Kirk P, Roughton M, Porter B, et al. Cardiac T2* magnetic resonance for prediction of cardiac complications in thalassemaia major. Circulation 2009; 120: 1961-8
- Modell B, Khan M, Darlison M, et al. Improved survival of thalassemia major in the UK and relation to T2* cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2008; 10: 42
- Cooper LT. Myocarditis. N Engl J Med 2009 ; 360: 1526-38
- Kuhl U, Pauschinger M, Seeberg B, et al. Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation 2005; 112: 1965-70
- Kuhl U, Pauschinger M, Noutsias M, et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with "idiopathic" left ventricular dysfunction. Circulation 2005; 111: 887-93
- Mahrholdt H, Goedecke C, Wagner A, et al. Cardiovascular magnetic resonance assessment of human myocarditis: a comparison to histology and molecular pathology. Circulation 2004; 109: 1250-8
- Mahrholdt H, wagner A, Deluigi CC, et al. Presentation, patterns of myocardial damage, and clinical course of myocarditis. Circulation 2006; 114: 1581-90
- Friedrich MG, Sechtem U, Schulz-Menger J, et al. Cardiovascular magnetic resonance in myocarditis: a JACC White Paper. J Am Coll Cardiol 2009; 53: 1475-87
- Smedema JP, Snoep G, van Kroonenburgh MP, et al. The additional value of gadolinium-enhanced MRI to standard assessment for cardiac involvement in patients with pulmonary sarcoidosis. Chest 2005; 128: 1629-37
- Patel MR, Cawley PJ, Heitner JF, et al. Detection of myocardial damage in patients with sarcoidosis. Circulation 2009; 120: 1969-77
- Syed IS, Martinez MW, Feng DL, et al. Cardiac magnetic resonance imaging of eosinophilic endomyocardial disease. Int J Cardiol 2008; 126: e50-2
- Talreja DR, Edwards WD, Danielson GK, et al. Constrictive pericarditis in 26 patients with histologically normal pericardial thickness. Circulation 2003; 108: 1852-7
- Bogaert J, Francone M. Cardiovascular magnetic resonance in pericardial diseases. J Cardiovasc Magn Reson 2009; 11: 14
- Francone M, Dymarkowski S, Kalantzi M, et al. Assessment of ventricular coupling with real-time cine MRI and its value to differentiate constrictive pericarditis from restrictive cardiomyopathy. Eur Radiol 2006; 16: 944-51
- Fieno DS, Saouaf R, Thomson LE, et al. Cardiovascular magnetic resonance of primary tumors of the heart : a review. J Cardiovasc Magn reson 2006; 8: 839-53
- Matsuoka H, Hamada M, Honda T, et al. Morphologic and histologic characterization of cardiac myxomas by magnetic resonance imaging. Angiology 1996; 47: 693-8
- De Arenaza DP, Pietrani m, Moon JC, et al. Cardiac fibroelastoma : cardiovascular magnetic resonance characteristics. J Cardiovasc Magn reson 2007; 9: 621
- Funari M, Fujita N, Peck WW, et al. Cardiac tumors : assessment with Gd-DTPA enhanced MR imaging. J Comput Assist Tomogr 1991; 15: 593-8
- Best AK, Dobson RL, Ahmad AR. Best cases from the AFIP. Cardiac hemangiosarcoma. Radiographics 2003; 23: S141-5
- Chiles C, Woodward PK, Gutierrez FR, et al. Metastatic involvement of the heart and pericardium : CT and MR imaging. Radiographics 2001; 21: 439-49
- Hoffmann U, Globits S, Schima V, et al. Usefulness of magnetic resonance imaging of cardiac and paracardiac masses. Am J Cardiol 2003; 92: 890-5
- Russo V, Renzulli M, Buttazzi K, et al. Acquired diseases of the thoracic aorta : role of MRI and MRA. Eur Radiol 2006; 16: 852-65
- Pohost GM, Kim RJ, Kramer CM, et al. Task force 12 : Training in advanced cardiovascular imaging (Cadiovascular Mangetic resonance [CMR]). Endorsed by the Society for Cardiovascular Magnetic Resonance. J Am Coll Cardiol 2006; 47: 910-4
- Cramer CM, Barkhausen J, Flamm SD, et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols, society for cardiovascular magnetic resonance: board of trustees task force on standardized protocols. J Cardiovasc Magn Reson 2008; 10: 35
- Hundley WG, Bluemke D, Bogaert JG, et al. Society for cardiovascular magnetic resonance guidelines for reporting cardiovascular magnetic resonance examinations. J Cardiovasc Magn Reson 2009; 11: 5
- Mousseaux E Les contre-indications à l'IRM STV 1999 ; 11(9) :694-698
- Rapport à l'AFSSAPS par la direction de l'évaluation des dispositifs médicauxPDD
- revue prescrire n°281 mars2007 Dispositifs transdermiques contenant de l'aluminium : risques de brûlures
Voir aussi
Bibliographie
- B. Kastler, D. Vetter, Z. Patay et P. Germain, Comprendre l'IRM Manuel d'auto-apprentissage, 6ème édition, 2006. (ISBN 2-294-05110-6) (édition antérieure : 5èmeédition, 2003 ISBN 2-294-01411-1)
Articles connexes
- Imagerie cérébrale
- Tomographie d'émission monophotonique (Single Photon Emission Computed Tomography)
- Imagerie moléculaire
Liens externes
- Med.univ-rennes1.fr Cours sur l'IRM de l'université de Rennes 1.
- (en) Effets sur la santé de champs statiques et de scanners IRM - résumé par GreenFacts d'un rapport de l'OMS de 2006.
- (en), (it) et (ru) The Basics of MRI Les bases de la technologie et de la physique en IRM.
- (en) MR-TIP.com Portail d'information sur la technologie IRM à l'attention particulière des professionnels.
- (en) MRIsafety.com Site sur les bonnes pratiques, l'enseignement et la recherche en IRM.
- IRMtpe.com Site de vulgarisation sur l'IRM et son fonctionnement à l'attention des lycéens.
- (en) Simple Basics of MRI Les bases de la technologie et de la physique en IRM.(Animations)
- Society for Cardiovascular Magnetic Resonance Site officiel de la société de résonance magnétique cardiovasculaire. Nombreuses ressources à disposition : sélection d’articles scientifiques, présentations d’experts, recommandations pour les protocoles d’imagerie. Informations concernant cours de formation et congrès.
- EuroCMR Site du groupe de travail d’IRM cardiaque de la société européenne de cardiologie (ESC). Information sur les projets de recherche européens et sur le registre européen d’IRM cardiaque. Protocoles spécifiques d’imagerie. Présentations et webcasts. Informations sur le congrès européen d’IRM cardiaque
Wikimedia Foundation. 2010.