- RMN du fluor 19
-
Fluor 19 19F Général Nombre de neutrons 10 Nombre de protons 9 Spin
à l'état fondamental1/2 Abondance naturelle
[%]100 Données RMN Rapport gyromagnétique
[107 Rad/T/s]25,18148[1] Fréquence relative
[MHZ/ 1H 100 MHz]
100 MHz]40,0776[2] Sensibilité relative
[/ 1H 100]
100]0.834[2] Référence(s) CCl3F modifier 
La RMN du fluor 19 (parfois simplement appelée RMN du fluor) est l'application de la résonance magnétique nucléaire (RMN) au fluor. Le 19F possède un spin de ½ et son abondance relative naturelle est de 100 %, ce qui fait de cette technique une méthode de choix pour l'analyse et la résolution de structure des composés fluorés.
Sommaire
Propriétés du fluor 19
Hormis le proton et le carbone 13, le fluor 19 est l'un des noyaux les plus étudiés. L'avantage principal vient du fait que son abondance relative naturelle est de 100 % et de son très fort rapport gyromagnétique. Les différentes résonances du noyau de fluor sont généralement bien séparées, la plage de déplacement chimique étant vingt fois plus étendue que celle du proton.
Le 19F possède un spin de ½, et ainsi les temps de relaxation sont suffisamment longs pour que les couplages spin-spin puissent être résolus[3].
Déplacements chimiques
Selon son environnement chimique, les résonances des composés organiques et inorganiques peuvent couvrir une plage d'environ 700 ppm, allant de -300 à +400 ppm[4],[5].
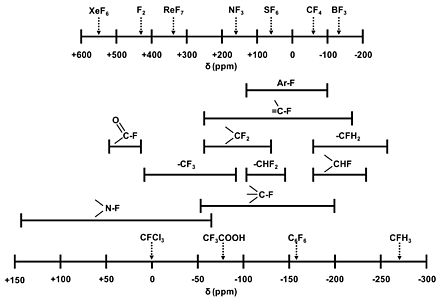 Déplacement chimique de différents composés fluorés
Déplacement chimique de différents composés fluorés
Références pour la mesure des déplacements chimiques
Par un consensus général, les déplacements chimiques sont notés comme positifs en direction des hautes fréquences de résonance (ou bas champs magnétiques) et négatifs en direction des basses fréquences de résonance (ou haut champs magnétiques).
La référence choisie pour mesurer les déplacements chimiques δ est le CCl3F, pour lequel δ=0[4],[5]. Cette molécule présente quatre pics, correspondant à la présence, des basses fréquences aux hautes fréquences, de trois, deux, un ou aucun noyaux 37Cl[3]. Ainsi des déplacements chimiques différents peuvent être mesurés si un des pics est choisit plutôt que le centre de gravité des quatre pics.
D'autres composés fluorés peuvent être choisit comme référence du fait de la volatilité du CCl3F, son point d'ébullition étant de 23,7 °C à 101,325 kPa[2]. Ainsi, le CFCl2CF2Cl ou le CF3CO2H sont communément employés comme références internes.
Déplacements chimiques de composés de référence fluorés[3] Composé Déplacement chimique
(en ppm)CCl3F 0 CFCl2CF2Cl -68,05 et -72,2 CF3CO2H -76,6 C4F8 -135,2 modifier] Notes et références - (en) NMR Properties of fluorine sur http://www.webelements.com/, WebElements. Consulté le 5 mars 2011
- (en) David R. Lide (dir.), CRC handbook of chemistry and physics, Boca Raton, FL, CRC Press/Taylor and Francis, 2010, 90e éd.
- (en) W. S. Brey, M. L. Brey, D. M. Grant (dir.) et R. K. Harris (dir.), Encyclopedia of nuclear magnetic resonance, John Wiley, 2002, 6490 p. (ISBN 9780470847848) [présentation en ligne], « Fluorine-19 NMR »
- (en) Roy Hoffman, « Fluorine NMR » sur http://chem.ch.huji.ac.il, The Hebrew University, 29. Consulté le 5 mars 2011
- (en) Peer Kirsch, Modern fluoroorganic chemistry : Synthesis, reactivity, applications, Wiley-VCH, 2004, 308 p. (ISBN 9783527306916) [présentation en ligne], p. 21-22
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Wikipédia:Fluorine-19 NMR » (voir la liste des auteurs)
Annexes
Bibliographie
- (en) T. S. Everett, M. Hudlicky (dir.) et A. E. Pavlath (dir.), Chemistry of organic fluorine compounds II : A critical review, American Chemical Society, 1995, 1296 p. (ISBN 9780841225152) [présentation en ligne], chap. 7 (« Analysis of organic fluorine compounds: Nuclear magnetic resonance spectroscopy of organofluorine compounds »), p. 1037-1088
- (en) W. S. Brey, M. L. Brey, D. M. Grant (dir.) et R. K. Harris (dir.), Encyclopedia of nuclear magnetic resonance, John Wiley, 2002, 6490 p. (ISBN 9780470847848) [présentation en ligne], « Fluorine-19 NMR »
Articles connexes
