- E-952
-
Cyclamate
Cyclamate de sodium 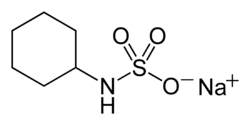
Général Nom IUPAC sodium N-cyclohexylsulfamate Synonymes * Cyclamate, sel de sodium de l'acide cyclamique
* Sodium sucaryl
* Cyclohexanesulfamate de sodium
* Cyclohexylsulfamate de sodiumNo CAS No EINECS PubChem No E E952(iv) Apparence Poudre incolore inodore Propriétés chimiques Formule brute C6H12NNaO3S [Isomères] Masse molaire 201,219 g∙mol-1
C 35,81 %, H 6,01 %, N 6,96 %, Na 11,43 %, O 23,85 %, S 15,94 %,
237,22 g⋅mol-1 (hydraté)Propriétés physiques T° fusion 265 °C Solubilité Soluble dans l'eau, pratiquement insoluble dans l'éthanol[1] Précautions Directive 67/548/EEC 
XnPhrases R : 22, Écotoxicologie DL50 1,28 g⋅kg-1 (rats, oral) [2]
3,5 g⋅kg-1 (rats, i.v.)[2]
17 g⋅kg-1 (souris, oral)[2]
4,8 g⋅kg-1 (souris, i.v.)[2]Composés apparentés Autres composés Acide cyclamique, Cyclamate de calcium Unités du SI & CNTP, sauf indication contraire. Le cyclamate (ou cyclamate de sodium) est un édulcorant artificiel découvert en 1937 à l'Université de l'Illinois par un étudiant nommé Michael Sveda. Le cyclamate est également connu sous le numéro E (code des additifs) E952[1].
Sommaire
Histoire
Comme pour la plupart des édulcorants artificiels, le pouvoir sucrant du cyclamate de sodium fut découvert par hasard. Michael Sveda travaillait dans son laboratoire sur la synthèse d'un médicament antipyrétique. Il déposa sa cigarette sur le bord de sa table de laboratoire, et, quand il la remit à la bouche, il constata la saveur sucrée du cyclamate de sodium.
Le brevet du cyclamate de sodium fut racheté par DuPont mais cédé plus tard à Abbott Laboratories qui entreprit les études nécessaires et soumit la substance en tant que nouvelle application pour médicaments en 1950. Abbott pensait utiliser le cyclamate de sodium pour masquer l'amertume de certains médicaments comme des antibiotiques ou pentobarbital.
Structure et propriétés
Le cyclamate de sodium est le sel de sodium de l'acide cyclamique (acide cyclohexanesulfamique)[1]. Il est préparé par sulfonation de la cyclohexylamine ; ceci peut être fait en faisant réagir la cyclohexylamine avec de l'acide sulfamique ou du trioxyde de soufre.
Propriétés chimiques
Propriétés physiques
Le cyclamate de sodium est un composé solide incolore et inodore soluble dans l'eau et pratiquement insoluble dans l'éthanol[1].
Utilisation
Le cyclamate de sodium est 30 à 40 fois plus sucrant que le sucre[1] (selon sa concentration ; ce n'est pas une relation linéaire), faisant de lui le moins sucrant de tous les édulcorants artificiels.
Quelques personnes lui trouvent un arrière-goût désagréable, mais généralement moins que celui de la saccharine et ses sels ou que l'acésulfame potassium.
Il est habituellement utilisé en synergie avec d'autres édulcorants, spécialement avec la saccharine ; le mélange de 10 parts de cyclamate pour 1 part de saccharine est courante et masque les arrière-goûts des deux substances.
Il est moins cher que la plupart des édulcorants, y compris le saccharose, et il est stable à la chaleur. Le cyclamate est commercialisé sous forme de comprimés ou sous forme liquide.
Réglementation
En Europe, son utilisation est limitée aux boissons non alcoolisées (0,25 g⋅L-1 maximum), aux desserts et produits similaires (0,25 g⋅kg-1 maximum) et aux confiseries (de 0,25 à 1,6 g⋅kg-1)[3]. Pour l'acide cyclamique (E952(i)) et ses sels de sodium (cyclamate de sodium E952(iv)) et de calcium (cyclamate de calcium E952(ii)), les doses maximales d'emploi sont exprimées en acide libre.
Le codex alimentarius classe le cyclamate comme édulcorant[4] et son utilisation est élargie à un plus grand nombre de produits alimentaires dont les sucres de table[5].
Le cyclamate est approuvé comme édulcorant dans plus de 55 pays dont le Canada.
Cyclamate et santé
En 1958 il a été désigné comme « généralement reconnu comme inoffensif » ((en) GRAS).
Cependant, en 1966, une étude rapporte que certaines bactéries pourraient désulfoner le cyclamate pour produire de la cyclohexylamine, un composé suspecté d'avoir une toxicité chronique chez l'animal. D'autres recherches ont eu pour résultats, en 1969, que le mélange usuel 10:1 cyclamate:saccharine augmentait la probabilité du cancer de la vessie chez le rat. D'autres études impliquèrent la cyclohexylamine dans l'atrophie des testicules chez la souris. En 1970, la Food and Drug Administration (FDA) interdit sa vente aux États-Unis.
Ces études ont poussé le Japon, au début des années 70, à cultiver et commercialiser massivement un édulcorant naturel, tiré du Stevia rebaudiana, plante contenant naturellement un fort pouvoir édulcorant.
Abbott Laboratories soutint que ses propres études n'avaient jamais été capables de reproduire les résultats de l'étude de 1969 et, en 1973, Abbott demanda à la FDA de retirer l'interdiction de vente du cyclamate. Cette pétition a été, par la suite, refusée en 1980 par un commissaire de la FDA (Jere Goyan). Le laboratoire d'Abbott, avec le Calorie Control Council (un lobby politique représentant l'industrie des aliments de régime), déposèrent une seconde pétition en 1982.
En 1982, le comité international mixte FAO/OMS d'experts sur les additifs alimentaires (JECFA) a établi une dose journalière admissible (DJA) de 11 mg⋅kg-1⋅de m.c. pour l'acide cyclamique et ses sels de sodium et de calcium, dose exprimée en acide libre[6].
Bien que la FDA ait décidé, à la relecture de toutes les preuves, que le cyclamate n'était pas impliqué comme cancérogène chez la souris ou chez le rat, il reste interdit dans les aliments aux États-Unis. La pétition est toujours en suspens (elle n'est pas considérée activement), sans savoir si c'est à la demande des laboratoires d'Abott eux-mêmes ou si c'est parce que la FDA la considère comme insuffisante et peu claire.
En 2000, le comité scientifique de l'alimentation humaine de l'Union européenne a établi une DJA de 7 mg⋅kg-1⋅ de m.c., valeur inférieure à celle du JECFA. Cette nouvelle valeur, exprimée en acide cyclamique, est basée sur la dose sans effet (NOAEL) de 100 mg⋅kg-1⋅ de m.c. de la cyclohexylamine, suivie d'une conversion de 85 % et la division par un facteur de sécurité de 32[7].
Notes et références
- ↑ a , b , c , d et e Parlement européen et Conseil de l'Europe, « Directive 2008/60/CE établissant des critères de pureté spécifiques pour les édulcorants pouvant être utilisés dans les denrées alimentaires. », dans Journal officiel de l’Union européenne, no L 158, 18/06/2008, p. 17-40 [résumé, texte intégral (pages consultées le 17/10/2008)]
- ↑ a , b , c et d (en) ChemIDplus, « Sodium cyclamate - RN: 139-05-9 » sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine. Consulté le 23/07/2008.
- ↑ Parlement européen et Conseil de l'europe, « Directive 94/35/CE concernant les édulcorants destinés à être employés dans les denrées alimentaires. », dans Journal Officiel, no L 237, 10.9.1994, p. 1-19 [résumé, texte intégral (pages consultées le 23/05/2008)] [pdf] Texte à jour
- ↑ (en) Codex Alimentarius Commission, « Updated up to the 31st Session of the Codex Alimentarius Commission for Sodium cyclamate (952(iv)) » sur http://www.codexalimentarius.net, 2008, GSFA Online, Codex Alimentarius. Consulté le 16/10/2008.
- ↑ (en) Codex Alimentarius Commission, « Updated up to the 31st Session of the Codex Alimentarius Commission for Cyclamates » sur http://www.codexalimentarius.net, 2008, GSFA Online, Codex Alimentarius. Consulté le 16/10/2008.
- ↑ (en) JECFA, « Monograph Sodium cyclamate - INS N° 952(iv) » sur http://www.fao.org, 2006, Food additive Monograph, FAO, p. 1-2. Consulté le 21/11/2008 [pdf]
- ↑ (en) Scientific Committee for Food, « Revised opinion on cyclamique acid and its sodium and calcium salts - SCF/CS/EDUL/192 final » sur ec.europa.eu, 09/03/2000, Reports of the Scientific Committee for Food, Commission européenne, p. 1-7. Consulté le 21/11/2008 [pdf]
Voir aussi
Articles connexes
Liens externes
- (en) site fournisseur de cyclamate
- (en) Low calorie sweetener - cyclamate
- (en) US FDA Petitions Currently Held in Abeyance
- Portail de la chimie
- Portail de l’alimentation et de la gastronomie
- Portail de la pharmacie
Catégories : Composé du sodium | Produit chimique nocif | Édulcorant | Sulfamidé
Wikimedia Foundation. 2010.
