- Acide fluoroantimonique
-
Acide fluoroantimonique 
Général Nom IUPAC acide fluoroantimonique Synonymes acide hexafluoroantimonique. No CAS No EINECS PubChem SMILES InChI Apparence liquide visqueux incolore Propriétés chimiques Formule brute HSbF6 Masse molaire[1] 236,758 ± 0,001 g·mol-1
H 0,43 %, F 48,15 %, Sb 51,43 %,pKa -25 Propriétés physiques T° ébullition décomposition Solubilité décomposition Précautions Directive 67/548/EEC[2] 
Xn
NPhrases R : 20/22, 51/53, Phrases S : 61, Transport[2] - 2922 SGH[2] 

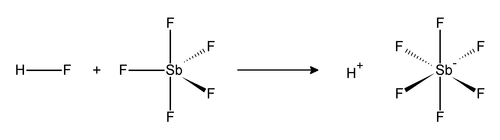
AttentionUnités du SI & CNTP, sauf indication contraire. L’acide fluoroantimonique est un mélange en proportions variables de fluorure d'hydrogène et de pentafluorure d'antimoine[3]. La combinaison 1:1 de ce mélange, de formule chimique HSbF6, correspond au superacide le plus fort qu'on connaisse, capable de protoner même des hydrocarbures en carbocations[4].
La réaction du fluorure d'hydrogène HF et du pentafluorure d'antimoine SbF5 est exothermique. HF libère l'ion H+ et sa base conjuguée F- est séquestrée par un ou plusieurs SbF5 pour conduire à l'ion octaédrique [SbF6]-. Cet anion est non coordinant dans la mesure où il est à la fois très faiblement nucléophile et très faiblement basique.
Le proton de l'ion H+ du système HF + SbF5 à 1:1 est presque totalement libre, ce qui explique son acidité extrême : l'acide fluoroantimonique HSbF6 est 2×1019 fois plus fort que l'acide sulfurique H2SO4 à 100 %.
Cet acide est si fort qu'il peut protoner pratiquement n'importe quel composé organique. Bickel et Hogeveen ont montré en 1967 qu'un mélange équimolaire HF + SbF5 libère H2 à partir d'isobutane HC(CH3)3 et CH4 à partir de néopentane C(CH3)4[5],[6] :
Deux composés obtenus à partir de mélanges HF + SbF5 ont été cristallisés et analysés par diffractométrie de rayons X. Il s'agit des sels [H2F+][Sb2F11−] et [H3F2+][Sb2F11−], dont l'anion est [Sb2F11−][7], la structure duquel a ainsi pu être déterminée.
L'acide fluoroantimonique est décomposé de façon explosive par l'eau et réagit avec pratiquement tous les solvants[4], hormis le fluorure de chlorosulfonyle SO2ClF et le dioxyde de soufre SO2, ainsi que les chlorofluorocarbones.
Il doit être stocké dans des récipients en polytétrafluoroéthylène (PTFE).
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- SIGMA-ALDRICH
- (en) e-EROS Encyclopedia of Reagents for Organic Synthesis – 2004 « Hydrogen Fluoride–Antimony(V) Fluoride. »
- (en) George Andrew Olah, « A life of magic chemistry: autobiographical reflections of a nobel prize winner », John Wiley and Sons, 2001, pp. 100–101. ISBN 978-0-471-15743-4.
- (en) H. Hogeveen et A. F. Bickel, « Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons », dans Chemical Communications (London), no 13, 1967, p. 635-636 [texte intégral (page consultée le 15 novembre 2010)]
DOI:10.1039/C19670000635 - (en) A. F. Bickel, C. J. Gaasbeek, H. Hogeveen, J. M. Oelderik et J. C. Platteeuw, « Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen », dans Chemical Communications (London), no 13, 1967, p. 634-635 [texte intégral (page consultée le 15 novembre 2010)]
DOI:10.1039/C19670000634 - (en) Dietrich Mootz, Klemens Bartmann, « The Fluoronium Ions H2F⊕ and H3F⊕2: Characterization by Crystal Structure Analysis », dans Angewandte Chemie – International Edition in English, vol. 27, no 3, mars 1998, p. 391-392 [texte intégral (page consultée le 15 novembre 2010)]
DOI:10.1002/anie.198803911
Articles connexes
- Acide fluoroborique
- Acide fluorosulfurique
- Acide magique
Catégories :- Composé de l'antimoine
- Produit chimique nocif
- Produit chimique dangereux pour l'environnement
- Superacide
- Composé du fluor
Wikimedia Foundation. 2010.