- Pentafluorure d'antimoine
-
Pentafluorure d'antimoine 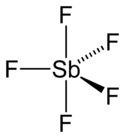
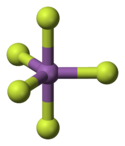
Structure du pentafluorure d'antimoine.Général Nom IUPAC pentafluoro-λ5-stibane Synonymes fluorure d'antimoine(V), pentafluoroantimoine No CAS No EINECS No RTECS PubChem SMILES InChI Apparence liquide visqueux hygroscopique incolore. Propriétés chimiques Formule brute SbF5 Masse molaire[1] 216,752 ± 0,001 g·mol-1
F 43,83 %, Sb 56,17 %,Propriétés physiques T° fusion 8,3 °C T° ébullition 149,5 °C Masse volumique 2,99 g·cm-3 Précautions Directive 67/548/EEC[2] 
C
NPhrases R : 14, 20/22, 34, 51/53, Phrases S : 22, 26, 36/37/39, 45, 61, Transport[2] 86 1732 NFPA 704 SGH[3] 

AttentionUnités du SI & CNTP, sauf indication contraire. Le pentafluorure d'antimoine est un composé chimique de formule SbF5. Il s'agit d'un acide de Lewis puissant qui se présente sous forme d'un liquide incolore visqueux et entre dans la composition de plusieurs superacides tels que l'acide magique HSFO3·SbF5 et l'acide fluoroantimonique HSbF6, le plus fort des acides connus, par réaction respectivement avec l'acide fluorosulfurique HSO3F et le fluorure d'hydrogène HF :
- SbF5 + HSO3F → HSFO3·SbF5
- SbF5 + HF → HSbF6.
Très corrosif, toxique et sensible à l'humidité, il réagit avec à peu près toutes les espèces chimiques connues[4]. C'est un catalyseur employé dans les processus se déroulant en milieu acide, notamment avec la réaction de Friedel-Crafts et les isomérisations.
Sommaire
Production
On le prépare en faisant réagir du fluorure d'hydrogène anhydre HF sur du pentachlorure d'antimoine SbCl5 :
- HF → SbF5 + 5 HCl.
On peut également le préparer à partir de trifluorure d'antimoine SbF3, ou en traitant le pentoxyde d'antimoine Sb2O5 avec de l'acide fluorhydrique HF aqueux et évaporation subséquente de l'eau.
Structure et propriétés chimiques
Le pentafluorure d'antimoine adopte une structure trigonale bipyramidale de groupe de symétrie D3h à l'état gazeux, mais plus complexe à l'état condensé (liquide et solide) : en phase liquide, il polymérise sous forme de [SbF4(μ-F)2]n dans lequel chaque atome d'antimoine est octaédrique, tandis qu'il cristallise sous forme de tétramères [SbF4(μ-F)]4. Les liaisons Sb-F ont une longueur de 202 pm dans l'anneau de huit unités Sb4F4, les ligands fluorure étant liés aux quatre centres Sb par des liaisons de 182 pm[5]. Les composés apparentés que sont PF5 et monomériques à l'état condensé, probablement en raison de la taille plus réduite de l'ion central, ce qui limite sa coordinence. acide de Lewis fort, notamment envers les sources d'ions fluorure F- qui conduisent à la formations d'ions [SbF6]- très stables, lesquels réagissent avec un excédent de SbF5 pour donner des ions [Sb2F11]-. De la même façon que SbF5 accroît l'acidité de Brønsted de HF, il augmente le pouvoir oxydant de F2 ; cet effet est illustré par l'oxydation de l'oxygène en dioxygényle[7] :
Le pentafluorure d'antimoine a été le premier réactif connu permettant de produire du difluor F2 à partir de fluorures, en raison de la très grande affinité de SbF5 pour l'ion fluorure F- :
- 4 SbF5 + 2 K2MnF6 → 4 KSbF6 + 2 MnF3 + F2.
Sécurité
Le pentafluorure d'antimoine réagit violemment avec de très nombreux composés, le plus souvent en libérant du fluorure d'hydrogène HF, un gaz très dangereux. Il est corrosif pour la plupart des matériaux. Ses projections attaquent la peau et les yeux. Son ingestion accidentelle est à l'origine de diarrhées, de nausées et de vomissements[8],[9],[10].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Antimony(V) fluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mars 2011 (JavaScript nécessaire)
- SIGMA-ALDRICH
- (en) e-EROS Encyclopedia of Reagents for Organic Synthesis « Antimony(V) Fluoride. »
- (en) A. J. Edwards et P. Taylor, « Crystal structure of antimony pentafluoride », dans Journal of the Chemical Society D: Chemical Communications, no 21, 1971, p. 1376-1377 [texte intégral (page consultée le 15 novembre 2010)]
DOI:10.1039/C29710001376 - (en) A. F. Holleman, E. Wiberg, « Inorganic Chemistry », Academic Press, San Diego, 2001. ISBN 0-12-352651-5.
- (en) J. Shamir, J. Binenboym, « Dioxygenyl Salts », Inorganic Syntheses, 1973, XIV, 109-122. ISSN 0073-8077.
- (fr) Commission européenne – 1993 Fiche de sécurité du SbF5.
Traduction autorisée de l'International Chemical Safety Card (ICSC), publié par l'UNEP/ILO/WHO dans le cadre de la coopération entre le PISSC et la CE – Programme International sur la Sécurité des Substances Chimiques - Commission Européenne, 1993 - (en) Commission of the European Communities (CEC) – 2005 « Antimony pentafluoride. »
- (en) Environmental Chemistry – 2006 « Chemical Database - Antimony Pentafluoride. »
Voir aussi
Articles connexes
Catégories :- Composé de l'antimoine
- Produit chimique corrosif
- Produit chimique dangereux pour l'environnement
- Produit chimique qui réagit avec l'eau
- Fluorure
Wikimedia Foundation. 2010.



