Acide Fluorosulfurique
- Acide Fluorosulfurique
-
Acide fluorosulfurique
| Acide fluorosulfurique |
|
  |
| Général |
| Nom IUPAC |
Acide fluorosulfurique |
| No CAS |
7789-21-1 |
| No EINECS |
232-149-4 |
| Apparence |
liquide incolore |
| Propriétés chimiques |
| Formule brute |
HFO3SHSO3F |
| Masse molaire |
100,07 g∙mol-1
H 1,01 %, F 18,99 %, O 47,96 %, S 32,04 %,
|
| pKa |
-10 |
| Propriétés physiques |
| T° fusion |
-87,3 °C |
| T° ébullition |
165,5 °C |
| Solubilité |
Soluble dans l'eau |
| Masse volumique |
1,84 , liquide |
| Précautions |
|
Directive 67/548/EEC
|

C
|
|
Numéro index :
016-018-00-7
Symboles :
C : Corrosif
Phrases R :
R20 : Nocif par inhalation.
R35 : Provoque de graves brûlures.
Phrases S :
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste.
S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible, lui montrer l’étiquette).
(S1/2) : Conserver sous clef et hors de portée des enfants.
|
| Phrases R : 20, 35, |
| Phrases S : (1/2), 26, 45, |
|
SIMDUT[1]
|
  E, F,
E, F,
E : Matière corrosive
Transport des marchandises dangereuses : classe 8
F : Matière dangereusement réactive
réagit violemment au contact de l'eau en dégageant un gaz très toxique : chlorure d'hydrogène
Divulgation à 1,0% selon la liste de divulgation des ingrédients
|
|
SGH[2]
|

Danger
H314, H332,
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H332 : Nocif par inhalation
|
|
Unités du SI & CNTP, sauf indication contraire.
|
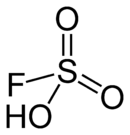
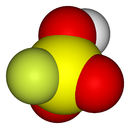
L'acide fluorosulfurique est une molécule de formule HSO3F. C'est un des acides les plus forts que l'on connaisse.
Description
L'acide fluorosulfurique peut être vu comme une molécule d'acide sulfurique où un groupe -OH aurait été substitué par un atome de fluor. L'électronégativité du fluor supérieure à celle de l'oxygène entraîne une augmentation de l'acidité du produit obtenu.
Préparation
Il suffit d'ajouter du fluorure d'hydrogène (HF) à du trioxyde de soufre appelé aussi anhydride sulfurique (SO3)
Utilisation
On s'en sert quand on a besoin d'acidité très élevée, pour stabiliser les carbocations par exemple.
Notes et références de l'article
Voir aussi
Articles connexes
Liens et documents externes
 Portail de la chimie
Portail de la chimie
Catégories : Composé du fluor | Produit chimique corrosif | Composé du soufre | Superacide
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Acide Fluorosulfurique de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Acide fluorosulfurique — Structure de l acide fluorosulfurique … Wikipédia en Français
Acide magique — Composants de « l acide magique. » … Wikipédia en Français
Acide Fort — Un acide fort est un acide qui se dissocie totalement dans l eau. Sommaire 1 Définition 2 Utilisations des acides forts 3 Exemples d acides forts 4 Sécurité … Wikipédia en Français
Acide Trifluorométhanesulfonique — Acide trifluorométhanesulfonique … Wikipédia en Français
Acide triflique — Acide trifluorométhanesulfonique Acide trifluorométhanesulfonique … Wikipédia en Français
Acide trifluoromethanesulfonique — Acide trifluorométhanesulfonique Acide trifluorométhanesulfonique … Wikipédia en Français
Acide trifluorométhanesulfonique — Acide trifluorométhanesulfonique … Wikipédia en Français
Acide fluoroantimonique — Général Nom IUPAC acide fluoroantimonique Synonymes … Wikipédia en Français
Acide fort — Un acide fort est un acide qui, en solution aqueuse, se dissocie totalement en un proton H+ et une base très faible dite base conjuguée de l acide. Sommaire 1 Définition 2 Utilisations des acides forts 3 … Wikipédia en Français
Puissance acide — En chimie, la puissance acide réfère à la mesure de la causticité d’une substance. Elle est notée en utilisant sa valeur Ho. Les substances avec une valeur Ho inférieure à 12 sont considérées comme des superacides. Exemples de superacides :… … Wikipédia en Français






