- Chlorofluorocarbone
-
Chlorofluorocarbure
Les chlorofluorocarbures ou CFC sont une sous-classe de gaz fluorés, eux-mêmes faisant partie de la famille des halogénoalcanes. Ce sont des gaz composés dérivés des alcanes, ou tous les atomes d'hydrogène ont été substitués par des atomes de chlore et de fluor.
Sommaire
Caractéristiques
Contrairement à d'autres halogénoalcanes, comme par exemple les hydrochlorofluorocarbures (HCFC), les CFC ne contiennent plus d'atome d'hydrogène; on dit de ces molécules qu'elles sont complètement halogénées. Seuls subsistent les atomes de carbones centraux de la molécule d'alcane, entourés par des atomes de chlore et de fluor.
Les différence entre les diverses molécules de CFC sont le nombre d'atomes de carbone, de chlore et de fluor, et la disposition des atomes dans l'espace (isomères). Pour nommer les différents CFC, on utilise une règle simple régie par la norme 34-1992 d'ANSI/ASHRAE et approuvée par l'Union internationale de chimie pure et appliquée (IUPAC) concernant les halogénoalcanes, appliquée dans le cas particulier des CFC .
Les CFC se notent : CFC-ABCDE
- A : Nombre de doubles liaisons (omis si égal à zéro)
- B : Nombre d'atomes de carbone -1 (omis si égal à zéro)
- C : Nombre d'atomes d’hydrogène +1 = 1 dans le cas des CFC (nombre d'atome d'hydrogène = 0)
- D : Nombre d'atomes de fluor
- E : Lettre pour identifier les isomères, on commence par "a", puis "b", etc.
Exemple : Le trichlorofluorométhane CCl3F
- A : 0 (pas de double liaison)
- B : 1-1= 0 (dérivé du méthane)
- C : 0+1= 1 (CFC)
- D : 1
- E : pas d'isomère
Le trichlorofluorométhane est donc le CFC-11.
Parfois on peut trouver la lettre R à la place de CFC pour indiquer que la molécule est utilisée comme réfrigérant. Ainsi R-12 et CFC-12 représentent exactement la même molécule, en l'occurrence le dichlorodifluorométhane.
Propriétés
Les CFC ont de très intéressantes propriétés physico-chimiques, ce qui leur a valu un grand intérêt de la part des industries et explique leur utilisation massive, jusqu'à la découverte de leur rôle dans la destruction de la couche d'ozone.
Les chlorofluorocarbones sont en effet:
- ininflammables, les CFC ne peuvent pas prendre feu contrairement à leur précurseurs ;
- très peu coûteux à fabriquer : le prix était de quelques dollars le baril, mais a fortement augmenté après leur interdiction ;
- extrêmement stables et inertes, presque autant que des gaz nobles, grâce à la nature de leurs liaisons entre les différents atomes les composant, qui font intervenir les nuages électroniques de ces derniers ; ce sont des liaisons covalentes fortes.
Synthèse des CFC
Les chlorofluorocarbures sont synthétisés à partir d'alcanes, par substitution des atomes d'hydrogène par des atomes de chlore et de fluor.
- Exemple de synthèse de CFC: le fréon 12 ou dichlorodifluorométhane
CH4+ 4Cl2 → CCl4 + 4HCl
CCl4 + 2HF → CCl2F2 + 2HCl
Dans ce cas, c'est le méthane qui est substitué par deux atomes de fluor et deux de chlore.
Applications industrielles des CFC
Les CFC doivent leurs intérêts principaux à leurs propriétés : inerte, stable, ininflammable et non toxique, ainsi que dans leurs prix de fabrication. En effet ces derniers ne coûtent quasiment rien à la production, c’est pour cela notamment que les gaz nobles, très coûteux, ne sont pas utilisés à leur place.
Avant que les CFC ne soient découverts et produits de façon industrielle, d'autres gaz servaient à leur place comme : l'ammoniac anhydre (NH3), le tétrachlorométhane (CCl4), le chlorométhane (CH3Cl), le dioxyde de soufre (SO2) et le méthane (CH4) qui étaient toxiques et/ou inflammables et/ou explosifs, provoquant ainsi de nombreux accidents domestiques : des gens mouraient asphyxiés ou brûlés vifs durant leur sommeil à cause d’une fuite de leur réfrigérateur ou lors de l’utilisation d’une bombe aérosol, le méthane propulsant le liquide pouvant former un mélange détonant avec l’air dans une pièce close.
Dans les années 80, les CFC étaient utilisés dans plusieurs secteurs industriels :
- l'industrie du froid ;
- l'industrie des nettoyants industriels ;
- l'industrie des propulseurs ;
- l'industrie des mousses isolantes.
Un autre intérêt des CFC réside dans le fait qu'ils ont tous un point d'ébullition différent et peuvent donc convenir à des applications variées.
Industrie du froid
Les CFC servent en majorité dans l’industrie du froid, dans les climatiseurs, qu'ils soient intérieurs ou dans une voiture et dans les réfrigérateurs, congélateurs, industriels ou domestiques.
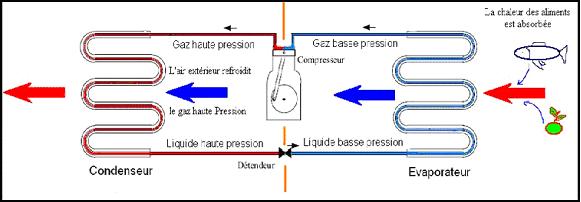
Que l'installation soit un réfrigérateur ou un climatiseur, le principe est le même : Pour fabriquer du froid, on joue sur le changement d’état liquide-gaz : la vaporisation. En effet, pour refroidir un gaz il suffit d’augmenter la pression de ce dernier, d’où le rôle d’un compresseur qui liquéfie le gaz en augmentant sa pression. Ensuite lorsque le liquide ainsi produit va se retrouver en contact avec la chaleur du milieu, il va l’absorber pour redevenir gazeux : c’est un échange thermique entre le milieu et le réfrigérant. C'est le même principe que l’on observe lorsque l’on fait bouillir de l’eau : on augmente la température de l’eau (liquide) et il se forme de la vapeur d’eau (gaz).
Le choix du réfrigérant s’est porté sur les CFC pour leur :
- stabilité, ainsi l’installation dure « indéfiniment » puisque le réfrigérant ne se dégrade pas et ne dégrade pas l’installation (non corrosif) ;
- facilité de liquéfaction (température d’ébullition modérée) ;
- chaleur de changement d’état favorable (il absorbe beaucoup de calories par unité de masse) ;
- ininflammabilité ;
- non toxicité.
Pour l'industrie du froid les CFC utilisés sont notamment le Fréon 11 et le Fréon 12.
Schéma de fonctionnement d’un réfrigérateur :
Industrie des nettoyants industriels
Pour cette industrie, on a besoin d'un puissant solvant :
- inodore, important pour le nettoyage de grandes surfaces commerciales, où une odeur désagréable pourrait faire fuir les clients ;
- non nocif pour la santé, également très important, pour les techniciens de surfaces ;
- ininflammable, cela pourrait avoir des conséquences gravissimes si une femme de ménage venait à fumer pendant qu’elle manipule un solvant inflammable.
Les CFC ayant une grande capacité à dissoudre les graisses, ils sont parfaits pour ce type d’industrie.
Industrie des propulseurs
Dans cette industrie, on a besoin d’une substance inodore, incolore, stable, inerte, ininflammable et avec une vitesse d’évaporation élevée ; il faut que le gaz se libère rapidement. De plus, il ne faut pas qu’il réagisse avec la substance propulsée, d’où la nécessité d’un produit inerte.
Le fonctionnement des bombes aérosols est le même que celui des extincteurs : le principe consiste à mettre un gaz propulseur et le produit (par exemple de la laque) en contact (d’où la nécessité qu’il soit inerte) dans une même bouteille où la pression est très forte afin de les stocker sous forme liquide (cela permet d’augmenter la quantité de matière stockée). Dès lors que l’on diminuera la pression en appuyant sur le bouton, le gaz propulseur se vaporisera, passant de l’état liquide à l’état gazeux (la seule chose qui le maintient liquide est la forte pression) et entraînant, avec lui, le produit (ici la laque).
Industrie des mousses
L'industrie des mousses a besoin d’un gaz pour souffler des mousses.
Il faut donc un gaz :
- incolore pour ne pas détériorer la couleur recherchée pour la mousse ;
- ininflammable afin que la mousse ne le soit pas elle-même.
L'utilisation d’air comprimé comme agent de soufflage aurait pu paraître plus simple, mais cette alternative doit être utilisée à très forte pression difficile à obtenir et explose à la moindre étincelle, ce qui avantage encore une fois les CFC.
Développement durable
Les CFC sont responsables pour une bonne part de la destruction de la couche d'ozone. Ils sont 20 000 fois plus destructeurs que de simples molécules de dioxyde de carbone. Ils modifient les molécules d'ozone de l'atmosphère (O3) en enlevant un atome d'oxygène. Comme ils se dégradent progressivement mais très lentement dans l'atmosphère, leur effet destructeur se poursuit pendant plusieurs siècles après leur émission. C'est pourquoi certains États, dont le Québec, les ont déjà interdits.
Liste des 5 CFC les plus utilisés
Formule chimique brute de la molécule de CFC
Nom de la molécule Appellation ANSI/ASHRAE
Molécule d'alcane de départ
Atome d'halogène CFCl3 Trichlorofluorométhane CFC-11 ou R-11 Méthane F + 3Cl CF2Cl2 Dichlorodifluorométhane CFC-12 ou R-12 Méthane 2F + 2Cl C2F3Cl3 Trichlorotrifluoroéthane CFC-113 Éthane 3F + 3Cl C2F4Cl2 Dichlorotétrafluoroéthane CFC-114 Éthane 4F + 2Cl C2F5Cl Chloropentafluoroéthane CFC-115 Éthane 5F + Cl - Portail de la chimie
Catégorie : Chlorofluorocarbure
Wikimedia Foundation. 2010.
