- Acide magique
-
Acide magique 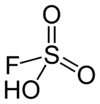
Composants de « l'acide magique. »Général Nom IUPAC acide fluorosulfurique - pentafluoro-λ5-stibane (1:1) No CAS No EINECS Propriétés chimiques Formule brute HF6O3SSb Masse molaire[1] 316,822 ± 0,007 g·mol-1
H 0,32 %, F 35,98 %, O 15,15 %, S 10,12 %, Sb 38,43 %,pKa -20 Précautions Directive 67/548/EEC[2] 
TPhrases R : 14, 23/24/25, 34, Phrases S : 26, 27, 36/37/39, 45, Transport[2] - 2922 SGH[2] 


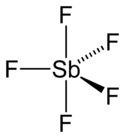
DangerUnités du SI & CNTP, sauf indication contraire. L’acide magique est un superacide de formule HFSO3·SbF5 et de pKa voisin de -20 résultant du mélange équimolaire d'acide fluorosulfurique HFSO3 et de pentafluorure d'antimoine SbF5. On l'appelle « magique » en référence au fait que cet acide est suffisamment fort pour protoner les hydrocarbures, ce qui a été spectaculairement illustré par J. Lukas, un chercheur postdoctoral allemand de l'équipe du chimiste américain George A. Olah (prix Nobel de chimie 1994), qui est parvenu à dissoudre une bougie dans ce mélange.
Sommaire
Propriétés et réactions chimiques
Un mélange HFSO3 - SbF5 1:1 conduit à l'espèce chimique HFSO3·SbF5, qui s'ionise presque totalement en H+ et [SbF5OSO2F]- :
- HFSO3·SbF5 → H+ + SbF6- + SO3
avec un pKa inférieur à -20[3] (par comparaison, celui l'acide sulfurique à 100 % est de l'ordre de -3).
Au contact de l'eau, l'acide magique s'hydrolyse de façon explosive en acide sulfurique H2SO4 et acide fluoroantimonique HSbF6, ce dernier étant le plus fort des superacides connus :
Olah et al. ont publié en mai 1968 la conversion du méthane CH4 en carbocation tert-butyle C+(CH3)3 par l'acide magique à 140 °C[4]. La réaction commence par la protonation du méthane en méthanium CH5+, qui se dissocie immédiatement en hydrogène H2 et méthylium CH3+, ce dernier réagissant à son tour avec le méthane restant :
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- SIGMA-ALDRICH
- (en) University of Memphis, Department of Chemistry – novembre 2010 « Section 8 Sykes CH5 electron deficient centers. » CHEM 43-6311, page 1.
- (en) George A. Olah, Richard H. Schlosberg, « Chemistry in super acids. I. Hydrogen exchange and polycondensation of methane and alkanes in FSO3H-SbF5 ("magic acid") solution. Protonation of alkanes and the intermediacy of CH5+ and related hydrocarbon ions. The high chemical reactivity of "paraffins" in ionic solution reactions », dans Journal of the American Chemical Society, vol. 90, no 10, mai 1968, p. 2726-2727 [texte intégral (page consultée le 16 novembre 2010)]
DOI:10.1021/ja01012a066
Voir aussi
Articles connexes
Liens externes
- (en) University of Southern California – 8 décembre 1994 « My search for carbocations and their role in chemistry, » par George A. Olah à l'occasion de son prix Nobel.
- (en) George A. Olah, « Crossing Conventional Boundaries in Half a Century of Research », dans Journal of Organic Chemistry, vol. 70, no 7, 2005, p. 2413-2429 [texte intégral (page consultée le 16 novembre 2010)]
DOI:10.1021/jo040285o
Catégories :- Composé de l'antimoine
- Produit chimique toxique
- Produit chimique corrosif
- Acide
Wikimedia Foundation. 2010.

