- Équimolaire
-
Mole (unité)
 Pour les articles homonymes, voir Mole.
Pour les articles homonymes, voir Mole.La mole (symbole : mol) est une unité de base du système international, apparue en 1971, qui est principalement utilisée en physique et en chimie. La mole est la quantité de matière d'un système contenant autant d'entités élémentaires qu'il y a d'atomes dans 12 grammes de carbone 12 ; son symbole est mol[1].
Une mole d’atomes contient environ 6,022×1023 d'atomes (une approximation plus correcte serait 6,02214179(30)×1023). Ce nombre est appelé constante d'Avogadro, son symbole est NA.
Formulé de manière plus compréhensible, la mole est une unité de comptage au même titre que la centaine, la vingtaine ou la douzaine, sauf que cette unité de comptage est immense (environ 600 000 millards de millards d'unités). De la même manière qu'il y a autant d'éléments dans une douzaine de pommes que dans une douzaine d'œufs, il y a le même nombre d'atomes dans une mole de carbone que dans une mole de plomb (ie. 602 214 millards de millards d'atomes).
Un échantillon de matière normal contient un très grand nombre d'atomes. Par exemple, 6 grammes d'aluminium contiennent environ 1,34×1023 atomes (134 000 000 000 000 000 000 000 atomes ; soit 134 mille milliards de milliards). Pour éviter l'utilisation d'aussi grands nombres, on a créé une unité de mesure, la mole (dans le cas présent 6 g d'aluminium représentent 0,22 mole d'atomes).
Sommaire
Multiples
multiples actuels : Préfixes du système international d'unités.Comme toutes les unités, les multiples de la mole sont décrits avec les préfixes du système international d'unités. Son sous-multiple le plus courant est la millimole (mmol) = 10-3 mol. Il est essentiel d'indiquer la nature des entités élémentaires : une mole d’atomes, de molécules, d'ions, d'électrons, d'autres particules, de groupes de particules…
10N Préfixe Symbole Nombre 1024 yottamole Ymol Quadrillion 1021 zettamole Zmol Trilliard 1018 examole Emol Trillion 1015 pétamole Pmol Billiard 1012 téramole Tmol Billion 109 gigamole Gmol Milliard 106 mégamole Mmol Million 103 kilomole kmol Mille 102 hectomole hmol Cent 101 décamole damol Dix 100 mole mol Un 10-1 décimole dmol Dixième 10-2 centimole cmol Centième 10-3 millimole mmol Millième 10-6 micromole μmol Millionième 10-9 nanomole nmol Milliardième 10-12 picomole pmol Billionième 10-15 femtomole fmol Billiardième 10-18 attomole amol Trillionième 10-21 zeptomole zmol Trilliardième 10-24 yoctomole ymol Quadrillionième Anciens multiples et sous-multiples de la mole 10N Préfixe Symbole Nombre en français Nombre en chiffre 104 myriamole mamol Dix mille 10 000 10-4 myriomole momol Dix-millième 0,000 1 Ordre de grandeur
Pour donner un ordre de grandeur, une mole de secondes représenterait un peu plus de 4 millions de fois l'estimation de l'âge de la Terre : ~19×1015 ans.
Une mole de grains de maïs éclaté permettrait de recouvrir la surface des États-Unis d'une couche uniforme d'une épaisseur d'environ 14 km.[2]
Toujours pour un ordre de grandeur, une mole de grains de sable de 0,1 mm (sable très fin) est contenue dans un volume de 10 km3, soit celui d'un cube de 2,15 km de côté. (cf: livre de référence.)
Formules
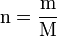
- n : quantité de matière en mol
- m : masse du composé en g
- M : masse molaire du composé en
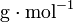
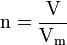
- n : quantité de matière en mol
- V : volume du gaz en L
- Vm : volume molaire du composé en
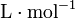
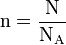
- n : quantité de matière en mol
- N : nombre d'entités chimiques (sans dimension).
- NA : nombre d'Avogadro (mol − 1)
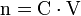
- n : quantité de matière en mol
- C : concentration molaire en
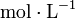
- V : volume du liquide en L
Notes et références
- ↑ Bureau international des poids et mesures, « Résolution 3 de la 14e CGPM (1971) »
- ↑ Chemistry & Chemical Reactivity de Kotz,Treichel et Weaver
Articles connexes
- Quantité de matière
- Concentration molaire
- Masse moléculaire
- Masse molaire
- Volume molaire
- Nombre d'Avogadro
Liens externes
- La mole sur le site math-sciences de l'académie de Rouen - Octobre 2001
- (histoire des sciences) le texte d'Avogadro (1811) à l'origine du Nombre d'Avogadro, en ligne et commenté sur le site BibNum.
- Portail de la chimie
- Portail de la physique
Catégories : Unité SI de base | Unité de chimie | Unité de mesure de quantité
Wikimedia Foundation. 2010.
