- Isomérisation
-
Isomérie
En chimie organique, on parle d'isomérie lorsque deux molécules possèdent la même formule brute mais ont des formules semi-développées ou des formules développées différentes. Ces molécules, appelées isomères, ont des propriétés physiques, chimiques et biologiques différentes.
Le terme isomérie vient du grec ίσος (isos = identique) et μερος (meros = partie).
L'isomérie a été remarquée la première fois en 1827, quand Friedrich Woehler a préparé l'acide cyanique (H-C=N=O) et a noté que, bien que sa composition élémentaire soit la même que celle de l'acide fulminique (H-N=C=O, préparé par Justus von Liebig l'année précédente), les propriétés chimiques de ces substances sont radicalement différentes. Cette découverte était en contraste avec les théories de l'époque dans le cadre desquelles l'on pensait que les propriétés d'une substance étaient entièrement déterminées par sa formule brute.
On distingue différentes isoméries, principalement les isoméries de constitution et de configuration (stéréoisomérie). Il y a aussi des isoméries de conformation.
Sommaire
Isomérie de constitution (ou de structure)
L'isomérie de constitution correspond aux isoméries désignant des enchaînements d'atomes différents. Des isomères de constitution ont pour seul point commun leur formule brute; ils ne sont pas constitués des mêmes fonctions chimiques.
Isomérie de chaîne
L'isomérie de chaîne désigne les isomères qui diffèrent par leur chaîne carbonée (squelette). Ces isomères sont caractérisées par leurs propriétés chimiques identiques et propriétés physiques différentes.
Exemple : C4H10
butane méthylpropane CH3-CH2-CH2-CH3 CH3-CH-CH3 | CH3Isomérie de position de fonction
L'isomérie de position de fonction qualifie les isomères dont un groupement fonctionnel est placé sur des carbones différents de la chaîne carbonée, qui veut dire que c'est la fonction qui se déplace à l'intérieur du squelette. Ces isomères sont caractérisés par leurs propriétés physiques différentes et chimiques légèrement différentes. On appelle ces isomères, des isomères de "position".
Exemple : C3H7OH
propan-1-ol propan-2-ol CH2-CH2-CH3 CH3-CH-CH3 | | OH OHIsomérie de nature de fonction
L'isomérie de nature de fonction caractérise les isomères dont les groupes fonctionnels sont différents, donc de propriétés physiques et chimiques différentes. On appelle ces isomères, des isomères de "fonction".
Exemple : C2H6O
éthanol méthoxyméthane CH3-CH2-OH CH3-O-CH3Isomérie d'insaturation
L'isomérie d'insaturation caractérise les isomère dont les insaturations sont différentes.
Exemple : C3H6
propène cyclopropane CH2=CH-CH3 H2C——CH2 \ / CH2Stéréoisomérie
La stéréoisomérie désigne les isomères de configuration, c'est-à-dire les molécules de constitution identique mais dont l'organisation spatiale des atomes est différente. On classe les isomères de configuration en deux grands groupes : les énantiomères et les diastéréoisomères.
Énantiomérie
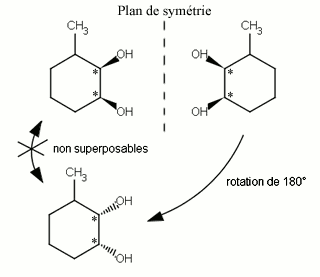
Aussi appelés isomères optiques, les énantiomères sont deux molécules qui sont l'image l'une de l'autre par un miroir et ne sont pas superposables : ils présentent en effet une chiralité. Elles ne sont pas symétriques, elles ne sont donc pas superposables à leurs images dans le miroir. L'exemple le plus concret de chiralité est celui d'une main droite non superposable sur une main gauche.
Exemples d'énantiomères ayant une efficacité clinique en médecine :
- lévodopa, forme lévogyre de la 3,4-dihydroxyphénylalanine : elle seule est métabolisable par l'organisme grâce à la L-dopadécarboxylase qui la transforme en dopamine ; la lévodopa est utilisée dans le traitement de la maladie de parkinson, permettant de diminuer les effets indésirables du mélange racémique[1].
- L-thyroxine, forme lévogyre de la Thyroxine, utilisée dans le traitement substitutif de l'insuffisance thyroidienne ; la D-thyroxine est peu efficace et cardiotoxique[1].
- dextropropoxyphène a des effets antalgiques ; le lévopropoxyphène est utilisé comme antitussif[1].
Diastéréoisomérie
Les diastéréoisomères (que l'on écrit aussi diastéréo-isomères) sont les stéréoisomères qui ne sont pas énantiomères.
Diastéréoisomérie de configurations Z et E
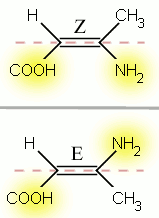 configurations Z et E de l'acide 3-aminobut-2-ènoïque
configurations Z et E de l'acide 3-aminobut-2-ènoïqueLorsque, sur chacun des deux côtés d'une double liaison, on trouve deux groupes différents, on distingue deux configurations : Z et E. La libre rotation autour de la double liaison n'est pas possible, du fait de la présence d'une liaison π : il en résulte une molécule plane ayant deux configurations possibles.
En utilisant l'ordre de priorité d'après la convention CIP (Cahn, Ingold, Prelog) on définit les deux isoméries ainsi :
- La configuration Z caractérise les diastéréoisomères dont les groupes prioritaires sont du même côté du plan formé par la double liaison (et perpendiculaire au plan de la molécule). L'abréviation Z vient de l'allemand zusammen qui signifie « ensemble ».
- La configuration E caractérise les diastéréoisomères dont les groupes prioritaires sont du côté opposé l'un de l'autre par le plan formé par la double liaison. Le terme E vient de l'allemand entgegen qui signifie « opposé ».
exemple : l'acide 3-aminobut-2-ènoïque, ci-contre. Les priorités sont COOH > H et NH2 > CH3. On a donc dans le premier cas les groupes prioritaires du même côté du plan : c'est donc la représentation de l'acide (Z)-3-aminobut-2-ènoïque. À l'inverse, dans la seconde représentation, les groupes prioritaires sont opposés : la molécule représentée est donc l'acide (E)-3-aminobut-2-ènoïque.
De manière générale, les configurations Z sont plus rares car les groupements prioritaires (souvent les plus volumineux) sont déstabilisés par leur encombrement stérique. Mais certaines configurations peuvent être stabilisées, notamment par chélation.
NB : On utilise moins les termes cis et trans qui qualifient plutôt des positions relatives de groupements sans tenir compte de leur priorité. Par exemple, sur l'illustration de la configuration E, on dira que le H est en trans du CH3, et que le H est en cis du NH2.
Autres types
Il y a diastéréoisométrie entre deux molécules isomères possédant même enchaînement de liaison, qui comportent deux ou plusieurs centres de chiralité (des atomes portant 4 substituants différents) et qui ne sont pas des énantiomères[2]. Exemple : les formes (R)-(S) et (R)-(R) de l'acide tartrique sont des diastéréomères et possèdent des propriétés physiques différentes.
Conformérie
Ces isomères ont une même formule développée. Ils ne se différencient que par rotation autour d'une liaison simple (liaison sigma), sans la rompre. Par exemple le butane (C4H10) a trois conforméres.
Épimérie
Deux épimères ne diffèrent entre eux que par la configuration absolue d'un seul carbone asymétrique, comme par exemple entre le D-mannose et le D-glucose ou encore entre le D-glucose et le D-galactose.
Anomérie
C’est un cas particulier d’épimèrie pour le carbone 1 des oses. Il permet de décrire notamment la convention α et β. Si la fonction hydroxyle du carbone 1 est en-dessous du plan (représentation de Haworth), l’ose est dit α (alpha) alors que si l’hydroxyle du carbone 1 est au-dessus du plan, l’ose est dit β (béta).
Exemple : α-glucose : sur l'image, le carbone 1 est à droite et la fonction hydroxyle n'est ni en haut ni en bas (il faudrait choisir pour avoir du α ou β).
Cette nomenclature est très importante pour décrire les liaisons chimiques contractées dans les disaccharides et les polysaccharides.
Exemple : le saccharose (α-D-glucopyrannosyl(1→2)β-D-fructofurannoside) est un dissacharide formé d'α-glucose et d'β-fructose liés en α1-2.
Notes et références
- ↑ a , b et c Revue Prescrire, n°295, Mai 2008
- ↑ http://www.educnet.education.fr/rnchimie/chi_org/viollon/stereo.pdf
Voir aussi
Liens externes
- Isomérie sur le Wiktionnaire
- http://www.faidherbe.org/site/cours/dupuis/regcip.htm
Isomérie en chimie organique Isomèrie de constitution squelette - position - fonction Stéréoisomérie chiralité - carbone asymétrique - stéréocentre - activité optique - configuration absolue
énantiomérie (mélange racémique) - diastéréoisomérie - diastéréoisomérie géométrique - anomérie
synthèse asymétrique - stéréosélectivité - stéréospécificitéAutres conformérie - mésomérie - tautomérie - Portail de la chimie
Catégories : Stéréochimie | Isomérase
Wikimedia Foundation. 2010.