- Cycloocta-1,5-diène
-
Cycloocta-1,5-diène 
Général Nom IUPAC Cycloocta-1,5-diène No CAS No EINECS PubChem SMILES InChI Propriétés chimiques Formule brute C8H12 [Isomères] Masse molaire[2] 108,1809 ± 0,0072 g·mol-1
C 88,82 %, H 11,18 %,Susceptibilité magnétique χM 71,5 ± 0,7×10-6 cm3·mol-1[1] Propriétés physiques T° fusion -70 °C[3] T° ébullition 150 °C[3] Solubilité 0,480 g·l-1 (eau, 20 °C)[3] Masse volumique 0,88 g·cm-3[3] Point d’éclair 31 °C (coupelle fermée)[3] Pression de vapeur saturante 6,5 mbar à (20 °C)
27 mbar à (50 °C)[3]Thermochimie S0liquide, 1 bar 250 J·K-1·mol-1 [4] ΔfH0gaz 57 kJ·mol-1 [4] ΔfH0liquide 24 kJ·mol-1 [4] ΔfusH° 9,83 kJ·mol-1 à -69,15 °C [4] ΔvapH° 33,0 kJ·mol-1 [4] Cp 198,9 J·K-1·mol-1 (liquide,25 °C)
230,95 J·K-1·mol-1 (gaz,226,85 °C)[4]PCI -4 887 kJ·mol-1 [4] Précautions Directive 67/548/EEC[3] 
XiPhrases R : 10, 19, 36/38, 43, Phrases S : 26, 36, Transport[3] 30 2520 NFPA 704[6] Écotoxicologie LogP 3,16[3] Unités du SI & CNTP, sauf indication contraire. Le cycloocta-1,5-diène est un composé organique de formule C8H12. En général noté COD, ce diène est un précurseur d'autre composés organiques et sert de ligand en chimie organométallique[7],[8].
Sommaire
Production et synthèse
Le cycloocta-1,5-diène peut être préparé par dimérisation du butadiène en présence d'un catalyseur au nickel, la réaction produisant un autre produit, le 4-vinylcyclohexène. Approximativement 10 000 tonnes de cycloocta-1,5-diène furent produites en 2005[9].
Propriétés physico-chimniques
Réactions organiques
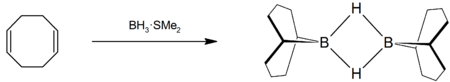
Le COD réagit avec le borane pour former le 9-borabicyclo(3.3.1)nonane[10], appelé couramment 9-BBN, un réactif en chimie organique utilisé pour des hydroborations:
Le COD additionné de SCl2 (ou de réactifs similaires) donne le 2,6-dichloro-9-thiabicyclo[3.3.1]nonane[11]:
Le composé dichloré résultant peut par la suite être transformé en diazoture or dicyanure correspondant, par une substitution nucléophile.
Complexes métalliques
Le COD-1,5 se lie en général à des métaux à faible valence, via ses deux double liaisons. Le complexe Ni(COD)2 est un précurseur de plusieurs complexes de nickel(0) et Ni(II). Les complexes métal-COD sont intéressants car ils sont suffisamment stables pour être isolés, et sont en général plus résistants que leur équivalent éthylénés. La stabilité des complexes du COD est attribuée à l'« effet chélate ». Les ligands COD peuvent être facilement remplacés par d'autres ligands, par exemple des phosphines.
Le Ni(COD)2 est préparé par réduction d'acétylacétonate de nickel anhydre en présence de COD, et de triéthylaluminium[12] :
- 1/3 [Ni(C5H7O2)2]3 + 2 COD + 2 Al(C2H5)3 → Ni(COD)2 + 2 Al(C2H5)2(C5H7O2) + C2H4 + C2H6
L'équivalent Pt(COD)2 est préparé par une voie plus détournée, utilisant par le cyclooctatétraène de dilithium[13] :
- Li2C8H8 + PtCl2(COD) + 3 C7H10 → [Pt(C7H10)3] + 2 LiCl + C8H8 + C8H12
- Pt(C7H10)3 + 2 COD → Pt(COD)2 + 3 C7H10
Un travail important a été mené sur les complexes de COD, dont la majorité est décrite dans les volumes 25 , 26 et 28 de Inorganic Syntheses. Le complexe du platine a été utilisé dans de nombreuses synthèses:
- Pt(COD)2 + 3 C2H4 → Pt(C2H4)3 + 2 COD
Les complexes de COD sont utiles comme composés de départ, un exemple remarquable étant la réaction :
- Ni(cod)2 + 4 CO(g)
 Ni(CO)4 + 2 COD
Ni(CO)4 + 2 COD
Le produit Ni(CO)4 est un composé très toxique, qui peut donc être avantageusement créé in situ plutôt que d'être injecté dans le milieu réactionnel.
On peut notamment citer comme cas complexes du COD impliquant des métaux à faible valence, le Mo(COD)(CO)4, le [RuCl2(COD)]n, ou le Fe(COD)(CO)3.
Le COD est particulièrement important dans la chimie de coordination du rhodium(I) et de l'iridium(I), comme dans le catalyseur de Crabtree ou le dimère cholure de rhodium cyclooctadiène.
Il existe aussi des complexes carrés plan de [M(COD)2]+ (M = Rh, Ir).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 1,5-Cyclooctadiene » (voir la liste des auteurs)
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », dans Journal of the American Chemical Society, vol. 91, no 8, 9 avril 1968, p. 1991-1998
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 111-78-4 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20/01/10 (JavaScript nécessaire)
- (en) « 1,5-Cyclooctadiene » sur NIST/WebBook, consulté le 21 janvier 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-859-4)
- UCB Université du Colorado
- Buehler, C; Pearson, D.Survey of Organic Syntheses. Wiley-Intersciene, New York. 1970.
- Shriver, D; Atkins, P.Inorganic Chemistry. W. H. Freeman and Co., New York. 1999.
- Thomas Schiffer, Georg Oenbrink « Cyclododecatriene, Cyclooctadiene, and 4-Vinylcyclohexene » in Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim.
- John A. Soderquist and Alvin Negron (1998). "9-Borabicyclo[3.3.1]nonane Dimer". Org. Synth.; Coll. Vol. 9: 95.
- Roger Bishop. "9-Thiabicyclo[3.3.1]nonane-2,6-dione". Org. Synth.; Coll. Vol. 9: 692. Díaz, David Díaz, « 2,6-Dichloro-9-thiabicyclo[3.3.1]nonane: Multigram Display of Azide and Cyanide Components on a Versatile Scaffold », dans Molecules, vol. 11, 2006, p. 212–218 [texte intégral, lien DOI]
- Schunn, R; Ittel, S., « Bis(1,5-Cyclooctadiene) Nickel(0) », dans Inorg. Synth., vol. 28, 1990, p. 94 [lien DOI]
- Crascall, L; Spencer, J., « Olefin Complexes of Platinum », dans Inorg. Synth., vol. 28, 1990, p. 126 [lien DOI]
Catégories :- Produit chimique irritant
- Cycloalcène
Wikimedia Foundation. 2010.






![2,6-Dichloro-9-thiabicyclo[3.3.1]nonane, synthèse et and réactions](/pictures/frwiki/52/450px-CODSCl2.png)
