- 119-36-8
-
Salicylate de méthyle
Salicylate de méthyle 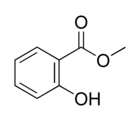
Structure du salicylate de méthyle. Général Nom IUPAC 2-hydroxybenzoate de méthyl Synonymes ortho-hydroxybenzoate de méthyl No CAS No EINECS FEMA Apparence liquide incolore ou jaune à rouge, huileux, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C8H8O3 [Isomères] Masse molaire 152,1473 g∙mol-1
C 63,15 %, H 5,3 %, O 31,55 %,Propriétés physiques T° fusion -8,6 °C[1] T° ébullition 222 °C[1] Solubilité dans l'eau à 20 °C : 0.07 g/100 ml[1] Masse volumique (eau = 1) : 1.18[1] T° d’auto-inflammation 451 °C[1] Point d’éclair 96 °C (c.f.)[1] Pression de vapeur saturante à 20 °C : 6 Pa[1] Précautions NFPA 704 SIMDUT[2] 
Écotoxicologie LogP 2.55[1] Unités du SI & CNTP, sauf indication contraire. Le salicylate de méthyle (Formule semi-développée C6H4(HO)COOCH3) aussi appelé ester de méthyle d'acide salicylique est très utilisé comme parfums et comme arôme alimentaire sous le nom d’essence de Wintergreen. Son odeur est très forte et très appréciée. Il est aussi prisé pour ses propriétés analgésiques et antipyrétiques.
Sommaire
Biologie
Le salicylate de méthyle peut être toxique lorsqu'il est absorbé et on considère que cette substance a évolué pour créer une défense anti-insecte-herbivores chez les plantes. Outre cette toxicité, cette molécule phéromone sert à prévenir les autres plantes de menaces comme celle que représente le Virus mosaïque du tabac (voir [3]). Lorsque la plante est infestée par des insectes herbivores, la libération de salicylate de méthyle fonctionne comme exophéromone et attire des insectivores (PMID 15537163). De nombreuses plantes produisent du salicylate de méthyle en petite quantité.
Les plantes qui génèrent cette molécule en quantité détectable :
- La plupart des espèces de la famille des Pyrolaceae, et particulièrement dans le genre Pyrola.
- Quelques espèces du genre Gaultheria dans la famille des Ericaceae.
- Quelques espèces du genre Betula dans la famille des Betulaceae, particulièrement celles du sous genre Betulenta.
- Alors qu'ils surveillaient les composés organiques volatils (COV) émis par une noyeraie, en Californie, des scientifiques du National Center for Atmospheric Research (NCAR) ont découvert par hazard la présence de salicylate de méthyle. Celui-ci est émis par les feuilles des noyers lorsque les arbres répondent à une situation de stress : sécheresse, attaque d'insectes, températures anormales pour la saison ... [4].
Production commerciale
La synthèse du salicylate de méthyle, exécutée pour la première fois en 1886, se fait à partir de la réaction d'estérification du méthanol et d'acide salicylique.
Aujourd'hui, l'acide salicylique est synthétisé artificiellement, mais autrefois il était communément obtenu par distillation du bouleau flexible (Betula lenta) et de la gaulthérie couchée (Gaultheria procumbens).
Usages
Il est très utilisé dans le domaine des parfums et dans l'alimentation pour aromatiser. Son odeur est très forte et très appréciée. On parle de pomme sûre.
Il est également utilisé pour ses propriétés de fluorescence, en convertissant les ultraviolets en lumière bleue visible.
Il est aussi prisé pour ses propriétés analgésiques et antipyrétiques.
On l'utilise également dans la fabrication de rouge à lèvres.
Toxicité
Le salicylate de méthyle peut être mortel aussi bien en usage interne qu’externe. Une dose de 5 ml (une cuillère à café) peut être fatale à un enfant [5].
Utilisé en pommade ou vaporisateur, il est potentiellement mortel.
Notes et références
- ↑ a , b , c , d , e , f , g , h et i SALICYLATE DE METHYLE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Salicylate de méthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ (en) Airborne signalling by methyl salicylate in plant pathogen resistance
- ↑ (en)Walnut Trees Emit Aspirin-Like Chemical to Deal With Stress sur National Geographic, septembre 2008
- ↑ (en)Methyl salicylate overdose
Liens externes
- Portail de la chimie
- Portail de la botanique
- Portail de la biochimie
Catégories : Phénol | Benzoate d'alkyle | Arôme | AINS
Wikimedia Foundation. 2010.