- 119-61-9
-
Benzophénone
Benzophénone 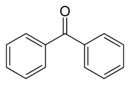
Structure 2D de la benzophénone Général Nom IUPAC diphénylméthanone Synonymes diphénylcétone
Benzoylbenzène
PhénylcétoneNo CAS No EINECS DrugBank PubChem FEMA SMILES InChI Apparence cristaux blancs dont l'odeur rappelle la rose.[1] Propriétés chimiques Formule brute C13H10O [Isomères] Masse molaire 182,2179 g∙mol-1
C 85,69 %, H 5,53 %, O 8,78 %,Propriétés physiques T° fusion 49 °C [2] T° ébullition 305 °C [2] Solubilité 137 mg∙l-1 (eau, 25 °C) [3] Masse volumique 1,146 g∙cm-3 à 20 °C [2] T° d’auto-inflammation 560 °C [2] Point d’éclair 150 °C [2] Thermochimie ΔfH0gaz 49,9 J∙K-1∙mol-1 [4] ΔfH0solide -34 kJ∙mol-1 [4] ΔfusH° 18,194 kJ∙mol-1 à 47,9 °C [4] ΔvapH° 94,977 kJ∙mol-1 [4] Cp 224,8 J∙K-1∙mol-1 à 26,9 °C [4] PCI -6 508 kJ∙mol-1 [4] Précautions Directive 67/548/EEC 
Xi
NPhrases R : 36/37/38, 50/53, Phrases S : 26, 29, 37/39, 61, Transport 90 3077 SIMDUT[5] Produit non contrôlé Écotoxicologie DL50 10 g/kg (rat, oral)
2,895 g/kg (souris, oral) [3]LogP 3.38[1] Unités du SI & CNTP, sauf indication contraire. La benzophénone est une cétone bicyclique de formule brute C13H10O1. Ce composé est utilisé dans les encres et les vernis UV d'imprimerie, comme intermédiaire pour la synthèse de composés pharmaceutiques et agrochimiques et dans l'industrie des parfums [6].
Utilisation
Ce composé est utilisé comme photo-initiateur UV pour la polymérisation des encres[6].
En chimie, elle sert à assécher, désoxygéner en association avec le sodium des solvants aprotiques avant distillation pour synthèse. Elle forme avec le sodium, un radical (C6H5)2C∙-O− qui réagit avec l'eau et l'oxygène et aussi avec les peroxydes d'éther en les éliminant. Ce radical est d'une belle couleur violet foncé qui quand elle est observée, garantit que tous les peroxydes, eau et O2 ont été éliminés.
Production et synthèse
La principale voie de synthèse est l'oxydation en présence d'air du diphénylméthane à l'aide de catalyseur métallique tel le naphténate de cuivre. D'autres voies utilisent le benzène et le chlorure de benzoyle via une acylation de Friedel-Crafts ou encore le benzène et le phosgène[6].
Notes et références
- ↑ a et b BENZOPHENONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d et e Entrée de « Benzophenone » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 février 2009 (JavaScript nécessaire)
- ↑ a et b (en) « Benzophenone » sur ChemIDplus, consulté le 23 février 2009
- ↑ a , b , c , d , e et f Benzophenone sur http://www.nist.gov/. Consulté le 23 février 2009
- ↑ « Benzophénone » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ a , b et c Hardo Siegel, Manfred Eggersdorfer, Ullmann's Encyclopedia of Industrial Chemistry, Ketones, Wiley-VCH Verlag GmbH & Co, 2002
- Portail de la chimie
Catégories : Produit chimique irritant | Produit chimique dangereux pour l'environnement | Benzophénone
Wikimedia Foundation. 2010.

