- Chaleur Latente
-
Enthalpie de changement d'état
L'enthalpie de changement d'état, molaire ou massique, correspond à la quantité de chaleur nécessaire à l'unité de quantité de matière (mole) ou de masse (kg) d'un corps pour qu'il change d'état; cette transformation ayant lieu à pression constante. Par exemple pour le passage de l'état liquide à l'état de vapeur on parlera d'enthalpie de vaporisation.
L'enthalpie échangée lors du changement d'état résulte de la modification (rupture ou établissement) de liaisons interatomiques ou intermoléculaires. Il existe trois états physiques principaux pour tout corps pur: l'état solide, l'état liquide et l'état gazeux. Les liaisons sont plus fortes dans l'état solide que dans l'état liquide et ces liaisons sont quasi-absentes dans l'état gazeux. Il existe un quatrième état obtenu à très haute température où la matière se trouve sous la forme d'un plasma d'ions et d'électrons.
Par exemple, l'eau bout à 100 °C sous la pression d'1 atmosphère ( 1atm = 101325 Pascal). L'enthalpie de vaporisation de l'eau, égale à la quantité de chaleur fournie pour transformer l'eau liquide en vapeur, est de 2257 kJ/kg.
Enthalpies de changement d'état de diverses substances
Corps simples
solidesEnthalpie de fusion
kJ/kgvaporisation
kJ/kgAluminium 393 Antimoine 163 1340 Argent 103 2160 Béryllium 1339 Bismuth 43 858 Cadmium 45 1004 Calcium 2430 Césium 16 Chrome 316 Cobalt 259 Cuivre 205 4650 Étain 59 2600 Fer 207 Gallium 80 Lithium 137 Magnésium 369 8450 Manganèse 101 Nickel 298 Palladium 152 Phosphore blanc 21 540 Platine 114 Plomb 23 920 Rubidium 26 Sélénium 56 Soufre clinorhombique 39 Thallium 15 Tellure 31 Zinc 96 1820 Autres substances Azote 3219 Méthane 510 Éthane 489 Propane 426 Butane 385 Pentane 357 Isopentane 339 n-Hexane 337 n-Heptane 320 n-Octane 306 Éthylène 483 Propylène 438 But-1-ène 391 Isobutène 394 Cyclopentane 390 Cyclohexane 358 Acétylène 829 Benzène 394 Toluène 363 o-Xylène 347 Cumène 312 Méthanol 1100 Éthanol 855 Propanol 695 Isopropanol 667 n-Butanol 591 Acétaldéhyde 570 Acétone 521 Silane 342 Diéthyléther 377 Essence automobile 335 Eau 330 2256 Ammoniac 1391 Dans le tableau ci-contre, la chaleur de vaporisation correspond à la température d'ébullition du corps sous une pression égale à l'atmosphère au niveau de la mer (101,3 kPa).
Changement d'état
Au cours d'un changement d'état d'un corps pur, il y a une variation d'enthalpie et d'entropie du corps. Par exemple pour un corps de masse m passant de l'état 1 à l'état 2 à la température T0
- ΔH1,2 = mL1,2 et
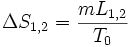
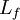 Chaleur latente massique exprimée en J/kg
Chaleur latente massique exprimée en J/kg- ΔH1,2 Variation d'enthalpie en J
- ΔS1,2 Variation d'entropie en J/K
- m masse en kg
- T0 Température en K
La chaleur latente massique de fusion des métaux est comprise entre 4 et 16 kJ/(mol.K), sauf rare exception. Cette règle permet de connaître une valeur approchée de l'enthalpie de fusion, connaissant la température de fusion :
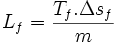
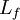 chaleur latente massique exprimée en J/kg
chaleur latente massique exprimée en J/kg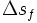 variation d'entropie molaire lors de la fusion en J/(mol.K)
variation d'entropie molaire lors de la fusion en J/(mol.K)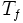 température de fusion en K
température de fusion en K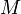 masse en kg
masse en kgEnthalpie de fusion
Article détaillé : Enthalpie de fusion.L'enthalpie de fusion est l'énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l'état solide à l'état liquide à température et pression constantes.
Enthalpie de vaporisation
Article détaillé : Enthalpie de vaporisation.L'enthalpie de vaporisation d'un composé chimique est la différence d'enthalpie mise en jeu lors de la vaporisation d'une mole de ce composé.
Enthalpie de sublimation
Article détaillé : Enthalpie de sublimation.L'enthalpie de Sublimation, ou chaleur latente de Sublimation, est l'énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l'état solide à l'état gazeux à température et pression constantes.
Histoire
On nommait autrefois chaleur latente cette grandeur, en référence à la vision substantialiste de la chaleur (considérée comme un fluide, une substance, immatérielle) qui était largement répandue jusqu'au XIXe siècle avec notamment les travaux de Joseph Fourier sur cette dernière.
Voir aussi
- Chaleur massique
- Enthalpie
- Enthalpie de fusion
- Enthalpie de vaporisation
- Enthalpie de sublimation
- Règle de Trouton (calcul empirique de l'enthalpie de vaporisation)
- Formule de Clapeyron
- Chaleur
- Calorimétrie
Référence
"Carburants et moteurs", J-C Guibet, Publication de l'Institut Français du Pétrole, ISBN 2-7108-0704-1
- Portail de la physique
- Portail de la chimie
Catégories : Grandeur physique | Thermodynamique | Thermochimie - ΔH1,2 = mL1,2 et
Wikimedia Foundation. 2010.
