- C8H11N5O3
-
Aciclovir
Aciclovir 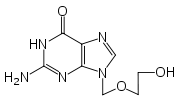
Général Nom IUPAC 2-amino-9-((2-hydroxyethoxy)methyl)
-1H-purin-6(9H)-oneSynonymes Acycloguanosine No CAS No EINECS Code ATC PubChem Propriétés chimiques Formule brute C8H11N5O3 [Isomères] Masse molaire 225,2046 g∙mol-1
C 42,67 %, H 4,92 %, N 31,1 %, O 21,31 %,Précautions Classification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[1] Classe thérapeutique Antiviral antiherpétique Données pharmacocinétiques Biodisponibilité 10 - 20 % (orale) Liaison protéique 9 - 33 % Métabolisme Thymidine kinase virale Demi-vie d’élim. 2,2 à 20 h Excrétion Urinaire Considérations thérapeutiques Voie d’administration Orale
IV
topiqueUnités du SI & CNTP, sauf indication contraire. L'aciclovir (DCI), commercialisé sous le nom de Zovirax® ou Activir®, est l'un des principaux médicaments antiviraux. Sa découverte a été sentie comme le début d'une nouvelle ère dans la thérapie antivirale, du fait de sa très grande spécificité et de sa faible cytotoxicité. Cependant, l'aciclovir a un champ d'action très restreint, uniquement efficace contre certains virus comme l'HSV-1 et 2, et le VZV, avec une efficacité limitée contre le Virus d'Epstein-Barr (Epstein-Barr virus EBV) actif, et il agit à peine contre la forme humaine du cytomegalovirus (CMV). Il agit environ 10 fois plus contre l'HSV que contre le VZV. Il ne supprime pas le virus de l'herpès, et n'est pas très efficace contre l'herpès génital chez la femme. L'aciclovir est différent des autres analogues nucléosidiques car il comporte uniquement une structure partielle de nucléoside, le sucre cyclique étant remplacé par une chaîne ouverte.
Sommaire
Mode d'action
L'aciclovir est converti en forme monophosphate, aciclo-GMP, par la thymidine kinase virale, qui est bien plus efficace (3000 fois) dans la phosphorylation que la thymidine kinase cellulaire. Ensuite, la forme monophosphate est phosphorylée en forme active triphosphate, aciclo-GTP, par des kinases cellulaires. L'aciclo-GTP est un très puissant inhibiteur de l'ADN polymérase virale ; il a approximativement 100 fois plus d'affinité avec la polymérase virale que la polymérase cellulaire. La forme monophosphate de l'aciclovir agit aussi en s'incorporant dans l'ADN viral durant sa réplication, bloquant la polymérisation de ce dernier, les enzymes virales ne pouvant pas cliver l'aciclo-GMP de la chaîne protéique de l'ADN. L'aciclo-GTP est très vite métabolisé dans la cellule, probablement par des phosphatases cellulaires.
Pharmacocinétique
L'aciclovir est peu soluble dans l'eau, et n'est que partiellement absorbé lors de la prise par voie orale (20%). Lors de la prise par voie orale, le pic de concentration plasmatique est atteint en 1 à 2 heures. Si de fortes doses sont nécessaires, l'administration doit être faite par voie intraveineuse. L'aciclovir bénéficie d'une haute distribution, seulement 30% est fixé à des protéines dans le plasma sanguin.
La demi-vie du produit est d'environ 3h.
Pour pallier la faible absorption de l'aciclovir sous forme orale, on utilise actuellement une pro-drogue de l'aciclovir : le valaciclovir.
Le valaciclovir se transforme en aciclovir au niveau de la paroi intestinale. Le valaciclovir (Zelitrex®) permet une meilleure observance du traitement et un plus grand confort du malade en permettant 1 prise par jour là où l'aciclovir (Zovirax®) en exige 5.L'aciclovir peut aussi être administré localement (pommade) pour le traitement d'infections herpétiques cutanées ou des muqueuses, comme l'herpès génital ou l'herpès labial. (cold sore)
L'administration prophylactique est possible, notamment chez les patients sous immunosuppresseurs ou radiothérapie ou pour les patients souffrant de poussées fréquentes d'herpès labial ou génital.Métabolisme - Élimination
L'élimination de l'aciclovir se fait via le système rénal, en partie par filtration glomérulaire, et en partie par sécrétion tubulaire.
Des problèmes rénaux ont été rapportés lors de l'administration rapide de fortes doses par voie intraveineuse, ceci à cause de la cristallisation de l'aciclovir dans les néphrons.Effets secondaires - Contre-indications
Étant donné que l'aciclovir peut être incorporé dans l'ADN cellulaire, il est un mutagène de chromosome, de ce fait, sa prescription doit être évitée chez la femme enceinte. Cependant, il n'a jamais montré d'effet tératogène ou carcinogène.
Le seuil de toxicité (LD50) de l'aciclovir lors de l'administration par voie orale dépasse les 1mg/kg, à cause de la faible absorption par le tractus gastro-intestinal. Des cas isolés ont été rapportés, où des doses extrêmement hautes (jusqu'à 80mg/kg) ont été accidentellement administrées par voie intraveineuse, sans causer d'effets secondaires.
Les effets indésirables les plus courants sont une irritation locale ou une sensation de piqûre ou de brûlure au niveau de la zone d'application de la pommade, et des céphalées lors de la prise par voie orale.
La résistance à l'aciclovir évolue assez rapidement, bien que ceci ne gêne pas son utilisation clinique. Les formes résistantes sont le plus souvent des virus ayant subi une mutation de leur thymidine kinase ou de leur ADN polymérase.Indications
- Herpès labial (et prophylaxie)
- Herpès genital (et prophylaxie)
- Kératite herpétique
- Herpès zoster (Zona)
- Varicelle
Références
- Harvey Stewart C. in Remington’s Pharmaceutical Sciences 18th edition: (ed. Gennard, Alfonso R.) Mack Publishing Company, 1990. ISBN 0912734043.
- Huovinen P., Valtonen V. in Kliininen Farmakologia (ed. Neuvonen et. al.). Kandidaattikustannus Oy, 1994. ISBN 9518951098.
- Périgaud C., Gosselin G., Imbach J. -L.: Nucleoside analogues as chemotherapeutic agents: a review. Nucleosides and nucleotides 1992; 11(2-4)
- 20. Rang H.P., Dale M.M., Ritter J.M.: Pharmacology, 3rd edition. Pearson Professional Ltd, 1995. 2003 (5th) edition ISBN 0443071454; 2001 (4th) edition ISBN 0443065748; 1990 edition ISBN 0443034079.
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- Portail de la médecine
- Portail de la pharmacie
Catégorie : Médicament contre les virus herpétiques
Wikimedia Foundation. 2010.

